优化多重PCR检测Duchenne muscular dystrophy基因外显
白春英,于晓明,史铁伟,瑞云
(1.赤峰学院医学院分子医学研究中心;2.赤峰学院第一附属医院,内蒙古 赤峰 024000)
优化多重PCR检测Duchenne muscular dystrophy基因外显
白春英1,于晓明2,史铁伟1,瑞云1
(1.赤峰学院医学院分子医学研究中心;2.赤峰学院第一附属医院,内蒙古 赤峰 024000)
白春英,女,蒙古族,2008年3月毕业于日本岐阜大学医学系,获医学博士学位。研究方向为分子生物学检验技术。2008年9月进入赤峰学院医学院工作,现任医学院分子医学研究中心主任,副教授。承担《临床分子生物学检验技术》、《医用生物学》、《细胞生物学》和《医学遗传学》及公选课《常见遗传病的特征及分子基础》等教学工作。
目的:介绍一种快速简便地优化多重PCR检测DMD基因外显子缺失的方法及详细步骤.方法:采2m l外周血,用0.2%氯化钠处理收集白细胞,再用基因组DNA提取试剂盒抽提基因组DNA,用优化的多重PCR法直接检测DMD基因外显子的缺失.结果:用该方法检测DMD基因外显子缺失结果准确清晰.结论:用优化的多重PCR技术可以直接检测DMD基因外显子缺失,跟通常使用的9对引物一步法相比,具有经济、快速、简便等特点.
优化;多重PCR;Duchenne muscular dystrophy(DMD);缺失
杜氏肌营养不良(Duchennemuscular dystrophy,DMD)是最常见的X染色体连锁隐性遗传性肌肉疾病,发病率为1/3 500个男孩.患儿的主要表现为进行性骨骼肌无力和萎缩,由于臀中肌无力而行走时呈鸭步,因腹肌和腰肌无力而致下蹲起立时出现高尔斯征(Gower’s sign).病情中后期呈明显的全身肌肉萎缩,60%-90%的患儿伴有心肌受累,最终于20岁左右因心肌、呼吸肌萎缩导致心肺功能衰竭而死亡. DMD基因位于X染色体上,全长2500kb,有79个外显子. DMD基因突变以缺失为主,占DMD基因突变的55%-65%,主要分布在基因的上游和中部区域.多重PCR(multiplexPCR)是在同一扩增反应体系中加入一对以上的引物,对一个DNA样品中多个靶序列片段进行同时扩增.当被检基因较大、突变位点较多时,用多重PCR能够在一个扩增反应中同时检测出多个突变.
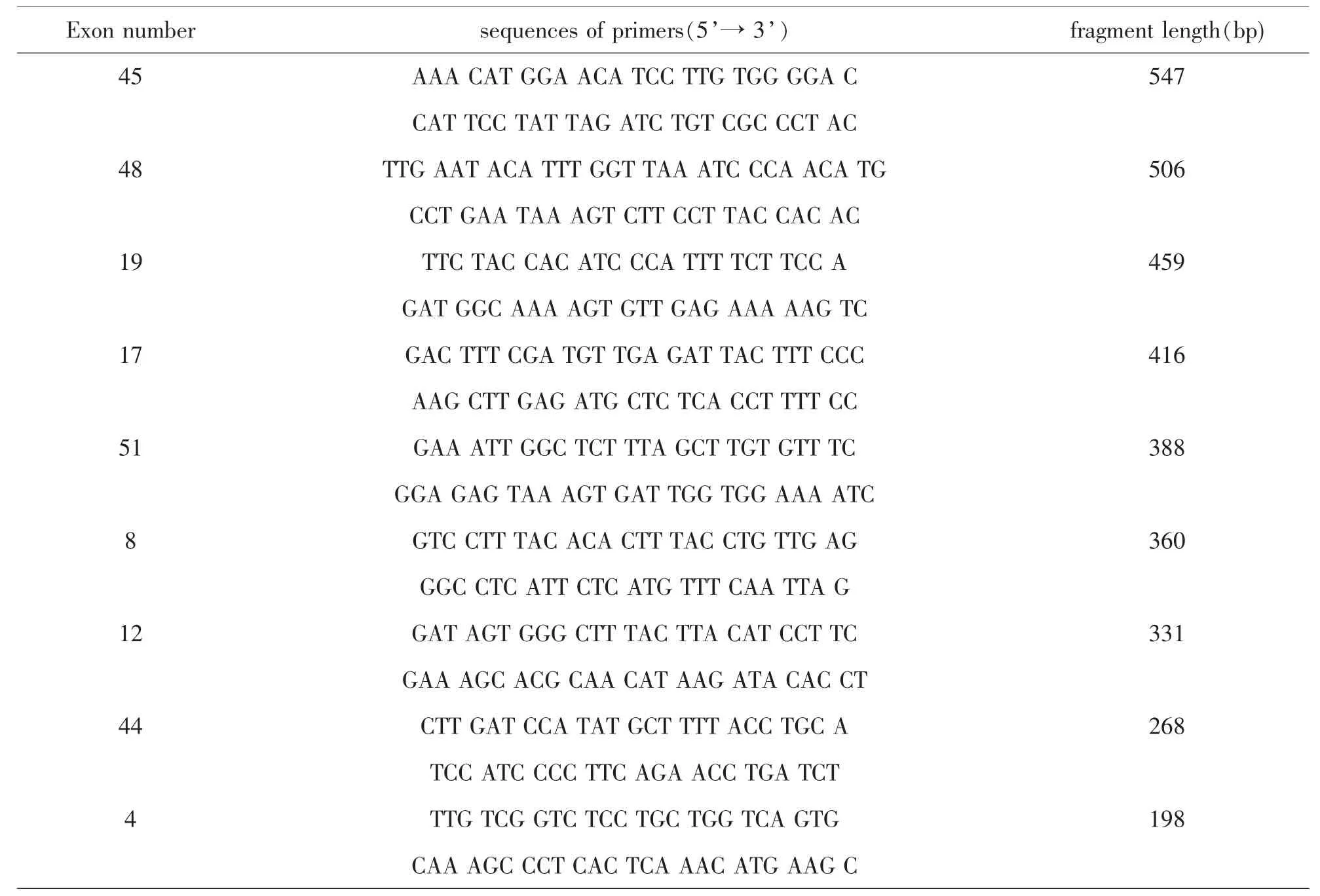
表1 引物序列及扩增产物片段大小
1 材料与方法
1.1 引物合成与稀释
[1]合成DMD基因9个常见的缺失外显子(4,8,12,17,19,44,45,51)(北京赛百盛公司).9对引物在DMD基因中的位置、序列和扩增产物片段的大小见表1(按扩增产物片段大小排列).优化前,我们将9对引物制备成混合液,使每条引物的终浓度为0.5μmol/L.
1.2 模板的制备
采正常对照、患儿及其母亲外周血各2ml-3ml,用0.2%氯化钠处理收集白细胞,再用基因组DNA提取试剂盒抽提基因组DNA,具体方法见参考文献[2].检测基因组DNA的浓度和纯度,使模板的浓度为100-150ng/μl.
1.3 多重PCR
优化前,为了摸索条件分成了四个组,第一组按顺序加入下列物质:灭菌超纯水13μl,2xPCR Mastermix(Bioteke, Beijing,China)25μl,混合引物10μl,DNA模板(选2个正常对照)2μl,总体积50μl.短暂离心混匀,放入PCR扩增仪内准备扩增.扩增条件:96℃预变性7min,55℃复性1min后进入循环.循环扩增程序为(延伸、变性、退火):72℃延伸2min,96℃变性30s,56℃退火1.5min,共进行30个循环,最后于72℃延伸7min.第二组的反应液中先不加人PCR mix,在96℃预变性7min后,在变性结束温度降至60℃左右时,暂停PCR仪加入PCR mix,其他条件同第一组.第三组的反应体系同第一组,不同于第一组的是循环扩增程序设置为普通PCR的循环程序(变性、退火、延伸).第四组与第三组的不同点为反应体系中后加PCR mix,其他都相同.
2 结果
2.1 优化前的结果
10μl PCR产物于2%普通的琼脂糖凝胶中分离.在1 X TAE电泳缓冲液中电泳,电压为5V/cm,电泳时间1.5h.优化前的结果见图1,每相邻的泳道样品为同一基因组,结果显示第一组的条带最为清晰,但从上面数第2-7条带之间的界限模糊,无法判断是否有缺失,需要优化反应条件.

图1 未优化前多重PCR电泳检测结果
2.2 优化后的结果
优化后,我们将原本混入一管的引物分成了2管,使相邻的2-7条带分成2管,加大了条带之间的间距,将48、17、8外显子引物混合加入B管,其余的引物(45、19、51、12、44、4)混合入A管,每条引物的终浓度为0.5μmol/L.反应条件我们选用了第一组,PCR mix直接加入反应体系中,扩增条件为:96℃预变性7min,55℃复性1min后进入循环,循环扩增程序为(延伸、变性、退火):72℃延伸2min,96℃变性30s,A管56℃(B管55℃)退火1.5min,共进行30个循环,最后于72℃延伸7min.电泳条件与优化前相同,结果见图2.电泳结果清晰,所有的条带之间的界限清晰,泳道4和7为患儿的DNA,可以准确地判断患儿所有细胞DMD基因的第51个外显子完全缺失,部分细胞DMD基因第48外显子有缺失(有条带但很弱),而患儿母亲的这9个外显子完全正常,图2的3和6泳道为患儿母亲的DNA.
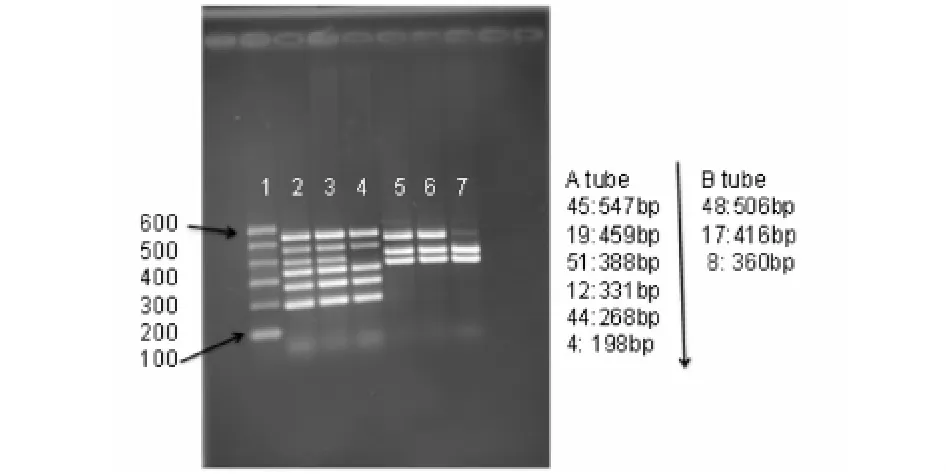
图2 优化后多重PCR电泳检测结果
3 讨论
3.1 优化后各个条带之间的界限明显,条带清晰,对基因缺失能够进行准确的判断.而且B管的退火温度设定为55℃后条带更为清晰.
3.2 对比其他检测DMD缺失的方法[1,3],我们的电泳使用的是实验室最常用的琼脂糖胶,不需要定购低熔点琼脂糖和聚丙烯酰胺,而且普通琼脂糖凝胶电泳比聚丙烯酰胺凝胶电泳方便简单,对比低熔点琼脂糖价格便宜.
3.3 若九对引物混在一个管内,因普通琼脂糖凝胶电泳分辨率低,第2-7条带之间很难分离,必须要延长电泳的时间(2h-4h)[4],加大了电泳的难度.而采用我们的方法,把相邻条带分成了两管,使条带之间的间距加大,只要1.5h就可以使条带分离,跟普通的电泳没有什么区别.
3.4 对比文献[5]的普通PCR检测DMD基因缺失的方法,检测9个外显子就需要9管PCR反应,而我们的多重PCR法只需要2管,操作简单了许多同时也可以节省PCR反应试剂.
综上所述,我们优化后的多重PCR技术兼备了普通PCR的准确性与9对引物法的便捷性,且操作简单,适合在多种环境下进行基因诊断,值得推广.
参考文献:
〔1〕徐克前.分子生物学检验技术实验指导[M].北京:人民卫生出版社,2007.165-168.
〔2〕白春英,周静,瑞云,等.经济、有效提取全血基因组DNA的方法[J].检验医学与临床,2010,7(17):1795-1798.
〔3〕闫杨,杨晓凤,尹富华,等.135例Duchenne型肌营养不良症DMD基因缺失分析[J].基础医学与临床,2009,29(8): 872-874.
〔4〕杜文津,万琪,陈晋文,等.假肥大肌营养不良基因突变检测方法的应用比较[J].卒中与神经疾病,2010,17(5):289-292.
〔5〕周海燕,邹永华.应用PCR技术对DMD患者进行缺失检测与产前诊断[J].生命科学研究,2006,10(4):346-349.
R446.9
A
1673-260X(2014)07-0014-02

