补肾益髓生血法AA大鼠含药血清对大鼠造血干细胞红系分化JAK2/STAT5信号通路的影响
田 晨 赵宗江 张新雪 张丰丰 程明秀 王颖超 赵 敬 吴志奎
(1 北京中医药大学基础医学院细胞与生化实验室,北京,100029; 2 中国中医科学院广安门医院,北京,100053)
补肾益髓生血法AA大鼠含药血清对大鼠造血干细胞红系分化JAK2/STAT5信号通路的影响
田 晨1赵宗江1张新雪1张丰丰1程明秀1王颖超1赵 敬1吴志奎2
(1 北京中医药大学基础医学院细胞与生化实验室,北京,100029; 2 中国中医科学院广安门医院,北京,100053)
目的:探讨补肾益髓生血法再生障碍性贫血(Aplastic Anemia,AA,简称再障)大鼠含药血清对大鼠骨髓造血干细胞红系分化JAK2/STAT5信号通路的影响。方法:在前期整体动物实验的基础上,体外培养正常大鼠造血干细胞,诱导其定向红系分化,分为空白对照组、正常对照组、模型组、司坦唑醇组(康力龙组)、益髓生血组、温肾生血组和滋肾生血组,在培养体系中加入含药血清干预4d后,提取红系细胞总RNA及蛋白,分别采用RT-PCR和Western blot检测细胞JAK2、STAT5mRNA及蛋白表达情况。结果:与正常对照组相比,模型组细胞JAK2、STAT5mRNA及蛋白表达均明显降低(P<0.01);与模型组相比,各治疗组JAK2、STAT5mRNA及蛋白表达明显升高(P<0.01或P<0.05);滋肾生血组JAK2、STAT5mRNA及蛋白表达高于益髓生血组和温肾生血组(P<0.05)。结论:补肾益髓生血法能够增强JAK2、STAT5的表达,可能通过影响JAK2/STAT5信号通路来促进红系细胞的分化成熟,其中滋肾生血法优于益髓生血法和温肾生血法。
补肾益髓生血法;再障;造血干细胞;红系分化;JAK2/STAT5信号通路
再生障碍性贫血(Aplastic Anemia,AA,简称再障)是骨髓造血功能衰竭性疾病,临床症状以贫血、出血、感染为主。属于中医“血虚”“髓劳”等范畴,其基本病机在于肾虚,肾不藏精,生髓,化血[1],贫血的发生主要是由于红系发育异常,导致成熟红细胞减少,血红蛋白浓度降低。EPO是促进红细胞分化成熟最为主要的细胞因子,EPO与红系祖细胞表面的EPOR结合后,可以启动JAK2/STAT5信号转导途径,引起基因转录增强或抑制,最终导致红系细胞的增殖和分化[2]。补肾益髓生血法是针对AA的基本病机,根据中医“肾藏精,生髓化血”理论结合临床实践确立的治疗AA大法。该法可以明显改善患者的贫血症状[3],增加红系祖细胞数目[4],提升红细胞水平,但其作用机制的研究有待进一步研究,因此,本研究在前期整体动物实验的基础上,体外培养造血干细胞并诱导其向红系分化,观察补肾益髓生血法再障大鼠含药血清对正常大鼠骨髓造血干细胞红系分化过程中JAK2/STAT5信号通路的影响。
1 材料
1.1 细胞 正常大鼠骨髓单个核细胞,SD大鼠,体重(200±20)g。
1.2 主要试剂 IMDM(Gibco,批号:12200036),大鼠外周血淋巴细胞分离液(天津灏洋,批号:LTS1083),干细胞因子(SCF,PeproTech,批号:0110258),重组大鼠白细胞介素3(IL-3,PROSPEC,批号:1108RIL301),重组人促红细胞生成素(EPO,赛博尔,批号:201206042),兔单克隆抗体JAK2(Cell Signaling Technology,批号:D2E12),兔多克隆抗体STAT5(abcam,批号:ab68465),β-acting单克隆抗体(Cell Signaling Technology,批号:4970),山羊抗兔IgG HPR(康为世纪,批号:CW0103),甲叉丙烯酰胺(Ameresco,批号:2967B040),甲叉双丙烯酰胺(Ameresco,批号:1209B293),cDNA第一链合成试剂盒(promega,A3500,批号:0000073779),Go Taq○RGreen Mix(promega,批号:0000040423),JAK2、STAT5、GAPDH、β-actin引物合成于生工生物有限公司。
1.3 主要仪器 倒置相差显微镜(日本Olympus公司),超净工作台(北京市昌平长城空气净化设备公司),恒温CO2培养箱(编号:B5060EK/CO2,德国产),0.22 μm滤器(PALL,批号:1419267),24孔细胞培养板(COSTAR,批号:3524),电泳槽,ICMIAS系列多功能图像分析系统,电源(Bio-Rad,041BR111842)。
2 方法
2.1 含药血清的制备及处理 使用整体动物实验结束时分离的各组大鼠血清[5]。股动脉取血,静置2 h后,2 500 r/min低温离心20 min,抽取上层血清,-20 ℃保存备用。使用前将其置于4 ℃24 h融化,室温复温1 h后,于56 ℃水浴锅中灭活补体30 min,0.22 μm的滤器过滤后分装备用,-20 ℃保存。
2.2 大鼠骨髓单个核细胞离培养与分组 取正常SD大鼠后股骨段骨髓,用PBS溶液反复冲洗3次,将得到的细胞悬液缓慢的加入到等量淋巴细胞分离液上层,2 500 r/min离心25 min;轻轻抽取中间白膜层骨髓单个核细胞(BMMNC),加入10%FBS IMDM洗涤2次,然后用10%FBS IMDM重悬,计数后,调整BMMNC浓度为1×106/mL。于含有1%甲基纤维素、IMDM,10%FBS、1%BSA、1×10-4M β-巯基乙醇、SCF 50ng/mL、IL-3 10ng/mL、EPO 3U/mL、100U/mL青霉素、100U/mL链霉素的红系培养体系培养,分别加入各个组别的含药血清,占培养体系比例为20%,BMMNC密度为1×105/mL,每孔1 mL,24孔板,每组设6个复孔,周围孔加入0.5 mL无菌超纯水,将细胞板置于5%CO2、37 ℃、保持湿度的CO2孵育箱中培养。
根据加入含药血清的不同,分为空白对照组(30%FBS组,不含大鼠血清)、正常对照组、模型组、西药对照司坦唑醇组(康力龙组)、益髓生血组、温肾生血组、滋肾生血组。观察细胞生长状态,于第4天提取细胞总RNA及蛋白。
2.3 检测指标及检测方法 分别采用RT-PCR和Western blot方法检测各组红系细胞中JAK2、STAT5mRNA及蛋白表达,JAK2、STAT5、GAPDH、β-actin引物见表1。

表1 基因引物序列及其扩增产物
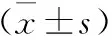
表2 补肾益髓生血法AA大鼠含药血清对红系细胞JAK2、STAT5mRNA表达的影响
注:与模型组相比,*P<0.05,**P<0.01;与康力龙组相比,△P<0.05,△△P<0.01;与益髓生血组相比,□P<0.05,□□P<0.01;与温肾生血组相比,▲P<0.05,▲▲P<0.01。
3 结果
3.1 补肾益髓生血法AA大鼠含药血清对大鼠造血干细胞红系分化JAK2、STAT5mRNA表达的影响 与正常对照组相比,模型组JAK2、STAT5mRNA表达明显降低,有统计学意义(P<0.01),与模型组相比,各治疗组JAK2、STAT5mRNA表达明显升高,有统计学意义(P<0.01),滋肾生血组JAK2、STAT5mRNA表达高于益髓生血组和温肾生血组,有统计学意义(P<0.01)。具体见表2,图1-图2。
图1 补肾益髓生血法AA大鼠含药血清对红系细胞JAK2、STAT5mRNA的影响
注:与模型组相比,*P<0.05,**P<0.01;与康力龙组相比,△P<0.05,△△P<0.01;与益髓生血组相比,□P<0.05,□□P<0.01;与温肾生血组相比,▲P<0.05,▲▲P<0.01。
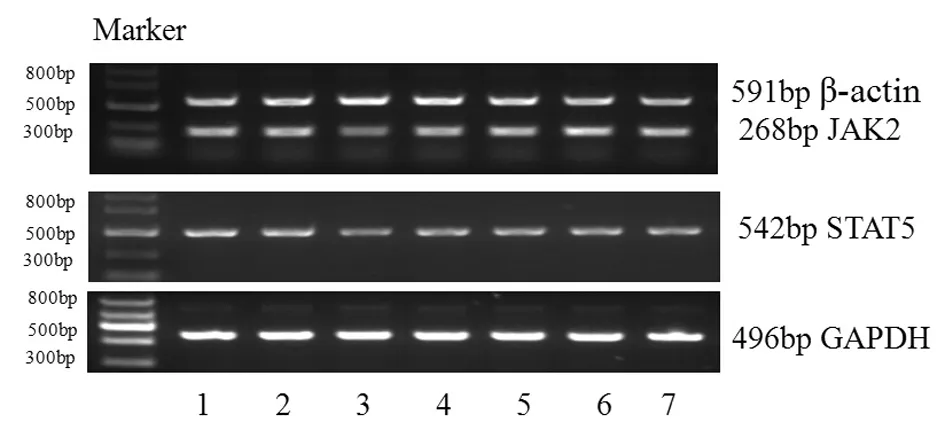
图2 补肾益髓生血法AA大鼠含药血清对红系细胞JAK2、STAT5mRNA表达的影响
注:1空白对照组;2正常对照组;3模型组;4康立龙组;5益髓生血组;6温肾生血组;7滋肾生血组。
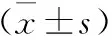
表3 补肾益髓生血法AA大鼠含药血清对JAK2、STAT5蛋白表达的影响
注:与模型组相比,*P<0.05,**P<0.01;与康力龙组相比,△P<0.05,△△P<0.01;与益髓生血组相比,□P<0.05,□□P<0.01;与温肾生血组相比,▲P<0.05,▲▲P<0.01。
3.2 补肾益髓生血法AA大鼠含药血清对大鼠造血干细胞红系分化JAK2、STAT5蛋白表达的影响 模型组JAK2、STAT5蛋白表达较正常对照组明显降低(P<0.01),与模型组相比,各治疗组JAK2、STAT5蛋白表达明显升高(P<0.01或P<0.05),滋肾生血组JAK2、STAT5蛋白表达明显高于益髓生血组(P<0.01)、滋肾生血组JAK2蛋白表达明显高于温肾生血组(P<0.05)。具体见表3,图3-图4。

图3 补肾益髓生血法AA大鼠含药血清对JAK2、STAT5蛋白表达的影响
注:与模型组相比,*P<0.05,**P<0.01;与康力龙组相比,△P<0.05,△△P<0.01;与益髓生血组相比,□P<0.05,□□P<0.01;与温肾生血组相比,▲P<0.05,▲▲P<0.01。
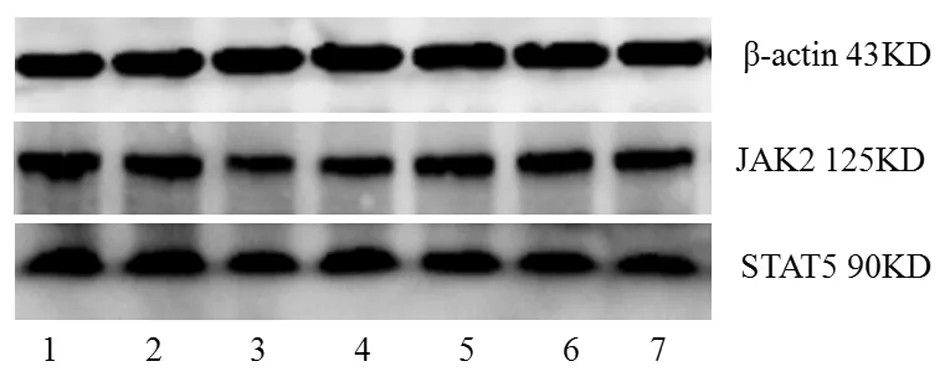
图4 补肾益髓生血法AA大鼠含药血清对红系细胞JAK2、STAT5蛋白表达的影响
注:1空白对照组;2正常对照组;3模型组;4康立龙组;5益髓生血组;6温肾生血组;7滋肾生血组。
4 讨论
AA是常见的血液系统疾病之一,以外周血全血细胞减少为主要特征。中医学认为,血液的化生与肾藏精密切相关,而AA主要表现出贫血等症状,故肾虚,肾不藏精,生髓不足是AA发病的关键病机。血液的化生离不开五脏协调,但与肾最为密切。《张氏医通》云:“气不耗,归精于肾化为精,精不泄,归精于肝而化清血”,《灵枢·决气》云:“中焦受气取汁,变化而赤是谓血”,指出肾与肝、脾胃同化;《医精经义》曰:“肾藏精,精生髓,髓生骨……精足则髓足”,《血证论》云:“气乃先天肾中一点肾阳,静而复动,化生精血”,指出了肾、精、骨、髓、血的关系,反映了精髓化生血液主要取决于肾的功能。目前大多医家认为治疗AA基本上都是在“以肾为本、从肾论治”的基础上进行变通,充分发挥中医辨证论治AA的优势。
AA患者全血细胞的减少主要源于T细胞介导的免疫异常导致造血干细胞向各系细胞分化过程中出现异常,从而导致各系成熟血细胞减少[9-10]。而红系发育异常,导致成熟红细胞减少,血红蛋白浓度降低是AA患者出现贫血症状的主要机制,调控红系分化成熟的信号通路主要有JAK/STAT通路、Ras/MAPK通路和PI3K通路,其中,JAK2/STAT5信号通路与EPOR信息传递关系最为密切[11-12]。活化的STAT5在EPO介导的红系细胞分化成熟过程中是必要的,抑制STAT5活化后,红细胞的成熟受抑制[2],STAT5可通过JAK2/STAT5信号通路来调节红系关键转录因子GATA-1的表达,进而增强激活红系特异基因的转录,促进红系细胞分化、成熟。在红系分化过程中,EPOR基因的表达依赖于GATA-l活性。GATA-1-miRNA轴在红细胞生成中发挥重要作用,GATA-1可通过miRNA途径来调控红细胞分化成熟,已报道miR-27a/24、microRNA-23a、miR-199b-5p能够促进红系生成[13-15]。研究表明,造血干细胞向红系分化过程中,红系分化相关基因GATA-1、Klf1、EPOR表达明显升高,而且多向分化祖细胞MPP显示出JAK2异常信号,提示JAK2信号能够影响造血干/祖细胞定向红系分化[16]。
补肾益髓生血法组方以“肾藏精”为理论指导,包括益髓生血方(益髓生血颗粒)、温肾生血方、滋肾生血方三方。其代表方益髓生血颗粒以山茱萸、何首乌滋阴补肾共为君药,以熟地黄、补骨脂助君生精化血、炙黄芪、党参健脾益气、阿胶、当归养血补血共为臣药,鸡血藤、鳖甲活血化瘀为佐药,砂仁为使药,以防滋腻,全方补肾为主,兼以健脾养肝,共奏滋肾养阴、益髓生血、健脾益气之功。温肾生血方在益髓生血颗粒的基础上加入淫羊藿,以增强温肾阳之功。滋肾生血方在益髓生血颗粒的基础上入女贞子,以加强滋肾阴、壮髓生血功效。
课题组通过前期实验研究证明了补肾益髓生血法对AA大鼠具有肯定的疗效。补肾益髓生血法可以改善AA大鼠的一般状态,增加AA大鼠体重,使外周血全血细胞增加,使血细胞形态趋于正常,增加骨髓有核细胞数,减少脂肪滴,调节外周血T淋巴细胞亚群的异常,促进造血祖细胞的增殖分化,增加造血祖细胞CFU-E、BFU-E和CFU-GM的数量,提升造血干细胞定向分化的关键转录因子GATA-1、PU.1的表达,从而促进血细胞的成熟,起到恢复AA骨髓造血的作用,并且对比研究益髓生血法、温肾生血法和滋肾生血法,结果显示滋肾生血法对AA大鼠贫血状态、造血功能、免疫调节、造血祖细胞增殖分化等各个方面的改善作用优于益髓生血法和温肾生血法[4-5]。本研究从红系分化关键的JAK2/STAT5信号通路角度入手,探讨补肾益髓生血法调控AA造血干细胞定向红系分化成熟的作用机制。
研究结果表明,在EPO诱导造血干细胞向红系分化过程中,加入AA大鼠血清及各治疗组含药血清干预后,模型组红系细胞JAK2、STAT5 mRNA及蛋白表达显著低于正常对照组,各治疗组红系细胞JAK2、STAT5 mRNA及蛋白表达显著高于模型组,且滋肾生血组JAK2、STAT5 mRNA及蛋白表达明显高于益髓生血组、温肾生血组。说明补肾益髓生血法能够影响JAK2/STAT5信号通路,增强JAK2、STAT5的表达,进而调控下游相关靶基因,促进红系细胞的分化成熟,提示补肾益髓生血法可能通过影响JAK2/STAT5信号通路来促进红系细胞分化成熟,从而达到治疗AA的作用。对比三法,滋肾生血法对JAK2/STAT5调控作用最强,可能是由于肾精亏虚、血化无源是AA全血细胞减少的根本原因,滋肾生血方加入滋补肝肾之阴的女贞子,在益髓生血方基础上增强了滋阴、壮髓、生血的功效,与AA病机更加切合,从而表现出较好的促进红系造血作用。本研究阐明了补肾益髓生血法促进造血干细胞红系分化成熟的分子机制及三法的作用特点,为深入阐明补肾益髓生血法治疗AA疗效机制提供了实验依据,为中医“肾藏精、生髓化血”理论研究及临床应用提供了有力的实验依据。
[1]赵宗江,张新雪.慢性再生障碍性贫血的中医药研究[J].中华中医药杂志(原中国医药学报),2011,26(11):2635-2638.
[2]Florian G,Marc A,Kerenyi,et,al.Stat5 activation enables erythropoiesis in the absence of EpoR and Jak2[J].Hematopoiesis and Stem Cell,2008,111:4511-4522.
[3]Fang SP,Wu ZK,Zhang XH,et al.Clinical observation on YiSuiShengXueGranule on treating 156 patients with Thalassemia major and the molecular mechanism study[J].Biol Phram Bull,2007,30(11):2084-2087.
[4]田晨,张新雪,张丰丰,等.补肾益髓生血法再障大鼠含药血清对大鼠造血祖细胞增殖分化及其机制的影响[J].世界科学技术-中医药现代化,2014,16(5):1106-1113.
[5]张新雪,张丰丰,赵宗江,等.补肾益髓生血法对60Co-γ联合CXT诱导AA大鼠骨髓造血及免疫功能影响的实验研究[J].中华中医药杂志,2014,37(6):464-470.
[6]任丹阳,徐涛,黄成,等.5,7,3'-三乙酰橙皮素对AA大鼠成纤维样滑膜细胞Jak2/Stat3信号通路及凋亡相关蛋白的影响[J].中国药理学通报,2012,28(8):1063-1068.
[7]Anne PT,Uriel B,Christian T,et al.Characterization of a Rat Uterine Cell Line,UIII Cells:Prolactin (PRL) Expression and Endogenous Regulation of PRL-Dependent Genes;Estrogen Receptorβ,α2-Macroglobulin,and Decidual PRL Involving the Jak2 and Stat5 Pathway[J].Endocrinology,2001,142(3):1242-1250.
[8]乌格敦其其格,赵宗江,蒋玉凤,等.糖肾平胶囊对STZ诱导糖尿病肾病大鼠肾脏保护及其对TGF-β1/p38MAPK信号转导通路的影响[J].中华中医药杂志,2012,26(4):1092-1097.
[9]Young NS,Scheinberg P,Calado RT.Aplastic anemia[J].Curropin Hematol,2008,15(3):162-168.
[10]Young NS,Bacigaupo A,Marsh JC.Aplastic anemia:pathophysiology and treatment[J].Biol Bolld Marrow Tranaplant,2010,16:110-125.
[11]Broxmeyer HE,J Hoggatt,HA O’Leary,et al.Dipeptidylpeptidase 4 negatively regulates colony-stimulating factor activity and stress hematopoiesis[J].Nat Med,2012,18:1786-1796.
[12]Banan M,Esmaeilzadeh GE,Nezami M,et al.cAMP response element-binding protein 1 is required for hydroxyurea-mediated induction of γ-globin expression in K562 cells[J].Clinical and Experimental Pharmacology and Physiology,2012,39(6):510-517.
[13]Fang Wang,Yong Zhu,Lihua Guo,et,al.A regulatory circuit comprising GATA1/2 switch and microRNA-27a/24 promotes erythropoiesis[J].Nucleic Acids Research,2014,42(1):442-457.
[14]Zhu Y,Wang D,Wang F,et al.A comprehensive analysis of GATA-1-regulated miRNAs reveals miR-23a to be a positive modulator of erythropoiesis[J].Nucleic Acids Res,2013,41:4129-4143.
[15]Yuxia Li,Hua Bai,Zhongzu Zhang,et al.The Up-Regulation of miR-199b-5p in Erythroid Differentiation Is Associated with GATA-1 and NF-E2[J].Mol Cells,2014,37(3):213-219.
[16]Ryuji I,Robert SW,Wanke Z.Stem and Progenitor cell Subsets are affected by JAK2 signaling and can be monitored by flow cytometry[J].Plos one,2014,9(4):e93643.
(2014-04-28收稿 责任编辑:洪志强)
Effect of Tonifying Kidney,Benefiting Marrow and Engendering Blood Method Medicated Serum of Rats with Aplastic Anemia on JAK2/STAT5 Signaling Pathway in The Erythroid Differentiation of Hematopoietic Stem Cells
Tian Chen1,Zhao Zongjiang1,Zhang Xinxue1,Zhang Fengfeng1,Cheng Minxiu1,Zhao Jing1,Wang Yingchao1,Wu Zhikui2
(1 Cellular and Biochemical Laboratory of Basic Medical College,Beijing University of Chinese Medicine,Beijing 100029,China; 2 Guang'anmen Hospital,China Academy of Chinese Medical Sciences,Beijing 100053,China)
Objective:To investigate the effect of tonifying kidney,benefiting marrow and engendering blood method on JAK2/STAT5 signaling pathway in the erythroid differentiation of hematopoietic stem cells. Methods: On the basis of the previous in vivo animal experiment,the hematopoietic stem cells were cultivated with AA rats serum and induced erythroid differentiation in vitro. The cells were divided into the following seven groups: blank control group,normal control group,model group,stanozolol group,benefiting marrow and engendering blood group,warming kidney and engendering blood group,nourishing kidney and engendering blood group. Erythroid cells RNA and protein were extracted in 4 days respectively,and the level of JAK2,STAT5 mRNA and protein in erythroid cells were detected with RT-PCR and Western blot. Results: Compared with the normal control group,the expressing of JAK2,STAT5 mRNA and protein in cells decreased significantly in the model group(P<0.01).Compared with the model group,the expression of JAK2,STAT5 mRNA and protein both significantly increased in treatment groups(P<0.01 orP<0.05),while the nourishing kidney group was significantly better than the benefiting marrow group and warming kidney group of the expression of JAK2,STAT5mRNA and protein. Conclusion: The method of tonifying kidney,benefiting marrow and engendering blood can increase the expression of JAK2,STAT5 and promote erythroid differentiation and maturation by affecting JAK2/STAT5 signaling pathway and stimulating activity. The nourishing kidney and engendering blood method is better than benefiting marrow and warming kidney method.
Tonifying kidney,benefiting marrow and engendering blood mthod; Aplastic anemia; Hematopoietic stem cells; Erythroid differentiation; JAK2/STAT5 signaling pathway
国家重点基础研究发展计划(973计划)——基于“肾藏精”的脏象理论基础研究——从障碍性贫血探讨“肾生髓”理论的研究(课题编号:2010CB530406)
田晨,女,研究生,研究方向:中医药防治再生障碍性贫血,E-mail:tianchen0901@163.com
赵宗江,男,教授,博士生导师,主任医师,邮编:100029,电话:(010)64286988,E-mail:zongjiangz@sina.com
R556.5;R242;R392.7
A
10.3969/j.issn.1673-7202.2014.06.008

