人防御素6基因的克隆、亚克隆及在酵母中的分泌表达
单 颖 , 吴学敏, 卢 颖
(辽宁医学院 免疫学教研室,辽宁 锦州 121000)
人防御素6基因的克隆、亚克隆及在酵母中的分泌表达
单 颖 , 吴学敏, 卢 颖
(辽宁医学院 免疫学教研室,辽宁 锦州 121000)
探讨人防御素6(HD-6)在毕赤酵母中表达的可行性,为进一步研究HD6的功能提供理论依据和实验基础。采用PCR方法,设计引物从cDNA文库中扩增出人α防御素6基因片段,并将其插入到克隆载体pMD-18T中,再与毕赤酵母表达载体pPICZαA重组,以得到重组的HD-6酵母表达载体pPICZαA/HD-6,并进行琼脂糖电泳和测序鉴定。再将构建好的毕赤酵母重组表达质粒pPICZαA/HD-6经SacⅠ线性化后,应用LiCl法转化毕赤酵母菌株GS115感受态中,Zeocin平板筛选,PCR鉴定转化子。经摇瓶发酵和甲醇诱导,SDS-PAGE分析重组HD-6的表达。从cDNA文库中扩增出的HD-6基因片断大小正确;电泳和测序结果均证明已将此片段克隆到酵母表达载体pPICZαA内;线性化的重组质粒pPICZαA/HD-6成功转化进入毕赤酵母感受态中,PCR鉴定结果与预期相符;蛋白电泳证实重组HD-6在酵母中获得分泌表达。提示重组HD-6可以在毕赤酵母中实现分泌表达。
人防御素6;表达质粒;毕赤酵母
人防御素(Defensin)属于抗菌肽家族成员,是一类具有广谱抗微生物活性的小分子阳离子多肽,分子内均含有6个由二硫键连接的半胱氨酸,是机体天然免疫系统的重要组成部分。根据其高级结构及所含3对分子内二硫键的连接方式不同,可将人类防御素分为2大类:α防御素和β防御素。α防御素主要存在于中性粒细胞(即髓源性防御素)和小肠潘氏细胞(即肠源性防御素)中。肠源性防御素包括HD-5和HD-6,主要分布于潘氏细胞和小肠上皮细胞[1-2]。近年来研究表明,肠源性防御素除了具有抗菌作用外,还具有抗病毒[3]作用,并且与一些消化系统疾病如炎症性肠病有密切关系[4-5]。目前通过基因拼接和固相合成手段表达或生产出具有生物活性的HD-6已有报道,但这些手段成本高,操作繁琐,而通过cDNA文库扩增表达HD-6编码基因至今未见报道。本研究旨在采用pPICZαA载体构建HD-6基因酵母表达载体,并尝试HD-6基因毕赤酵母的外源性表达,为大量生产和提纯具有生物活性的人α防御素6抗菌肽方法的研究提供实验基础,以进一步探讨HD-6的功能,并为用于消化系统疾病的治疗创造条件。
1 材料与方法
1.1材料
1.1.1 cDNA文库 MegaMan Human Transcriptome Library购自STRATAGENE公司,包括66种不同的来源于人体组织及人肿瘤细胞cDNA片段,其中包括人小肠细胞的cDNA文库。
1.1.2 菌株和载体 大肠埃希菌菌株DH-5α、Top10,毕赤酵母表达载体pPICZαA均由本教研室保存,克隆载体pMD-18T simple vector购自大连宝生物科技公司。
1.1.3 PCR引物设计和合成 上游引物:5′-CGGAATTCATGAGAACCCTCACCATCC-3′,下游引物:5′-GCTCTAGAGCGAGGCAGCAGAATCTGT-3′。上游引物中引入了EcoRⅠ,下游引物中引入了XbaⅠ的酶切位点。PCR引物由上海生工生物公司合成。
1.1.4 工具酶和主要试剂 限制性内切酶EcoRⅠ和XbaⅠ、ZeocinTM购自Invitrogen公司;质粒提取试剂盒、PCR产物回收试剂盒、MarkerDL12000和DL4000、限制性内切酶SacⅠ,均购自大连宝生物科技公司;LiCl、PEG3350、鲑鱼精DNA购自北京拜尔迪公司;Lyticase 购自Sigma公司;AOX引物于上海生工生物公司合成。
1.2方法
1.2.1 目的基因的扩增 用PCR方法以cDNA文库为模板,扩增HD-6序列。PCR反应程序如下:94 ℃预变性5 min,94 ℃变性55 s,55 ℃复性30 s,72 ℃延伸30 s,共循环35次,再72 ℃后延伸10 min,产物经电泳纯化并回收。
1.2.2 克隆载体的构建与鉴定 以pMD-18T为克隆载体,与HD-6的PCR产物连接,产物转化DH-5α,经氨苄青霉素、X-Gal和IPTG培养基培养,进行抗生素和蓝白斑双重筛选。挑取白色菌落,经菌液、质粒PCR验证获得含有HD-6片段的阳性克隆pMD-18T-HD6。
1.2.3 毕赤酵母表达载体的构建、鉴定 用EcoRⅠ和XbaⅠ双酶切pPICZαA质粒和pMD-18T-HD6,琼脂糖电泳回收2目的片段,用T4DNA连接酶将2目的片段连接,产物转化Top10,经Zeocin培养基筛选,挑取阳性克隆进行质粒的小量制备,经过PCR筛选获得含有正确目的片段的阳性克隆。将阳性克隆质粒进行测序。
1.2.4 重组质粒转化毕赤酵母GS115 挑取经分离纯化的GS115菌落接种到50 mL YPD培养基中,30 ℃摇菌过夜培养至OD600为0.8~1.0,离心收获细胞,采用LiCl法制备感受态。分别加入50% PEG3350 240 μL、1 mol/L LiCl 36 μL、2 mg/mL超声化单链鲑鱼精DNA 25 μL,用SacⅠ单酶切并纯化的重组质粒DNA 50 μL,剧烈旋涡混匀直至沉淀菌体完全分布均匀(约1 min),30 ℃水浴孵育30 min,42 ℃水浴热休克20 min,8 000 r/min离心收集酵母菌体,重悬酵母于1 mL YPD培养基中,30 ℃摇床孵育4 h后,取100 μL菌液铺选择性培养基平板YPDZ(Zeocin 100 μg/mL),30 ℃培养3~5 d,观察菌落长出情况并鉴定。
1.2.5 重组酵母菌的基因组提取及鉴定 接种重组转化子于5 mL YPDZ培养基中,培养3~5 d。室温下,2 000 r/min离心10 min收集菌体,TE重悬,加入β-巯基乙醇3 μL,Lyticase 50 U,37 ℃水浴60 min,提取酵母菌基因组。以提取的基因组作为模板,用AOX引物和目的基因HD-6引物作PCR鉴定。
1.2.6 重组菌株的诱导表达及检测 将PCR鉴定正确的重组酵母菌株接种到BMGY中,30 ℃、250 r/min振荡培养至OD600为2~6,室温下4 000×g离心5 min,将菌体用BMMY重悬至OD600为1。28 ℃、250 r/min振荡培养,进行甲醇诱导表达,培养24 h,10 000×g离心5 min,将上清移入新的灭菌离心管中,进行SDS-PAGE电泳检测,分析目的条带。
2 结果与分析
2.1目的基因的扩增
扩增的HD-6序列约为300 bp,PCR扩增产物琼脂糖凝胶电泳显示,在预期部位出现明显条带,结果见图1。
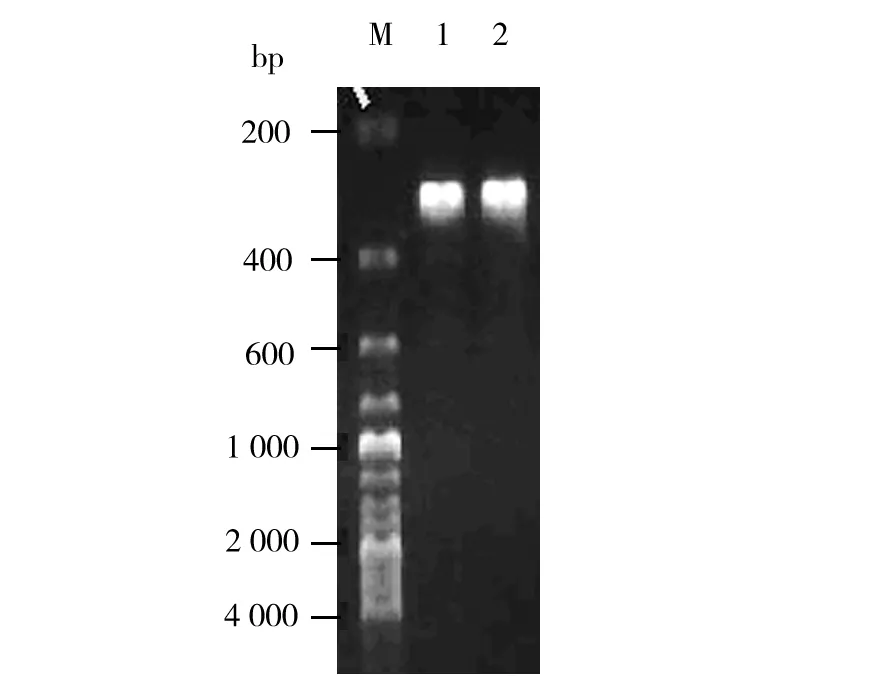
图1 PCR扩增产物的琼脂糖凝胶电泳图谱Fig.1 Amplification of HD-6 by PCR
2.2克隆载体的构建与鉴定
将HD-6片段克隆到载体pMD-18T中,构建重组质粒pMD-18T-HD6,并经过PCR鉴定,琼脂糖电泳显示PCR产物在300 bp左右出现条带,与HD-6片段大小一致。空载体pMD-18T在2 500 bp左右出现条带,重组质粒pMD-18T-HD6在3 000 bp左右出现条带,均与预期位置相符,显示与T载体连接成功,结果见图2。
2.3毕赤酵母表达载体的构建与鉴定
用EcoRⅠ和XbaⅠ双酶切pMD-18T-HD6,连接到同时进行此双酶切的pPICZαA的位点中,构建成酵母表达载体pPICZαA/HD-6,并经过PCR鉴定,质粒提取鉴定,均在预期部位出现条带,结果见图3。重组质粒测序结果表明HD-6基因序列为编码目的基因的正确序列。
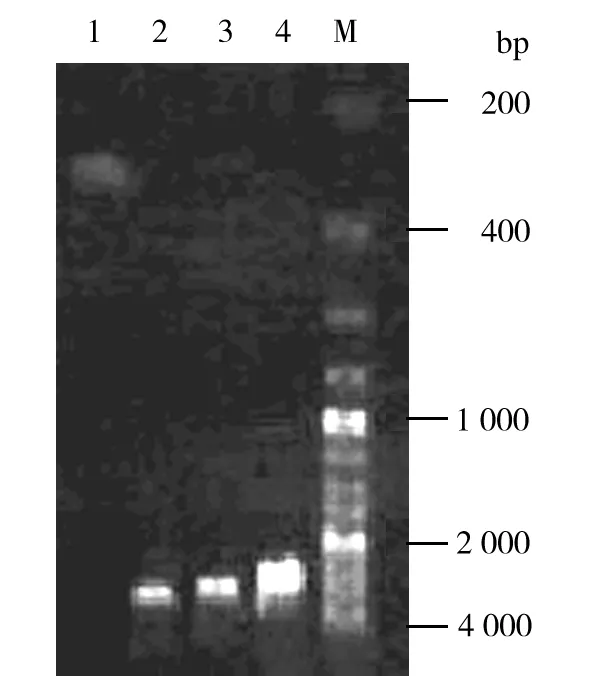
图2 重组质粒琼脂糖鉴定结果Fig.2 Recombinant plasmid pMD-18T-HD6
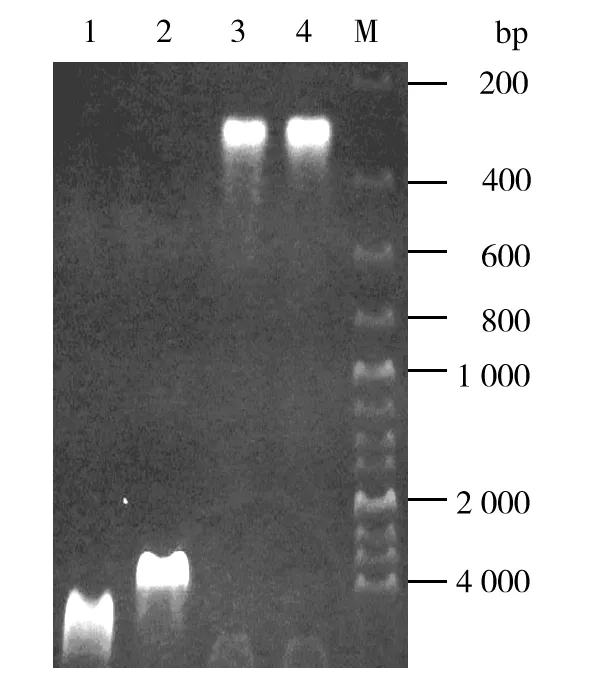
图3 重组质粒pPICZαA/HD-6琼脂糖电泳鉴定结果Fig.3 Recombinant plasmid pPICZαA/HD-6
2.4重组质粒的转化结果
pPICZαA/HD-6线性化,氯化锂转化法进入GS115感受态,在Zeocin抗性的YPD平板上培养3~5 d得到数个抗性转化菌落。
2.5重组酵母菌的基因组提取及PCR鉴定
随机挑取5个重组子,分别接种于YPDZ中摇菌3~5 d,分别提取酵母基因组。以AOX上下游引物和目的基因HD-6引物PCR扩增,结果有3个菌落分别获得大约830 bp和300 bp的正确产物条带,结果见图4。
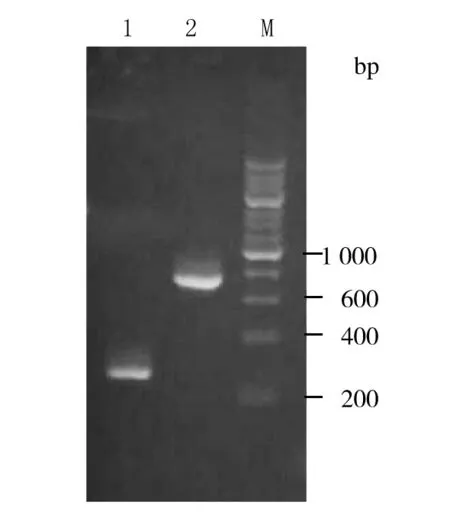
图4 重组酵母菌PCR鉴定结果 Fig.4 PCR identification of recombinant yeast
2.6SDS-PAGE分析
将重组酵母菌诱导表达的产物上清进行蛋白电泳,其结果与GS115空菌株进行对照,可见1条明显的新生蛋白带,其相对分子质量为11 ku,同预期的大小相一致,结果见图5。
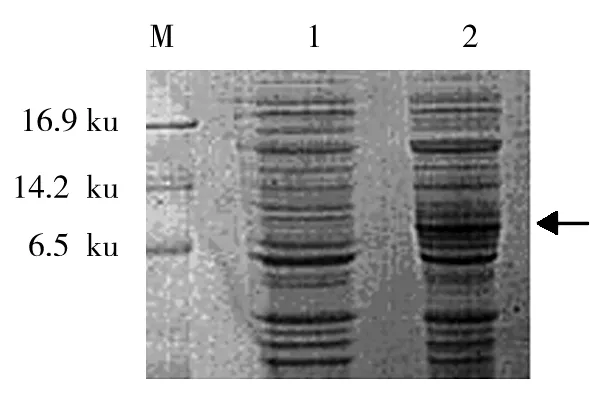
图5 毕赤酵母表达HD-6的SDS-PAGE电泳分析Fig.5 SDS-PAGE analysis of expression of HD-6
3 讨 论
抗生素耐药一直是对全人类健康的一个威胁。由于人防御素是内源性的而且具有广谱抗菌性,因此它们是一类很有前景的治疗候选药物。防御素对革兰阳性菌和阴性菌、真菌、分枝杆菌都有杀伤作用。然而生物机体内天然的防御素含量很低,分离成本极高,使得防御素的利用受到极大限制,远远不能满足人们的需要。而在大肠埃希菌等原核生物对防御素基因表达过程中,无法对其表达产物进行正确的空间结构折叠修饰,影响了防御素的抗菌活性。通过转基因工程手段也可从天然动植物中获得较高效防御素的表达,但在大规模提取和分离纯化中,所花成本极高,且工艺流程复杂,不利于进一步开发利用。因此利用近年开发的巴斯德毕赤酵母表达系统的优势,分泌型载体,构建了HD-6毕赤酵母表达质粒。
毕赤酵母表达体系是近年来发展最快、极具潜力的真核表达系统[6],已成功地应用于多种异源蛋白的表达[7-9]。由于它们属于单细胞生物,营养要求低,培养基成分简单、价廉,生长速度快,易于操作,可高密度发酵培养;可对蛋白进行翻译后的加工、修饰和折叠。通过同源重组,表达载体可稳定地整合到酵母宿主菌染色体中。选用酵母表达载体含有信号肽序列,可自动表达外源蛋白,且分泌至胞外,可有效防止外源基因表达产物对酵母菌生长可能产生的细胞毒性。
目前,人们对人髓源性防御素的基因、表达、翻译后加工及抗菌机制等过程研究得较为透彻,然而对于肠源性防御素的研究较少,而且还存在很多疑问。肠源性防御素不仅抗菌谱广,杀灭微生物作用强大,同时也可以作为免疫调节剂来调节机体免疫功能,对维持肠道屏障的完整性起到重要的作用[10],且能解决其他抗菌药物的耐药性问题,逐渐在医药领域中展现了广阔的开发前景。HD-6是属于肠源性防御素中的一种[11],关于它的功能及作用机制并不是很明确。本研究进行了毕赤酵母外源性表达HD-6蛋白,将表达产物的上清液做SDS-PAGE电泳分析,结果发现有特异条带的出现,其相对分子质量与预期值基本相符。提示HD-6可在毕赤酵母表达系统中进行外源性分泌表达。
虽然实现了HD-6蛋白在毕赤酵母中的分泌表达,但还需要对此蛋白表达产物进行进一步确认及纯化,并检测其是否具有生物活性,以进一步探讨其功能及作用机制。
[1] Schneider JJ, Unholzer A, Schaller M, et al. Human defensins [J]. J MolMed, 2005,83(8) :587 -595.
[2] Powers JP, Hancock RE. The relationship between peptide structure and antibacterial activity[J].Peptides,2003,24(11):1681-1691.
[3] Doss M, White MR, Tecle T, et al. Interactions of alpha-, beta-, and theta-defensins with influenza A virus and surfactant protein D[J].J Immunol,2009,15;182(12):7878-7887.
[4] Gersemann M, Wehkamp J, Fellermann K, et al. Crohn’s disease-defect in innate defence[J].World J Gastroenterol,2008,14(36):5499-5503.
[5] Zilbauer M, Jenke A, Wenzel G, et al. Intestinal alpha-defensin expression in pediatric inflammatory bowel disease[J].Inflamm Bowel Dis,2011,17(10):2076-2086.
[6] 李莲年,董秀涛,王丽丽,等.毕赤酵母生孢诱导条件的优化研究[J].微生物学杂志,2013,33(1):30-34.
[7] Macauley-Patrick S, Fazenda ML, McNeil B, et al. Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22:249-270.
[8] Han X, Ying X, Huang H, et al. Expression and purification of enterovirus type 71 polyprotein P1 using Pichia pastoris system[J].Virol Sin,2012,27(4):254-258.
[9] Jesus AL, Mariz FC, Souza HM, et al. Expression of the bovine papillomavirus type 1, 2 and 4 L1 genes in the yeast Pichia pastoris[J].Genet Mol Res,2012,11(3):2598-2607.
[10]Szyk A,Wu Z,Tucker K,et al. Crystal structures of human alpha-defensins HNP4,HD5 and HD6[J].Protein Sci,2006,15: 2749.
[11]Tanabe H,Ouellette AJ,Cocco MJ, et al. Differential effects on human immunodeficiency virus type 1 replication by alpha-defensins with comparable bactericidal activities[J].J Virol,2004,78:11622.
·写作常识·
引言
引言(也称前言、序言或概述)经常作为科技论文的开端,提出文中要研究的问题,引导读者阅读和理解全文。
1 引言的内容
引言作为论文的开场白,应以简短的篇幅介绍论文的写作背景和目的,以及相关领域内前人所做的工作和研究的概况,说明本研究与前人工作的关系,目前研究的热点、存在的问题及作者工作的意义,引出本文的主题给读者以引导。
引言也可点明本文的理论依据、实验基础和研究方法,简单阐述其研究内容;三言两言预示本研究的结果、意义和前景,但不必展开讨论。
2 引言的写作要求
2.1 开门见山,不绕圈子。避免大篇幅地讲述历史渊源和立题研究过程。
2.2 言简意赅,突出重点。不应过多叙述同行熟知的及教科书中的常识性内容,确有必要提及他人的研究成果和基本原理时,只需以参考引文的形式标出即可。在引言中提示本文的工作和观点时,意思应明确,语言应简练。
2.3 尊重科学,实事求是。在论述本文的研究意义时,应注意分寸,切忌使用“有很高的学术价值”、“填补了国内外空白”、“首次发现”等不适之词;同时也要注意不用客套话,如“才疏学浅”、“水平有限”、“恳求指教”、“抛砖引玉”之类的语言。
2.4 引言的内容不应与摘要雷同,也不应是摘要的注释。引言一般应与结论相呼应,在引言中提出的问题,在结论中应有解答,但也应避免引言与结论雷同。
2.5 引言不必交待开题过程和成果鉴定程序,也不必引用有关合同公文和鉴定的全部结论。
2.6 简短的引言,最好不要分段论述,不要插图列表和数学公式的推导证明。
Clone,Sub-CloneandSecretionExpressionofHumanDefensin6GeneinPichiapastoris
SHAN Ying, WU Xue-min, LU Ying
(Teach&Res.Div.ofImmunol.,LiaoningMed.Coll.,Jinzhou121001)
The feasibility of expression of human defensin 6 (HD-6) inPichiapastoriswas investigated in order to provide theoretical foundation and experiment bases for further study on HD-6 function. A primer was designed, from cDNA library a fragment of α HD6 gene was amplified with PCR method. Then inserted it into HD-6 segment into a clone vector pMD-18T. Then recombine the α HD-6 fragment with expression vector pPICZαA to obtain a recombinant expression vector of pPICZαA/HD-6 and then identified by electrophoresis and sequence analysis. After the constructedP.pastorisrecombinant plasmid pPICZαA/HD-6 was linearized bySacⅠ, then was transformed into competenceP.pastorisstrains GS115, screened on Zeocin plate, then identified the transformant with PCR. Induced through shaker flask fermentation and alcohol, the expression of recombinant HD-6 was analyzed by SDS-PAGE. The PCR results of HD-6 gene from cDNA library had the correct size and sequences. The results of electrophoresis and sequencing had all proved that the fragment had been cloned into the expression vector plasmid pPICZαA. The linearized recombinant plasmid pPICZαA/HD-6 had successfully transformed into competenceP.pastoris. The PCR identified results accorded with the one expected. Protein electrophoresis had proved that recombinant HD-6 had obtained secretion expression inP.pastoris. Suggested that the HD-6 could be realized the secretion expression inP.pastoris.
human defensin 6 (HD-6); expression plasmid;Pichiapastoris
辽宁省自然科学基金(201202140)
单颖 女,副教授。研究方向为感染免疫。Tel:0416-4673251,E-mail:1822518917@qq.com
2013-05-03;
2013-12-02
Q93-3;Q78;R392
A
1005-7021(2014)03-0061-05
10.3969/j.issn.1005-7021.2014.03.012