融合蛋白M-IL-2(88Arg,125Ala)在毕赤酵母中的表达及抗肿瘤活性研究
李 林 , 钱冬萌, 邵光灿, 闫志勇, 宋旭霞, 陈 豪, 王 斌
(青岛大学医学院 病原生物学教研室,山东 青岛 266071)
融合蛋白M-IL-2(88Arg,125Ala)在毕赤酵母中的表达及抗肿瘤活性研究
李 林 , 钱冬萌, 邵光灿, 闫志勇, 宋旭霞, 陈 豪, 王 斌*
(青岛大学医学院 病原生物学教研室,山东 青岛 266071)
构建融合基因蜂毒肽(melittin)与人变构白介素2(M-IL-2(88Arg,125Ala))毕赤酵母分泌型表达载体pPICZα A/M-IL-2(88Arg,125Ala),转化毕赤酵母菌株KM71H,甲醇诱导筛选出的多拷贝阳性菌株表达融合蛋白,纯化融合蛋白,并进行初步的抗肿瘤活性研究。经测序及PCR鉴定,M-IL-2(88Arg,125Ala)正确插入pPICZα A中,电转化后,重组载体通过同源重组整合到酵母基因组中,SDS-PAGE检测在26 ku左右有明显目的条带,与理论相符。经Western blot鉴定具有较高抗原性及特异性。BCA法测定甲醇诱导96 h融合蛋白表达量达315.2 mg/L。CCK-8法检测融合蛋白对人卵巢癌细胞SKOV3细胞及Hela细胞生长抑制作用,表明纯化的融合蛋白在体外能抑制人卵巢癌细胞SKOV3细胞及Hela细胞的生长增殖。该研究为融合蛋白M-IL-2(88Arg,125Ala)大规模制备和动物实验以及临床前期研究奠定了基础。
M-IL-2(88Arg,125Ala);毕赤酵母;表达;纯化;抗肿瘤活性
蜂毒肽(melittin)是蜂毒中的主要成分,是由26个氨基酸组成的碱性多肽[1],具有抗炎、降压、镇痛、抑制血小板凝集、抗辐射、抗菌、抗HIV、抗风湿关节炎及抗肿瘤等多种药理活性[2-3]。研究表明蜂毒肽还具有免疫调节功能,对多种肿瘤细胞有直接杀伤作用。Hood JL等[4]研究表明蜂毒肽能够干扰和抑制最初的HIV感染或潜在的其他膜病毒感染。然而蜂毒肽的溶血作用限制了其临床应用。人白细胞介素-2(human Interleukin-2, hIL-2)是一种细胞因子,能调节其他淋巴细胞的生长和分化,具有多种免疫调节功能相关的生物活性。临床上已经开始使用基因重组IL-2(rIL-2)作为治疗肾细胞癌、黑色素瘤、神经母细胞瘤、非何杰金氏淋巴瘤、结肠直肠癌、肝癌、膀胱癌等恶性肿瘤的药物[5]。研究表明基因变构IL-2能增强抗肿瘤活性,降低毒性[6-9]。但是IL-2对于其靶受体的选择性不高,在使用过程中显示出抗肿瘤的活性不够特异等问题。为解决以上问题,青岛大学医学院病原生物学教研室构建了融合蛋白M-IL-2(88Arg,125Ala),并在原核中得到成功表达[10-11]。初步研究融合蛋白M-IL-2(88Arg,125Ala) 具有较高的促进PBMC增殖,增强NK细胞的杀伤作用;体外实验证实其具有较显著的抑制人卵巢癌细胞SKOV3、人宫颈癌Hela细胞等癌细胞的增殖,体内实验证实该融合蛋白具有抑制鼠卵巢癌肿瘤生长的作用[12-14]。鉴于该融合基因采用原核表达系统表达产量低且对自身菌株具有杀伤作用,而毕赤酵母表达系统与原核表达系统相比,具有表达量高,真核生物表达时的蛋白质进行正确加工、修饰及合理的空间折叠等功能,非常有利于真核基因的表达,能有效克服大肠埃希菌系统缺乏蛋白翻译后加工、修饰的不足。为此本研究利用毕赤酵母表达系统表达M-IL-2(88Arg,125Ala),并进一步纯化该融合蛋白,对其生物学活性进行了初步研究,为大规模发酵生产M-IL-2(88Arg,125Ala)及其抗肿瘤、抗病毒活性研究奠定了基础。
1 材料与方法
1.1材料
1.1.1 菌株、质粒和细胞株 重组质粒pET/M-IL-2(88Arg,125Ala),大肠埃希菌DH5α均由本室保存。P.pastoris分泌表达载体pPICZα A、宿主菌KM71H(muts)购自Invitrogen公司。 人卵巢癌细胞SKOV3及Hela细胞由本室保存。
1.1.2 其他试剂EcoR I内切酶、KpnI内切酶、SacI内切酶、T4 DNA Ligase 购自NEB公司;Taq聚合酶购自TaKaRa公司。质粒提取试剂盒、切胶回收试剂盒购自康维公司;ZeocinTM抗生素购自Solarbio公司;兔抗人白介素2抗体,辣根过氧化物酶标记的羊抗兔IgG购自北京博奥森生物技术公司;YNB、山梨醇、生物素等购自Solarbio公司。CCK-8溶液购自SAB;改良型细胞培养液RPMI-1640购自赛默飞公司。
1.2方法
1.2.2 目的基因扩增及载体构建 通过引物P1、P2,以重组质粒pET/M-IL-2(88Arg,125Ala)为模板扩增目的基因(图1),EcoR I、KpnI对PCR扩增出的目的基因M-IL-2(88Arg,125Ala)及表达质粒pPICZα A分别进行双酶切后,T4 DNA连接酶连接为重组表达载体pPICZα A/M-IL-2(88Arg,125Ala)。
1.2.3 重组质粒转化大肠埃希菌DH5αCaCl2法制备大肠埃希菌感受态,化学法将重组质粒pPICZα A/M-IL-2(88Arg,125Ala)、空质粒pPICZα A转化感受态大肠埃希菌DH5α,37 ℃温育1 h, 50、100、200 μL涂布含25 μg/mL ZeocinTM抗生素的低盐LB培养基(LLB+Z)筛选阳性菌株,提取重组质粒、空质粒,经EcoR I、KpnI双酶切鉴定,并将重组质粒送测序。
1.2.4 毕赤酵母KM71H的电击转化及阳性菌株的筛选 用SacI单酶切重组表达载体pPICZα A/M-IL-2(88Arg,125Ala)、空表达载体pPICZα A。回收线性化的质粒5~10 μg,于1.5 kV,200 Ω,25 μF,8 ms条件进行电击转化毕赤酵母KM71H感受态后,立即向点击杯中加入1 mL 1 mol/L的预冷山梨醇,30 ℃温育1 h,分别50、100、200 μL涂布于含有100 μg/mL ZeocinTM的YPDS平板上(YPDS+Z),30 ℃培养箱培养3~5 d。将长出的菌株依次接种至含100、200、300 μg/mL ZeocinTM的YPD平板上,30 ℃培养箱培养,筛选多拷贝菌株。

图1 M-IL-2(88Arg, 125Ala) 基因序列Fig.1 The sequence of M-IL-2(88Arg, 125Ala)
1.2.5 重组酵母的PCR鉴定 利用玻璃珠破碎法提取重组有pPICZα A/M-IL-2(88Arg,125Ala)、pPICZα A重组酵母基因组及KM71H酵母基因组DNA,分别用AOX1通用引物(5′AOX1: GACTGGTTCCAATTGACAAGC,3′AOX1:GCAAATGGC ATTCTGACATCC)及M-IL-2(88Arg,125Ala)引物P1、P2两对引物检测外源基因的整合情况。
1.2.6 甲醇诱导表达 按毕赤酵母表达手册方法[15],从含300 mg/mL ZeocinTM的YPD平板上挑去多拷贝转化菌单菌落,接种至100 mL新鲜的BMGY培养基中,28~30 ℃,250 r/min条件下振荡培养18~24 h至OD600=2~6,收集菌液,3 000×g离心5 min,去除上清培养基,替换为20 mL BMMY培养基继续培养,培养条件为8层灭菌纱布封口,28 ℃,250 r/min振荡培养。每24 h补加甲醇至终浓度为0.5%,连续诱导72 h后,收集菌液,离心,将上清及沉淀分别置于-80 ℃保存。
1.2.7 优化诱导表达时间及表达量测定 挑取阳性克隆接种于100 mL新鲜的BMGY培养基中,28~30 ℃,250 r/min条件下振荡培养18~24 h至OD600=2~6,收集菌液,离心,去上清,用20 mL BMMY替换,继续培养,每24 h添加100%甲醇至终浓度为0.5%。每24 h吸取1 mL菌液,离心,取上清进行 SDS-PAGE,同时BCA法测定蛋白质浓度。
1.2.8 TCA沉淀、SDS-PAGE及Western blot检测表达产物 取200 μL表达酵母上清经TCA法浓缩,加20 μL超纯水溶解, 加20 μL载样缓冲液,沸水浴5 min,加样至聚丙烯酰胺凝胶中,跑电泳。同样,取适量诱导产物电泳后,将带有目的条带的凝胶切下,经电转仪转移至PVDF膜上,5%脱脂奶粉封闭3 h,羊抗人IL-2多抗封闭过夜,二抗辣根过氧化物酶(HRP)标记的羊抗兔IgG封闭2 h,每次换封闭液时用TBST清洗3次,每次10 min。化学发光试剂盒处理,在VILBER荧光凝胶成像仪中观察结果。
1.2.9 表达产物的纯化 将高表达菌体诱导表达,经SDS-PAGE及BCA法测试蛋白浓度得出在诱导96 h目的蛋白表达量达到最高峰,将诱导96 h表达上清过滤除去菌体残渣,经硫酸铵分级沉淀,将沉淀物重溶再经透析法透析,最后产物经Ni+亲和层析法纯化,经0.5 mol/L NaCl,0.02 mol/L PBS(pH 7.4)平衡液平衡Ni-琼脂糖凝胶6FF,分别用50、100、200、300、400 mmol/L咪唑,0.5 mol/L NaCl,0.02 mol/L PBS(pH 7.4)洗脱液洗脱,收集各个洗脱峰,经SDS-PAGE鉴定分析目的蛋白所在洗脱峰。收集的目的蛋白经Millipore超滤管浓缩目的蛋白,-80 ℃保存,用于分析鉴定及生物活性研究。
1.2.10 融合蛋白对人卵巢癌细胞SKOV3生长增殖的作用 参考文献[13],以人卵巢癌细胞SKOV3为实验对象,分别加入不同浓度梯度的纯化的融合蛋白(40、60、80、100、120、140 mg/L浓度各1份),以0.01 mol/L PBS(pH 7.2~7.4)作为阴性对照,反应体系为100 μL,每一浓度设6个复孔,设3块96孔板,分别培养24、48、72 h。在3个时间点分别加入CCK-8试剂检测细胞增殖作用。
1.2.11 融合蛋白对Hela细胞生长增殖的作用 参考文献[13],以Hela细胞为实验对象,分别加入不同浓度梯度的纯化的融合蛋白(2.5、5、10、20、40 mg/L 浓度各1份),以阿霉素作为阳性对照,以0.01 mol/L PBS(pH 7.2~7.4)作为阴性对照,反应体系为100 μL,每一浓度设6个复孔,培养72 h。加入CCK-8试剂检测细胞增殖作用。根据以下公式计算融合蛋白对细胞的抑制率:细胞生长抑制率=1-(融合蛋白OD/阴性对照OD)。
2 结果与分析
2.1重组酵母的表达载体的构建及鉴定
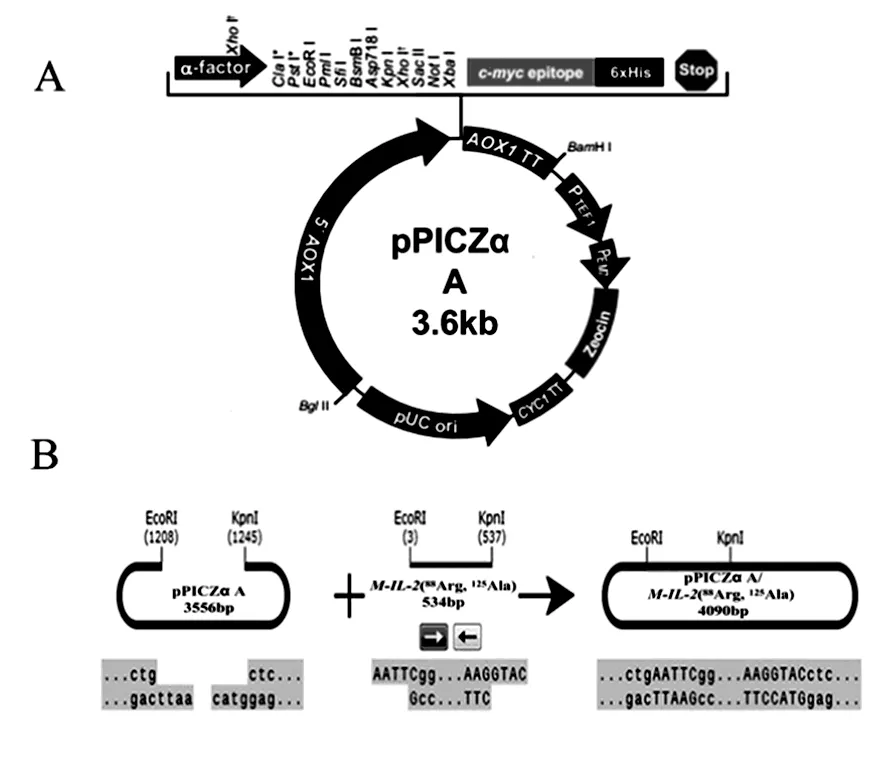
图2 质粒pPICZα A图谱(A)重组质粒pPICZα A/M-IL-2(88Arg, 125Ala) (B)构建过程Fig.2 The map of vector pPICZα A (A) Construction of the secreted expression vector pPICZαA/M-IL-2(88Arg, 125Ala) (B)
重组质粒构建策略如图2。用设计的引物P1、P2进行PCR扩增目的基因,将扩增的条带插入酵母表达载体pPICZα A(图2A)中,重组质粒以EcoR I、KpnI双酶切,电泳显示重组质粒酶切出现2条带,且插入片段长度约为500 bp,与理论值一致(图3)。同时提取重组质粒送上海生工生物工程有限公司测序,测序结果与理论一致,无碱基突变。

图3 重组质粒双酶切鉴定结果Fig.3 Identification of recombinant expression vector by EcoR I and Kpn I digestion
1:EcoR I 和KpnI 双酶酶切空质粒pPICZα A;2:EcoR I 和KpnI双酶酶切重组质粒pPICZαA/M-IL-2(88Arg,125Ala) ; M: DL 2000分子量标准
1: pPICZα A digested withEcoR I andKpnI; 2: recombinant clones digested withEcoR I andKpnI; M: DNA marker DL 2000
2.2重组酵母菌的鉴定
转化的阳性菌株经ZeocinTM梯度筛选,获得多拷贝阳性菌株,提取重组有pPICZα A/M-IL-2(88Arg,125Ala)、pPICZα A重组酵母基因组及KM71H酵母基因组DNA,经PCR鉴定结果见图4,从图4中可以看出,转化有空质粒的KM71H DNA 以P1、P2为引物PCR鉴定没有产生条带;以 5′AOX1、3′AOX1为引物PCR鉴定的目的条带约590 bp。转化重组质粒的KM71H DNA 以P1、P2为引物PCR鉴定的目的条带约500 bp;以 5′AOX1、3′AOX1为引物PCR鉴定的目的条带约为1.1 kb,与理论一致。
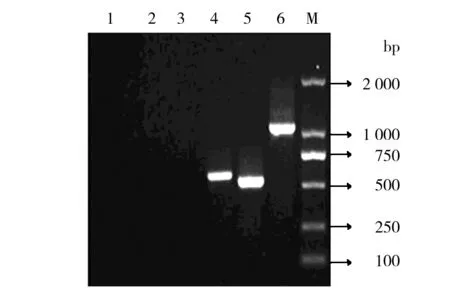
图4 重组酵母PCR鉴定
1:以5′AOX1 和3′AOX1为引物 KM71H DNA为模板扩增目的基因;2:以P1和P2为引物KM71H DNA为模板扩增目的基因;3:以P1和P2为引物KM71H/pPICZα A DNA为模板扩增目的基因;4:以5′AOX1和3′AOX1为引物KM71H/pPICZα A DNA为模板扩增目的基因;5:以P1和P2为引物KM71H/pPICZα A/M-IL-2(88Arg,125Ala) DNA为模板扩增目的基因;6:以5′AOX1和3′AOX1为引物KM71H/pPICZα A/M-IL-2(88Arg,125Ala) DNA为模板扩增目的基因;M: DL 2000分子量标准
1: KM71H DNA PCR by 5′AOX1 and 3′AOX1; 2: KM71H DNA PCR by P1 and P2; 3: KM71H/pPICZα A DNA PCR by P1 and P2; 4: KM71H/pPICZα A DNA PCR by 5′AOX1 and 3′AOX1; 5: KM71H/pPICZα A/M-IL-2(88Arg,125Ala) DNA PCR by P1 and P2; 6: KM71H/pPICZα A/M-IL-2(88Arg,125Ala) DNA PCR by 5′AOX1 and 3′AOX1; M: DL2000
2.3表达产物的SDS-PAGE检测及浓度测定

图5 96 h重组酵母菌株酵母培养基上清液SDS-PAGEFig.5 SDS-PAGE analysis of 96 h culture supernatant of KM71H/pPICZα A/M-IL-2(88Arg, 125Ala)
1:KM71H/pPICZα A表达上清样品;2:KM71H/pPICZα A/M-IL-2(88Arg,125Ala)表达上清样品;3:KM71H上清样品;M:蛋白质分子质量标准1: culture supernatant sample from KM71H/pPICZα A; 2: culture supernatant sample from KM71H/pPICZα A/M-IL-2(88Arg,125Ala); 3: culture supernatant sample from KM71H; M: protein Marker
考马斯亮蓝染色电泳图(图5)显示,KM71H转化重组子在26 ku左右表达出特异性条带,而未转化的菌株及转化了空载体的酵母菌株均未有特异条带产生。图6A显示每24 h KM71H/pPICZα A/M-IL-2(88Arg,125Ala) 重组酵母菌株表达产物SDS-PAGE。经BCA法检测(图6B)分泌蛋白表达量随培养时间增加而上升(P<0.05),在96 h时达到最高峰。因此判断最佳诱导表达时间为96 h,分泌蛋白总浓度达到435.3 mg/L,经灰度软件Image J分析,目的蛋白占分泌总蛋白的72.4%,即在诱导表达时间为96 h时,毕赤酵母分泌目的蛋白浓度为315.2 mg/L。
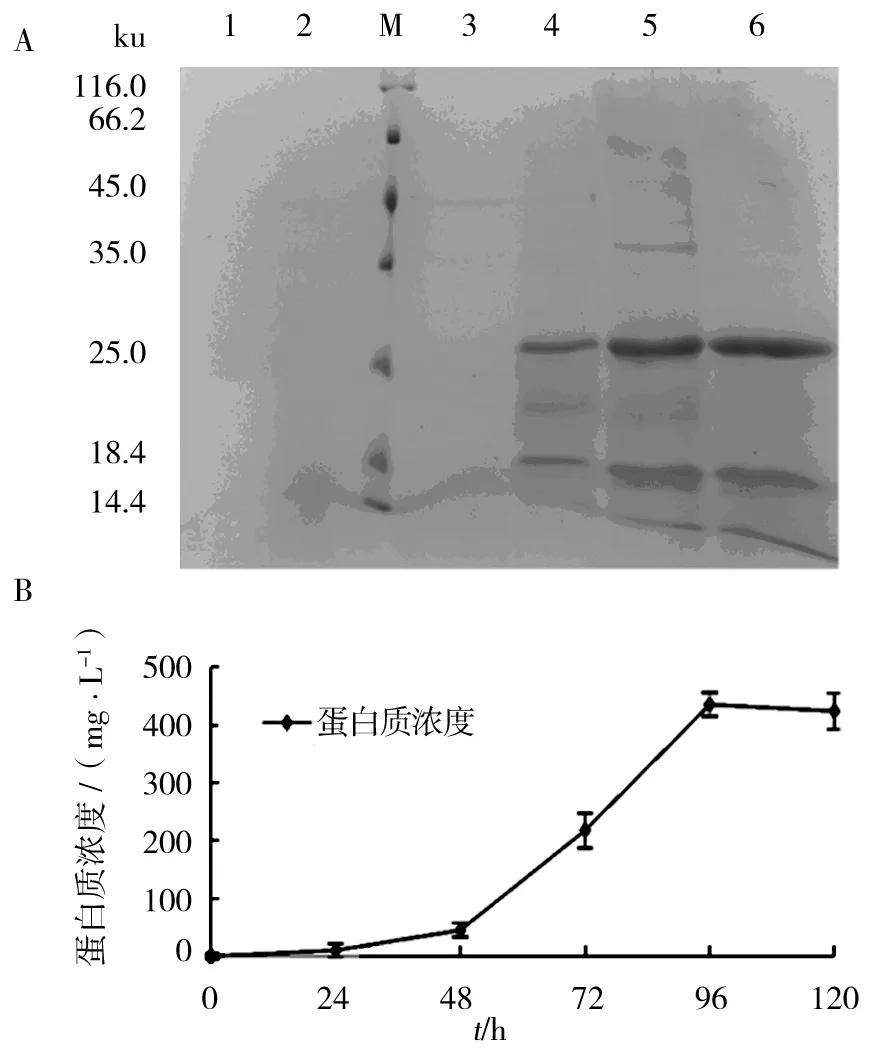
图6 分泌蛋白与诱导时间关系Fig.6 The relatronship of secretory proteins with induction time
1:0 h 分泌上清液样品;2:24 h 分泌上清液样品;3:48 h分泌上清液样品;4:72 h分泌上清液样品;5:96 h分泌上清液样品;6:120 h 分泌上清液样品;M:蛋白质分子质量标准1: 0 h culture supernatant; 2: 24 h culture supernatant; 3: 48 h culture supernatant; 4: 72 h culture supernatant; 5: 96 h culture supernatant ; 6: 120 h culture supernatant; M: protein Marker
2.4Westernblot鉴定目的蛋白
将位于26 ku左右的蛋白条带切下,用羊抗人IL-2多克隆抗体进行Western blot分析鉴定,图7结果显示,融合蛋白能与羊抗人IL-2多抗反应结合,具有特异性和抗原活性。

图7 融合蛋白的Western blot鉴定
1:融合蛋白M-IL-2(88Arg,125Ala)样品;2:阴性对照
1: M-IL-2(88Arg,125Ala) fusion protein;2: negative control
2.5目的蛋白纯化
阳性重组酵母KM71H经甲醇诱导表达96 h,收集菌液上清,硫酸铵分级沉淀法初步纯化分泌蛋白(30%、80%),目的蛋白M-IL-2(88Arg,125Ala)在硫酸铵80%饱和度析出;经透析、镍离子亲和层析得到纯化目的蛋白,经SDS-PAGE分析(图8), 目的蛋白在200 mmol/L咪唑+PBS(pH 7.4)处可被洗脱。经Image J软件进行灰度分析,融合蛋白纯度达到99%。纯化的M-IL-2(88Arg,125Ala)经millipore浓缩至2 mL。BCA法检测浓缩后融合蛋白浓度为273.5 mg/L。

图8 纯化后目的蛋白M-IL-2(88Arg, 125Ala) SDS-PAGE
1:纯化后融合蛋白M-IL-2(88Arg,125Ala)样品;M:蛋白质分子质量标准
1: purified M-IL-2(88Arg,125Ala); M: protein Marker
2.6融合蛋白对人卵巢癌细胞SKOV3生长抑制作用
如图9所示,融合蛋白对人卵巢癌细胞SKOV3有明显的生长抑制作用。经统计学分析,融合蛋白抑制率40 mg/L和60 mg/L比较,没有显著性,P>0.05。在60 mg/L后,随浓度升高和作用时间的延长,抑制率提高,其抑制作用具有浓度和时间显著性(P<0.05)。

图9 融合蛋白M-IL-2(88Arg, 125Ala)抑制人卵巢癌细胞SKOV3生长增殖关系曲线Fig.9 Effect of M-IL-2(88Arg, 125Ala) fusion protein on ovarian cancer SKOV3 cells
2.7融合蛋白对Hela细胞生长抑制作用
融合蛋白不同浓度(2.5、5、10、20、40 mg/L)处理Hela 细胞,分别作用24、48及72 h后检测Hela增长率表明,在所有浓度下,作用72 h时抑制效果最佳。因此在以后的检测中,只检测不同浓度融合蛋白作用72 h时对Hela细胞的抑制作用。 如图10所示,融合蛋白对Hela 细胞生长具有明显的抑制作用,且在10、20、40 mg/L浓度下与阿霉素作用相比P<0.05,具有统计学意义。
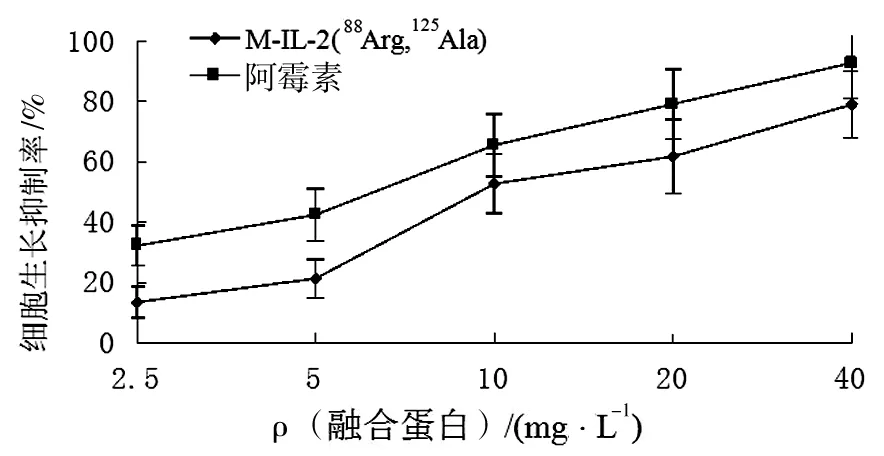
图10 融合蛋白M-IL-2(88Arg,125Ala)抑制Hela细胞生长增殖关系曲线Fig.10 Effect of M-IL-2(88Arg,125Ala) fusion protein on Hela cells
3 讨 论
毕赤酵母表达系统是应用最为广泛的酵母表达系统,近年来发展迅速,目前国内外已利用该系统表达了一系列重要具有生物学活性的蛋白质,如白细胞介素2(IL-2)[9]、CTLA-4[16]、内毒素中和蛋白[17]、甘油激酶[18]、融合蛋白rhIL-2-HSA[19]等。毕赤酵母能够广泛应用,原因在于其具有以下优点:具有目前最强,调控机理最严格的启动子之一醇氧化酶AOX1基因启动子;表达质粒能在基因组的特定位点以单拷贝或多拷贝的形式稳定整合; 菌株易于进行高密度发酵,外源蛋白表达量高;毕赤酵母中存在过氧化物酶体,表达的蛋白贮存其中,可免受蛋白酶的降解,而且减少对细胞的毒害作用;高效分泌表达质粒能将外源蛋白表达后,进行翻译后加工处理,将外源蛋白分泌到细胞外,不但提高表达蛋白的活性,而且有利于产物的纯化;菌株易于进行高密度发酵,外源蛋白表达量高,适于大规模工业生产。
本研究首次成功地在毕赤酵母系统中分泌表达了具有抗肿瘤活性的融合蛋白M-IL-2(88Arg,125Ala)。经过5 d连续诱导表达,通过BCA法测定每24 h蛋白表达量,发现随着诱导时间的延长,M-IL-2(88Arg,125Ala)在酵母上清中含量呈上升趋势,表明该融合蛋白稳定性较好。本研究中该融合蛋白在0.5%甲醇诱导、8层纱布封口、28 ℃、250 r/min条件下摇瓶表达量达到了315.2 mg/L,远远高于目前大肠埃希菌表达水平,如果使用发酵罐表达,预期目的蛋白表达量将会进一步提高。
在大肠埃希菌表达系统中,该目的蛋白占蛋白总量36%,而本研究中M-IL-2(88Arg,125Ala)的含量占酵母分泌蛋白总量的72.4%左右,优于大肠埃希菌表达系统。酵母菌自身分泌蛋白少,给下游纯化带来了极大的方便。本实验采用硫酸铵分级沉淀、透析法、镍离子亲和层析的纯化流程对目的蛋白进行纯化,纯化工艺相对简单,避免了多步层析对蛋白量及蛋白活性的损害,目的蛋白纯度达到99%。将不同浓度的纯化的融合蛋白对人卵巢癌细胞SKOV3及Hela细胞进行直接作用,CCK-8法检测细胞增殖率,表明M-IL-2(88Arg,125Ala)对卵巢癌细胞SKOV3细胞生长和Hela细胞具有明显生长抑制作用,且抑制效率远高于该融合蛋白在大肠埃希菌中表达后检测的结果[11-13]。
通过以上分析,本研究成功利用毕赤酵母表达系统高效表达了具有抗肿瘤活性的融合蛋白M-IL-2(88Arg,125Ala),为进一步研究其生物学活性,用于动物实验以及抗肿瘤、抗病毒感染等研究奠定了基础。
[1] Endo Y, Mitsui K, Motizuki M, et al. The mechanism of action of ricin and related toxic lectins on eukaryotic ribosomes[J].J Biol Chem,1987,262(12):5908-5912.
[2] 汪家政,范明.蛋白质技术手册[M].北京:科学出版社, 2000:189.
[3] Luykx DM, Dingemanse PJ, Goerdayal SS, et al. High-performance anion-exchange chromatography combined with intrinsic fluorescence detection to determine erythropoietin in pharmaceutical products[J].J Chromatogr A,2005,1078(1-2):113-119.
[4] Hood JL, Jallouk AP, Campbell N, et al. Cytolytic nanoparticles attenuate HIV-1 infectivity[J]. Antivir Ther,2013,18(1):95-103.
[5] N. Ambrosino.Noninvasive mechanical ventilation in acute respiratory failure[J]EurRespir J,1996,9:795-807.
[6] Armen BS, Yue L, Marie CS. A T-cell-selective interleukin-2 mutein inexhibits potent antitumor activity and is well tolerated in vivo[J].Nature Bio,2000,18:1197-1202.
[7] Ju G, Collins L, Kaffka K L, et al. Structure function analysis of human interleukin-2[J].J BioChem,1987,262:5723-5731.
[8] 孟林,刘明军,王斌,等.88Arg IL-2的克隆构建及原核表达[J].青岛大学医学院学报,2006,42(4):333-336.
[9] Yan Liu, Xun-Yan Xiao, Min Sun et al. Expression and Purification of a Mutant of Human Interleukin-2 in Pichia pastoris[J].Applied Biochemistry and Biotechnology,2006,133(1):77-86.
[10]郑旭,鲁晓晴,赵巍,等. 蜂毒肽与变构hIL-2融合基因原核表达载体的构建[J].公共卫生与临床医学, 2009, 5(1): 29-31.
[11]刘明军,王斌,钱冬萌,等.重组蜂毒素-基因变构IL-2的纯化与生物活性[J].中国生物制品学杂志,2006,19(6):623-626.
[12]丁守怡,钱冬萌,侯伟,等.蜂毒肽-IL-2嵌合蛋白的生物学活性检测[J].细胞与分子免疫学杂志, 2005,21(4):502-505.
[13]刘明军,宋旭霞,王斌.Melittin-IL-2融合蛋白的抗肿瘤活性[J].中华微生物学和免疫学杂志,2009,29(1):77-78.
[14]Mingjun Liu , Jinbao Zong, et al. A novel melittin-MhIL-2 fusion protein inhibits the growth of human ovarian cancer SKOV3 cells in vitro and in vivo tumor growth[J].Cancer Immunology Immunotherapy,2013,62(5):889-895.
[15]Invitrogen, EasySelectTMPichiaExpression Kit User Manual[J].Manual part no,2010, 25-0172.
[16]Peraino J, Zhang H, Hermanrud C E, et al. Expression and purification of soluble porcine CTLA-4 in Pichia pastoris[J].Protein expression and purification,2012,82(2):270-278.
[17]Paus E J, Willey J, Ridge R J, et al. Production of recombinant endotoxin neutralizing protein in Pichia pastoris and methods for its purification[J].Protein expression and purification, 2002,26(2):202-210.
[18]R. Janke, Y. Genzel, S. Freund, et al. Expression, purification, and characterization of a His6-tagged glycerokinase from Pichia farinosa for enzymatic cycling assays in mammalian cells[J].Journal of Biotechnology,2010,150:396-403.
[19]Lei J, Guan B, Li B, et al. Expression, purification and characterization of recombinant human interleukin-2-serum albumin (rhIL-2-HSA) fusion protein in Pichia pastoris[J].Protein Expression and Purification,2012,84(1):154-160.
Expression&AntitumorActivityofFusionProteinM-IL-2(88Arg,125Ala)inPichiapastoris
LI Lin, QIAN Dong-meng, SHAO Guang-can, YAN Zhi-yong, SONG Xu-xia, CHEN Hao, WANG Bin
(Teach. &Res.Div.ofPathog.Biology,QingdaoUni.Med.Coll.,Qingdao266071)
Pichiapastorisexpression vector of excretive type pPICZα A/M-IL-2(88Arg,125Ala) was constructed by fusion gene melittin and human metamer interleukin 2(M-IL-2(88Arg,125Ala)) inP.pastoris, and transformedP.pastorisstrain KM71H, methanol-induced and screened out a multicopy positive expression fusion protein, purified the fusion protein, and carried out initial study on its antitumor activity. It was identified through sequencing and PCR thatM-IL-2(88Arg,125Ala) was correctly inserted into pPICZαA and after electro-transformation, the recombinant vector was integrated into the genome of the yeast through homologous recombination, and it was tested by SDS-PAGE that there was an obvious band of 26 ku that accorded with theory. It had fairly high antigenicity and specificity through Western blot. The methanol-induced for 96 h protein expression was as high as 315.2 mg/L through BCA testing method. The fusion protein was tested by CCK-8 method for its inhibition against human oophocarcinoma cell SKOV3 and HeLa cell, suggested that the purified fusion protein could in vitro inhibit the growth and proliferation of oophocarcinoma cell SKOV3 and HeLa cell. The study had laid a foundation for large-scale preparation of fusion protein of M-IL-2(88Arg,125Ala) and animal experiment as well as early stage of clinical research.
M-IL-2(88Arg,125Ala);Pichiapastoris; expression; purification; antitumor activity
山东省科技攻关项目(2007GG3WZ05009);山东省优秀中青年科学家科研奖励基金(BS2011SW005)
李林 女,硕士研究生。主要从事病毒基因工程与蛋白质组学研究。Tel:0532-83780059,E-mail: linzi211@126.com
* 通讯作者。男,博士,博士生导师。研究方向为病毒基因工程与蛋白质组学研究。Tel:0532-83780032,E-mail: qdmblm@163.com
2013-11-04;
2013-11-14
Q789
A
1005-7021(2014)02-0047-07
10.3969/j.issn.1005-7021.2014.02.010

