同一胎鼠肠和脑神经干细胞神经递质的表达
夏立广,李仲荣,刘森清,王永飚,朱利斌,赵一鸣
(温州医科大学附属第二医院 育英儿童医院 小儿外科,浙江 温州 325027)
神经递质是发生突触联系的中介,经典神经递质目前已经明确的胆碱类主要为乙酰胆碱(acetylcholine,Ach),单胺类包括肾上腺素、去甲肾上腺素(noradrenaline,NA)、多巴胺、5-羟色胺,氨基酸类包括谷氨酸、门冬氨酸、γ-氨基丁酸(gammaaminobutyric acid,GABA)、甘氨酸等,以及其他的神经递质包括一氧化氮(nitric oxide,NO)、一氧化碳、前列腺素、P物质、组氨和神经肽等。几乎所有中枢神经系统中的递质均存在于肠神经系统中。本实验研究有代表性的Ach、NO、NA、GABA这4种递质在肠神经干细胞和脑神经干细胞间的差异,为今后如何获得合适的、有功能的、能长期使用的移植干细胞提供理论和实验依据。
1 材料和方法
1.1 材料 DMEM/F12、N2-supplement、B27-supplement、青霉素/链霉素、0.25%胰酶-EDTA为Gibco公司产品;bFGF、EGF、粗胶原酶、维甲酸、锥虫蓝为Sigma公司产品;二巯基乙醇、HFN为Chemicon公司产品;兔抗GABA、神经元型一氧化氮合酶(neurona nitric oxide synthase,nNOS)、胆碱乙酰转移酶(choline acetyltransterase,ChAT)、多巴胺β羟化酶(dopamine β-hydroxylase,DβH)、兔IgG同型对照抗体为abcam公司产品;DyLight488荧光二抗为KPL公司产品;酶标山羊抗兔二抗为PTG公司产品;固定通透试剂盒为BD公司产品;DAB显示试剂盒为武汉博士德产品;低熔点琼脂糖为上海捷瑞生物工程有限公司产品;倒置显微镜为Olympus公司产品;流式细胞仪为BD公司产品;CO2培养箱为Thermo公司产品。实验动物为孕20 d的SD大鼠(清洁级),由温州医科大学实验动物中心提供。
1.2 培养液及2种神经干细胞原代、传代培养及鉴定方法 从孕20 d的同一SD胚鼠中分别提取肠神经干细胞和脑神经干细胞,采用改良的神经干细胞培养液反复传代,取传代培养6~10 d后得到的2种不同来源的神经细胞球。参见文献[1-2]。
1.3 神经递质标志物 Ach、NO、NA、GABA这4种递质相对应的标志物分别为ChAT、nNOS、DβH、GABA抗体。
1.4 琼脂糖预包埋免疫细胞化学检测 本实验选用的一抗分别为:1∶15 000抗GABA,1∶100抗nNOS,1∶1 000抗ChAT,1∶2 000抗DβH。将传代培养得到2种不同来源的神经细胞球进行琼脂糖预包埋,分别制成石蜡切片。常规处理经GABA、nNOS、ChAT、DβH免疫细胞化学染色,DAB显色后苏木素复染。具体步骤参见文献[2]。
1.5 流式细胞仪检测 本实验选用的一抗分别为:1∶300抗GABA,1∶30抗nNOS,1∶100抗ChAT,1∶200抗DβH。分别设有同型对照组,流式细胞仪测定2种不同来源神经干细胞GABA、nNOS、ChAT、DβH荧光染色阳性细胞数目,每次每组测3管细胞,重复3次,计算阳性细胞合计率。具体步骤参见文献[2]。
1.6 统计学处理方法 采用SPSS16.0统计学软件。免疫细胞化学检测数据以±s表示,采用方差分析,流式细胞仪检测数据采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 琼脂糖预包埋免疫细胞化学检测结果 分别设有空白对照组(见图1)、GABA、nNOS、ChAT、DβH组(见图2-5),其阳性细胞的胞浆为黄色。
保持显微镜下相同条件下,全部用手动设置等条件下,拍摄400倍照片,每张切片随机拍摄3个视野,重复3次,每组共9张,并使用IPP6.0软件分析,把图像中呈现黄色的区域作为AOI(area of interest)进行分析。选择测量参数为累积面积、平均光密度和累积光密度(integrated optical density,IOD)。2种不同神经干细胞GABA、nNOS、ChAT、DβH组与相应的空白对照组相比:肠神经干细胞nNOS组、ChAT组累积面积、平均光密度和IOD与空白对照组相比,差异有统计学意义(P<0.05);脑神经干细胞nNOS组、ChAT组、DβH组累积面积、平均光密度和IOD与空白对照组相比,差异有统计学意义(P<0.05)。见表1。

图1 空白对照组神经球琼脂糖预包埋石蜡切片免疫细胞化学染色(×400)

图2 GABA组神经球琼脂糖预包埋石蜡切片免疫细胞化学染色(×400)
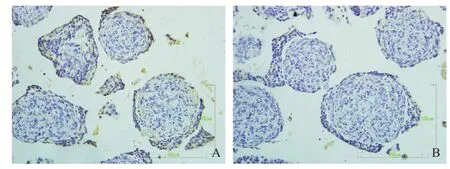
图3 nNOS组神经球琼脂糖预包埋石蜡切片免疫细胞化学染色(×400)
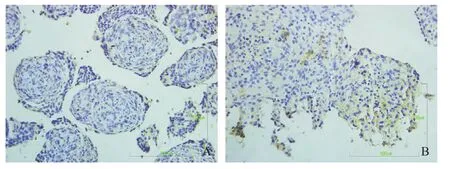
图4 ChAT组神经球琼脂糖预包埋石蜡切片免疫细胞化学染色(×400)

图5 DβH组神经球琼脂糖预包埋石蜡切片免疫细胞化学染色(×400)
2.2 流式细胞仪检测结果 流式细胞仪检测提示:肠神经干细胞GABA、nNOS、ChAT、DβH阳性细胞合计率分别为1.59%、14.97%、5.43%、1.36%,其中nNOS、ChAT与相应的同型对照组比较差异有统计学意义(P<0.05);而脑神经干细胞GABA、nNOS、ChAT、DβH阳性细胞合计率分别为1.68%、6.14%、25.42%、9.30%,其中nNOS、ChAT、DβH与相应的同型对照组比较差异有统计学意义(P<0.05)。见表2。
综合上述结果提示,肠神经干细胞表达的神经递质为NO和Ach,且以NO为主;脑神经干细胞表达的神经递质为NO、Ach和NA,且以Ach为主。GABA在2种神经干细胞中均无明显表达;NA在脑神经干细胞中有表达,而在肠神经干细胞中不表达。
通过比较均表达NO和Ach的2种不同来源神经干细胞nNOS组和ChAT组相关参数显示,肠神经干细胞表达的NO总量以及每个nNOS阳性细胞的NO的含量均较脑神经干细胞高;而脑神经干细胞表达的Ach总量较肠神经干细胞高,但每个ChAT阳性细胞的Ach含量却是肠神经干细胞高。
3 讨论
神经递质通过突触联系传递各种信息而实现调节机体生理功能的作用,几乎所有的神经递质均存在于中枢神经系统和肠神经系统中。
GABA是中枢神经系统中主要的抑制性神经递质,发育脑及原代培养的脑细胞研究证明,在突触形成之前GABA作用具有多样性,但在神经发育早期,GABA的确切作用仍不清楚。Pontes等[3]研究表明,GABA通过离子移变A受体和代谢性B受体,对神经干细胞、神经前体细胞、成神经细胞进行正性刺激。在消化系统中GABA除了作为神经递质外,还是一种胃肠激素。Weigert等[4]研究证实GABA参与迷走神经调节的胃泌素和生长抑素的释放。在幽门结扎的大鼠中,GABA和巴氯芬通过增加胃黏液分泌,抑制胃蛋白酶分泌,降低胃黏膜细胞脱落,发挥胃黏膜保护作用[5]。有报道[6]称GABA可通过GABA(B)受体的介导抑制肠段的收缩。我们的数据显示GABA在肠神经干细胞及脑神经干细胞中均无明显表达,考虑原因可能是我们所采用的神经干细胞培养液不适合神经干细胞的GABA能神经元表达,GABA能神经元是产生和释放GABA的主要来源。有报道[7]称Mash1与Hes1共表达时,能够促进GABA能神经元形成,而骨形成蛋白-2[8]可促进室管膜下区的神经干细胞向GABA能神经元的分化,增加这些因素的表达及含量可能也有利于我们所培养的这2种神经干细胞的GABA能神经元表达。
表1 神经干细胞4种神经递质免疫细胞化学检测结果(±s)

表1 神经干细胞4种神经递质免疫细胞化学检测结果(±s)
与空白对照组相同指标比:aP<0.05
组别 累计面积 平均光密度 IOD肠神经干细胞 脑神经干细胞 肠神经干细胞 脑神经干细胞 肠神经干细胞 脑神经干细胞空白对照组 1 261±24 1 245±40 0.095±0.005 0.096±0.004 122±7 124±6 GABA组 1 299±43 1 260±58 0.096±0.003 0.100±0.007 127±6 128±10 nNOS组 34 641±1 195a 17 845±601a 0.185±0.004a 0.132±0.004a 5 954±195a 2 556±103a ChAT组 24 895±874a 64 921±2 912a 0.153±0.005a 0.139±0.004a 4 011±187a 11 718±485a DβH组 1291±65 43 788±1 517a 0.100±0.009 0.145±0.007a 129±14 7 208±419a

表2 神经干细胞4种神经递质流式细胞仪检测结果
NO在中枢神经系统中起着至关重要的作用。在正常脑组织内,NO对于神经前体细胞的增殖具有负相的调节作用,但在脑损伤后,在不同的神经和非神经细胞中过剩的NO促进了神经发生[9]。萨喆燕等[10]研究发现,NO促进大鼠脑室下区神经干细胞分化。有研究表明NO是一种受神经营养因子影响的旁分泌信使,通过对新产生的神经元进行调节来控制神经前体细胞的增殖和分化[11]。也有研究表明NO的调节是双向的,神经干细胞nNOS表达既促进其增殖也是其分化所必需的;而神经元的nNOS表达抑制神经干细胞增殖,阻碍其分化[12]。NO在消化道系统[13]中的作用不言而喻,肠神经元直接控制肠壁肌肉活动,它主要通过兴奋性的胆碱能神经和抑制性的氮能神经发挥作用。NO可以松弛离体人类正常结肠及无神经节细胞肠段巨结肠肌条,是正常结肠及无神经节细胞症结肠松弛反应的递质。氮能神经元功能异常或缺陷是肠神经肌肉疾病的一个重要病因[14-16],可导致先天性巨结肠、贲门失弛缓和幽门肥厚性狭窄等疾病。这些研究结果给由NO引起的临床上一些神经系统性疾病治疗带来可喜的理论前景。本实验结果显示NO在2种神经干细胞中均有表达,但肠神经干细胞NO的表达量及每个nNOS阳性细胞NO的含量较脑神经干细胞高,这提示在相同的条件下肠神经干细胞可能比脑神经干细胞更适合作为诱导氮能神经元的种子细胞,治疗上述疾病。
在大脑内,末梢释放Ach的胆碱能神经元广泛分布在脑干及前脑,主要参与机体心血管活动、摄食、觉醒、感觉、运动等的调节。Winkler等[17]将基因修饰的胆碱能细胞移植于大鼠基底神经核后可以改善空间定向能力。另外,胆碱能细胞对记忆功能也有改善作用[18]。有研究表明Ach促进了神经干细胞及其子代细胞的增殖和分化,拮抗剂阿托品则阻断这种增强作用,并抑制神经干细胞的分化[19]。胆碱能神经元是肠道种类最多的一种神经元,包括感觉、运动、分泌及中间神经元。Ach是肠道副交感神经、迷走神经及盆神经主要的神经递质,胆碱能神经元对肠道动力主要起兴奋的作用。本组数据显示Ach在2种神经干细胞中均有表达,脑神经干细胞Ach的表达总量较肠神经干细胞高,但每个ChAT阳性细胞的含量却比肠神经干细胞低。这提示在相同的条件下脑神经干细胞比肠神经干细胞含有更多胆碱能神经元,但两者间不可以认为只有量的不同。这可能与肠神经干细胞含量较少,有较多其他组织细胞混杂有关,如果将肠神经干细胞进一步纯化的话,胆碱能神经元的含量可能会得到提高,也同样适合作为诱导胆碱能神经元的种子细胞,治疗相关的疾病。有报道[20]称Lhx8高表达促进海马神经干细胞往胆碱能神经元分化,是否试用其他神经干细胞有待进一步研究。
中枢去甲肾上腺素能神经元胞体在蓝斑聚集,发出神经纤维投射到脑的各个部位,在脑内形成了弥散连接,构成了中枢NA发挥作用的神经解剖学基础,参与心血管活动、体温、情绪活动的调节,也与维持大脑皮质的觉醒状态有关。有研究[21]报道基因敲除小鼠绝大部分难以存活,其主要原因是蓝斑不能合成NA来完成机体多种功能的调节。在消化系统,交感神经末梢释放NA,通过其受体Naα对胃肠运动起抑制作用。有学者认为,功能性胃排空障碍是胃肠交感神经活动增强,胃壁释放NA或其他抑制性物质直接与胃肠平滑肌细胞膜上的受体结合,阻止胃肠平滑肌中的副交感神经释放Ach,从而抑制胃的肌电活动,延缓胃的排空,这是目前被认为产生这种疾病的主要发病机制[22]。本实验数据显示NA只在脑神经干细胞中表达,在肠神经干细胞中未见表达,免疫细胞化学检测结果及流式数据显示两者在NA方面差异较大。这可能与这2种神经干细胞的来源本身属性有关,脑神经干细胞可能更适合作为诱导去甲肾上腺素能神经元的种子细胞,治疗相关的疾病。此外,Mong等[23]报道通过对胚胎干细胞在适当的信号条件下导入Phox2b,去甲肾上腺素能神经元可以高效率诱导,为获得更多特定的去甲肾上腺素能神经元种子细胞提供可能。

