射频消融术治疗骨转移瘤回顾性研究
李 伟,曹 亮,盛 俊,幺建立,彭 勋,彭 勇
射频消融术治疗骨转移瘤回顾性研究
李 伟1,曹 亮2,盛 俊1,幺建立1,彭 勋1,彭 勇3
目的观察射频消融术对肝癌、肺癌及乳腺癌骨转移瘤的临床疗效。方法回顾性分析秦皇岛市第三医院肿瘤科肝癌22例、肺癌12例及乳腺癌8例伴有骨转移瘤患者采用射频消融术治疗情况。观察指标包括射频消融术实施的完整性、可行性及安全性,术前1个月,术后1周及1个月,应用NRS评分评估疼痛的控制,KPS(karnofsky)评分系统评估功能状态,应用EORTC QLQ-C30评估生活质量。结果42例全部成功实施了射频消融术,有11例(26.2%)术后1周内疼痛较术前轻度加重,其余31例疼痛均不同程度缓解。1个月后所有患者疼痛较术前明显缓解(P<0.01)。KPS 评分由术前的(74.05±11.92)分提高到术后的(88.64±6.28)分,功能状态较术前明显好转(P<0.05)。术前EORTC QLQ-C30评分为(85.50±8.59)分,术后1周为(60.88±9.50)分,术后1个月为(51.38±7.48)分,患者生活质量明显提高(P<0.05)。结论射频消融术对骨转移瘤的治疗是安全、有效的,并且可明显改善患者癌痛、功能状态和生活质量。
射频消融术;骨转移瘤;骨疼痛;生活质量
骨骼是晚期恶性肿瘤转移的常见部位,仅次于淋巴结和肺[1]。据统计,临床上有4%~13% 恶性肿瘤患者发生骨转移[2]。其常见并发症包括骨痛、病理性骨折、功能障碍等,危害性极大,严重影响患者的生活质量。射频消融术是近年来日益受到重视的微创治疗手段之一,目前对癌症骨转移的治疗还没有大规模开展。据报道,射频消融术可改善患者的生活质量,有效防止和减少骨相关事件发生,患者耐受性好,不良反应少[3]。但其确切疗效有待临床进一步验证。为此,笔者回顾42例应用射频消融术治疗骨转移瘤的临床资料,旨在研究射频消融术对肝癌、肺癌及乳腺癌骨转移瘤的疗效。
1 对象与方法
1.1 对象 收集秦皇岛市第三医院2008-02至2012-03收治的骨转移肿瘤42例资料,其中男38例,女4例,年龄48~67岁,平均(56.6±7.6)岁。术前1个月应用NRS评分评估疼痛的程度,KPS(karnofsky)评分系统评估功能状态,应用EORTC QLQ-C30评分评估生活质量。治疗前所有患者行相关检查,对身体状况、手术风险、手术效果及术后并发症等行综合评估,所有患者均能够耐受手术,术前均详细交代病情及相关风险,家属均签订知情同意书。患者基本情况见表1。
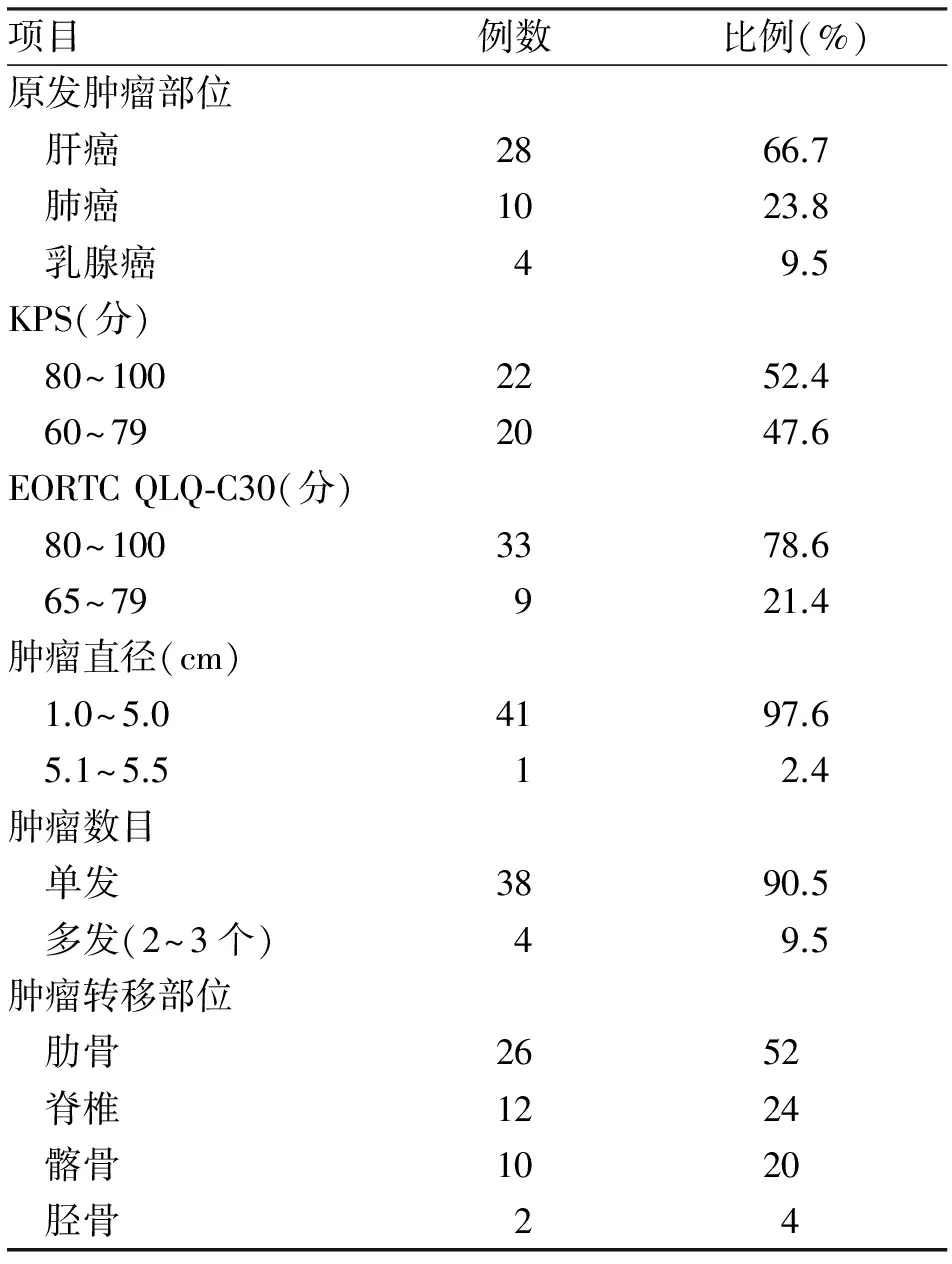
表1 42例骨转移肿瘤患者基本情况 (n=42)
1.2 方法
1.2.1 手术过程 肿瘤部位超声检查确定进针点、进针角度和布针方案,准确定位,选择穿刺点局部麻醉、静脉镇痛、 手术区域常规消毒、铺巾。参照各消融治疗仪的说明,进行消融治疗,逐点进行。对于直径≥5 cm转移瘤采取一针多点的重叠消融方式以保证消融范围和减少漏空的发生。消融完成后,争取在拨针时进行针道消融,防止术后出血和肿瘤沿针道种植。治疗结束前,进行再次超声全面扫描,确定消融范围已经完全覆盖肿瘤,对0.5~1.0 cm 的安全消融边界,排除可能出血、(血)气胸等并发症。
1.2.2 围术期处理 术后常规禁食、监测生命体征4 h,卧床6 h以上,注意监测血常规、肝肾功能等,并给予护肝、预防感染、镇痛、止血治疗。
1.2.3 疗效评估 术后1周、1个月进行疼痛数字评估(numerical rating scale, NRS),将一条10 cm长的直线划为10等份,最左面为0,代表无痛,最右面为10,代表患者能想象的最强剧烈疼痛,然后让患者根据自己的疼痛体验在此线上标记。轻度疼痛1~3分;中度疼痛4~6分;重度疼痛7~10分。应用KPS 评分系统对功能状态进行评分。最低分为0分,最高分为100分,得分越高一般状况越好,反之越差。采用EORTC QLQ-C30 ( Version 3.0) 方法问卷调查评价[4]。该评分标准包括5个功能领域:躯体功能,角色功能,情绪功能,任何功能和社会功能;3个症状为疲乏、恶性呕吐和疼痛。该量表计分将各项目所包括的条目得分相加,并除以包括的条目数得到该项目粗分,再将粗分转化为在0~100内取值的标准化得分。症状项和总体生活质量项得分越高说明功能状态和生活质量越好。
1.3 统计学处理 应用SPSS 16.0 统计软件对疼痛评估、KPS及EORTC QLQ-C30进行手术前后比较,配对样本采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 疼痛评估 42例均成功完成骨转移射频消融术,术后1周内有11例(26.2%)疼痛加重2~4分,对症处理后疼痛可控制在0~2分。其余31例疼痛均不同程度缓解。术后与术前疼痛NRS评分相比,差异有统计学意义(P<0.01,表2)。
2.2 各项指标评估 与术前比较,术后EORTC评分显著降低,患者术后生活质量较术前明显提高,差异有统计学意义(P<0.01)。术后1周、1个月KPS 评分与术前相比均有提高,术后1个月有明显提高,达(88.64±6.28)分,患者功能状态较术前明显好转,差异有统计学意义 (P<0.01,表2) 。
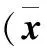
表2 骨转移肿瘤患者行射频消融术前、术后各项指标比较 ±s)
注:与治疗前比较,①P<0.01
3 讨 论
目前,恶性肿瘤呈逐年增加的趋势,其中前列腺癌、肺癌、乳腺癌、肝癌均容易发生骨转移。据报道6%~20%肝癌患者发生骨转移[5,6]。骨转移肿瘤引起的疼痛及病理性骨折严重影响患者的生活质量[7,8]。对于无法手术切除骨转移灶的患者,微创手术治疗,如射频消融术成为有效的治疗手段之一。射频消融是一种热凝固疗法,其原理是利用恶性肿瘤细胞对热损伤较为敏感,当温度超过60 ℃会死亡并且组织坏死的特点,实现局部灭除肿瘤细胞,以有效缓解骨痛[9,10]。其主要优势:患者可以免受放疗所导致的免疫抑制及皮肤损害等并发症;在影像引导下进针深度可灵活调整,病灶损毁范围可以精确控制。射频消融术亦有缩小肿瘤体积的作用,可为瘤体过大不能进行手术的患者提供了根治的机会[11-13]。同时,肿瘤缩小后能减轻对传感神经的压迫,减轻疼痛[14]。但对于射频消融术是如何减轻疼痛的机制,目前仍不明确[15]。对于髋臼、脊椎等没有结构支撑的部位发生恶性骨转移病,射频消融术联合骨水泥成形术可以达到更好的疼痛缓解,止痛效果优于单一的局部治疗[16-19]。
本研究结果表明,射频消融术可行性好,创伤小,所有患者均无明显不良反应,耐受性好,疼痛缓解率高。值得注意的是有少部分患者在术后1周内出现疼痛加重现象。本组有11例出现此情况,但无统计学意义。疼痛加重考虑与术后水肿压迫感觉神经有关,随着水肿消退,疼痛可以缓解。本组42例术后1个月疼痛均能得到显著改善,通过对比手术前后患者KPS评分及生活质量EORTC评分发现,术后较术前两组数据均有显著改善(P<0.01),表示射频消融术可以明显提高患者的生活质量。
总之,本研究表明,射频消融术可以有效控制恶性骨转移瘤所导致的疼痛,可以提高患者生活质量,是一种安全有效的治疗方法。
[1] 孙 燕.内科肿瘤学[M].北京:人民卫生出版社,2001:784.
[2] Nielsen O S, Munro A J, Tannock I F. Bone metastases: Pathophysiology and management policy [J]. J Clin Oncol, 1991, 9: 509-524.
[3] 张丽云,陈克敏,王忠敏. 骨肿瘤射频消融治疗研究进展[J]. 介入放射学杂志, 2009,18(5): 395-397.
[4] 万崇华, 陈明清, 张灿珍, 等. 肿瘤症患者生命质量测定量表EORT QLQ-C30中文版评价[J]. 实用肿瘤杂志, 2005, 20(4): 353-355.
[5] The Liver Cancer Study Group of Japan. Primary liver cancer in Japan [J]. Cancer, 1984, 54: 1747-1755.
[6] Nakashima T, Okuda K, Kojiro M,etal. Pathology of hepatocellular carcinoma in Japan [J]. Cancer, 1983,51: 863-877.
[7] Peteet J, Tay V, Cohen G,etal. Pain characteristics and treatment in an outpatient cancer population [J]. Cancer, 1986, 57: 1259-1265.
[8] Bunting R W, Boublik M, Blevins F T,etal. Functional outcome of pathologic fracture sec ondary to malignant disease in a rehabilitation hospital [J]. Cancer, 1992, 69: 98-102.
[9] 林 秾,杨迪生.肿瘤症脊柱转移的微创治疗进展[J]. 实用肿瘤杂志,2011, 26(6):561-562.
[10] 杨绥冲,聂 勇,王 刚,等.胰腺肿瘤术中射频消融治疗效果及安全性分析[J].武警医学,2008,19(6);521-524.
[11] Georgy B A, Wong W. Plasma-mediated radiofrequency ablation assisted percutaneous cement injection for treating advanced malignant vertebral compression fractures [J]. AJNR Am J Neuroradiol, 2007,28(4):700-705.
[12] Georgy B A. Bone cement deposition patterns with plasmamediated radio-frequency ablation and cement augmentation for advanced metastatic spine lesions [J]. AJNR Am J Neuroradio, 2009, 30(6) : 1197-1202.
[13] Sandri A, Carbognin G, Regis D,etal.Combined radiofrequency and kyphoplasty in painful osteolytic metastases to vertebral bodies [J]. Radiol Med, 2010, 115(2):261-271.
[14] 胡仁健,李 昂. 肝门胆管肿瘤介入治疗的疗效比较[J]. 武警医学,2009,20(9):821-823.
[15] Honore P, Luger N M, Sabino M A,etal. Osteoprotegerin blocks bone cancer-induced skeletal destruction, skeletal pain and pain-related neurochemical reorganization of the spinal cord [J]. Nat Med, 2000, 6:521-528.
[16] Schaefer O, Lohrmann C, Markmiller M,etal. Combined treatment of a spinal metastasis with radiofrequency heat ablation and vertebroplasty[J]. AJR, 2003, 180:1075-1077.
[17] Schaefer O, Lohrmann C, Herling M,etal. Combined rasdiofrequency thermal ablation and percutaneous cementoplasty treatment of a pathologic fracture [J]. J Vasc Interv Radiol, 2002, 13: 1047-1050.
[18] Nakatsuka A, Yamakado K, Maeda M,etal. Radiofrequency ablation combined with bone cement injection for the treatment of bone malignancies[J]. AJR, 2003, 180: 1075-1077.
[19] Toyota N, Naito A, Kakizawa H,etal. Radiofrequency ablation therapy combined with cementoplasty for painful bone metastases: initial experience [J]. Cardiovasc Intervent, 2005, 28: 578-583.
(2014-02-10收稿 2014-04-18修回)
(责任编辑 郭 青)
Radiofrequencyablationfortreatmentofbonemetastases:aretrospectivestudy
LI Wei1, CAO Liang2, SHENG Jun1, YAO Jianli1, PENG Xun1, and PENG Yong3. 1.Department of Medical Oncology, Qinhuangdao No.3 Hospital, Qinhuangdao 066000, China; 2. Department of Medical Oncology, Zhengzhou People’s Hospital. Yihe Hospital, Zhengzhou 450000, China; 3. Department of Biomedical Engineering, Yanshan University, Qinhuangdao 066004, China
ObjectiveTo evaluate the clinical therapeutic effects of bone radiofrequency ablation on patients with bone metastases from hepatocellular carcinoma,lung cancer and breast cancer.MethodsTo retrospectively analyze 22 hepatocellular carcinoma patients,12 lung cancer patients and 8 breast cancer patients with bone metastases who
radiofrequency ablation at Qinhuangdao No.3 hospital. The mean diameter of the bone metastases was 3.8 cm (range, 1.0-5.5 cm). The integrality,practicability and safety of this procedure were reviewed. The pain relief and of the bone metastases the quality of life were observed before RFA, as well as 1 week after and 1 month after RFA.NRS(numerical rating scale) was used to determine pain level, KPS(Karnofsky) was used to grade functional status. Patients’ quality of life was scored by using EORTC QLQ-C30 system.Results42 cases (100%) completed RFA successfully. 11(26.2%) cases exhibited worse pain levels within the first week after RFA. However, pains were all relieved significantly after 1 month (P<0.001). KPS increased dramatically from(74.05±11.92)to(88.64±6.28) before the RFA treatment and after 1 month of it(P<0.05). EORTC QLQ-C30 scores were also improved significantly, with (85.50±8.59) scores before RFA, and 60.88±9.5 and 51.38±7.48 within 1 week and 1 month ,respectively. Patients’ quality of life increased remarkably (P<0.05).ConclusionsBone radiofrequency ablation is efficient and safe in the treatment of bone metastases, especially the pain, patients’ life of quality and functional statues that caused by bone metastases were improved dramatically.
radiofrequency ablation; bone metastases; bone pain; quality of life
李 伟,本科学历,主治医师,E-mail:15903395665@163.com
1. 066000,河北省秦皇岛市第三医院肿瘤科;2. 450000,郑州市人民医院颐和医院肿瘤科;3. 066004,秦皇岛燕山大学生物医学工程系
彭 勋,E-mail:pengxun1960@163.com
R730.51

