健康体检者循环单核细胞亚群与性别及年龄的关系
李彭军,韩慧文,葛 兰,孙海英,卢芮伊,周 欣,李玉明
论著
健康体检者循环单核细胞亚群与性别及年龄的关系
李彭军1,韩慧文1,葛 兰2,孙海英2,卢芮伊2,周 欣2,李玉明2
目的观察成年健康人循环单核细胞各亚群细胞的数量和比例,探讨成年国人外周血单核细胞各亚群与性别和年龄的关系。方法连续纳入2012-05在武警后勤学院附属医院健康体检中心进行常规体检的175名成年人,采集外周静脉血后以枸橼酸钠抗凝,进行CD14/CD16/CD86三色流式细胞术分析,探讨单核细胞各亚群数量和比例的年龄和性别分布特点。结果45人因检出糖尿病、高血压病等相关临床疾病或可疑疾病而未纳入统计。130位成年人中,男性与女性健康体检者比较,外周血经典型单核细胞(CD14++CD16-)计数与比例差异无统计学意义(P=0.091,P=0.701),中间型单核细胞(CD14++CD16+,P=0.082,P=0.474)、非经典型单核细胞(CD14+CD16++,P=0.085,P=0.756)差异均无统计学意义。CD14++CD16-型、CD14+CD16++型单核细胞计数与比例统计在不同年龄段人群中差异无统计学意义。CD14++CD16+单核细胞计数随着受试者年龄的增加而增加[青年组单核细胞计数为11(6.5, 13.5),中年组为9.5(7.0, 18.0),老年组为9(7.0, 17.5),P=0.012], 同时CD14++CD16+型单核细胞比例也有增高趋势,差异无统计学意义。结论本研究首次证实国人循环单核细胞亚群存在年龄分布的差异,尤其是CD14++CD16+型单核细胞亚群随年龄增加而增多,对国人单核细胞亚群相关研究具有参考价值。
单核细胞亚群;性别;年龄;健康成年人
单核细胞作为连接固有免疫和获得性免疫的重要细胞类型,是多种炎性反应性疾病的主要参与者,也是组织内巨噬细胞和树突状细胞的重要来源。随着对单核细胞结构和功能研究的深入,研究人员发现,根据单核细胞形态的差异及细胞表面特异性抗原表达的差异可以将单核细胞进一步分群。目前根据人外周血单核细胞上LPS受体-CD14和FcγⅢ受体-CD16的表达情况可以将单核细胞划分为3个亚群[1]:经典型单核细胞(CD14++CD16-)、中间型单核细胞(CD14++CD16+)、非经典型单核细胞(CD14+CD16++)。正是由于单核细胞的这种异质性,才使得单核细胞在不同病理生理状态下表现出不同的功能。大量临床研究提示单核细胞亚群组成结构的变化常常与疾病的发生和进展高度相关。但目前尚缺乏健康国人单核细胞亚群比例和数量的资料,因此本研究旨在观察健康体检者外周血中各单核细胞亚群的数量和比例在性别和年龄上的分布差异,为单核细胞亚群的相关研究提供依据。
1 对象与方法
1.1 对象 连续入选2012-05在武警后勤学院附属医院体检中心体检的表观健康人群175位。在比较单核细胞亚群的年龄差异时,将30岁及以下的受试者编入青年组,30岁以上至49岁的受试者编入中年组,50岁及以上的受试者编入老年组。
1.2 方法
1.2.1 样本采集与处理 采用课题组建立的方法进行单核细胞亚群流式细胞术分析[2]。健康体检受试者采取坐位,上臂自然放置采血台上。使用5 ml一次性无菌注射器采集肘静脉外周全血2 ml,与抗凝剂混匀。各取6 μl抗CD14-FITC、抗CD16-PE和抗CD86-PE-Cy5与12 μl染色缓冲液混合,加入30 μl抗凝全血混合均匀,避光孵育15 min后,加入600 μl红细胞裂解液孵育10 min,加入30 μl荧光微球轻微震荡后立即上机检测。
1.2.2 仪器和试剂 采用Cytomics FC 500流式细胞仪(Beckman Coulter,USA)。抗CD14-FITC、抗CD16-PE和抗CD86-PE-Cy5均购自美国Biolegend公司。白细胞绝对计数使用的Flow-countTM荧光微球购自美国Beckman Coulter公司。
1.2.3 流式细胞术检测白细胞与血小板聚集体 使用FSC/SSC(即前向散射光 forward scatter,FSC和侧向散射光 side scatter,SSC)二维点图(dot plot)显示外周血各型白细胞分布情况,根据粒细胞和淋巴细胞大小以及细胞内颗粒复杂程度分别将两种细胞圈出。以CD86-PE-Cy5-Log为横坐标,SSC-Log为纵坐标,建立CD86-PE-Cy5和SSC散点图。根据图中细胞表达CD86的不同荧光强度和细胞内颗粒复杂程度将外周血单核细胞划出。再根据单核细胞上LPS受体-CD14和FcγⅢ受体-CD16的表达将单核细胞分为3个亚群:CD14++CD16-、CD14++CD16+、CD14+CD16++(图1)。利用荧光微球对各亚群细胞数量进行绝对计数。
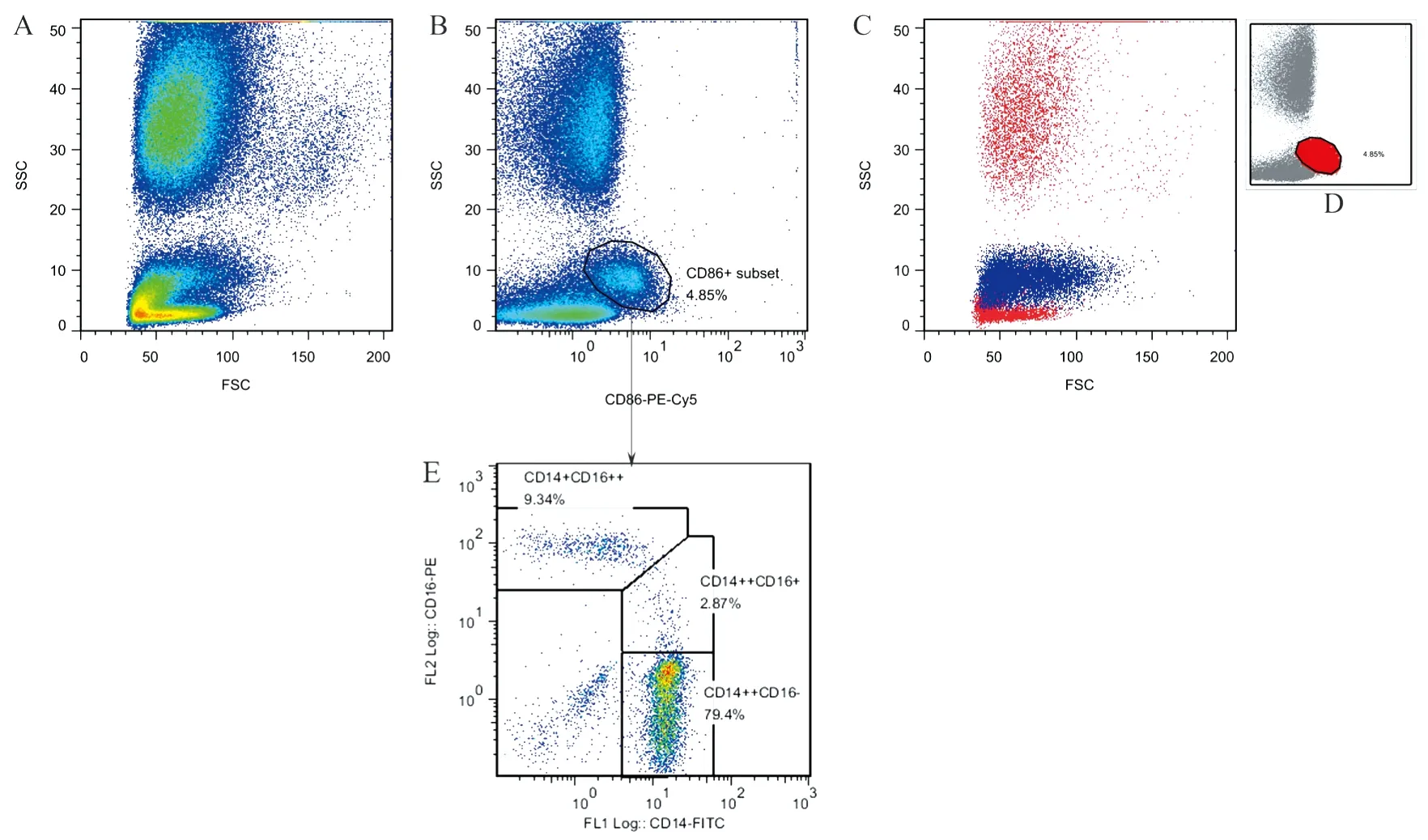
图1 流式细胞仪散点图阐述单核细胞及单核细胞亚群的设门策略

2 结 果
2.1 一般特征 45位受试者因检出糖尿病、高血压病等临床疾病/可疑疾病而被排除。剩余130位健康受试者平均年龄42.42岁,其中男75位,女55位。男女受试者心率、体重指数(body mass index, BMI)、白细胞(white blood cell, WBC)、单核细胞(monocyte, MON)、血糖(glucose, Glu)和三酰甘油(triglyceride, TG)差异均无统计学意义(表1)。
2.2 性别差异 健康受试者男性与女性相比,外周血单核细胞各亚群,包括经典型、中间型和非经典型,其细胞计数和百分比差异均无统计学意义(P<0.05,表2)。
2.3 单核细胞各亚群计数和比例与年龄的关系 不同年龄组之间比较,各亚群细胞百分比差异均无统计学意义。中老年组与青年组比较,CD14++
CD16+亚群细胞计数差异有统计学意义(P=0.012),而CD14++CD16-、CD14+CD16++亚群细胞计数在3个年龄组之间差异无统计学意义(表3)。
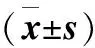
表1 130位健康受试者基本资料
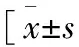
表2 健康受试者男性、女性外周血单核细胞各亚群计数和百分比情况 ;中位数(四分位数间距)]
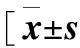
表3 健康受试者不同年龄组外周血单核细胞各亚群计数和百分比情况 ;中位数(四分位数间距)]
3 讨 论
本研究证实,随着年龄的增长单核细胞亚群的构成将发生动态性变化,其中,CD14++CD16-与CD14+CD16++单核细胞亚群的变化并不明显, 但CD14++CD16+单核细胞亚群数量及比例随着年龄的增加而升高。同时,本结果也显示单核细胞各亚群数量及比例在健康男性和女性中无统计学差异。
目前,学术界广泛认同的单核细胞亚群的分群方法是根据单核细胞表面LPS受体CD14和Fcγ-Ⅲ受体CD16的表达情况来划分的[1]。不同亚群的单核细胞,其生理特性有很大差异。CD14++CD16-单核细胞产生广泛细胞因子如:粒细胞集落刺激因子,白细胞介素10,趋化因子配体2,白介素6等,并可调节T细胞的生成,从而具有组织修复和免疫调节功能; CD14++CD16+单核细胞可以产生大量的ROS和炎性因子,具有抗原呈递能力,此外该群细胞因表达Tie-2和血管内皮生长因子而产生促血管生成的作用;CD14+CD16++单核细胞高表达促炎因子,如肿瘤坏死因子α和白细胞介素1β,这些因子使该亚群细胞具有促炎作用[3,4]。单核细胞亚群参与动脉粥样硬化的发展过程[5,6],ST段抬高心肌梗死和心力衰竭患者,CD14++CD16+单核细胞亚群明显升高,尤其是合并肾脏疾病的患者[7-9]。Seidler等[10]研究表明,CD14+CD16+单核细胞亚群数量以及该群细胞对循环单核细胞池的作用随着年龄的增加而升高。本实验结果中CD14++CD16+单核细胞亚群数量及比例与年龄均呈正相关,而CD14+CD16++单核细胞亚群数量随着年龄的增长而降低,可能由于Seidler研究把单核细胞划分为两群即CD14++CD16-和CD14+CD16+单核细胞亚群,本研究根据CD16的表达水平把CD16阳性单核细胞进一步划分为CD14++CD16+和CD14+CD16++单核细胞亚群,结果显示随着年龄的增加单核细胞数量主要为CD16弱表达的CD14++CD16+单核细胞亚群。
早期研究发现,单核细胞亚群在男性与女性人群中无明显差异[10]。最新动物实验再次证实,外周血单核细胞变化与性别无显著相关[11]。本研究结果显示,单核细胞总数及各亚群的细胞数量及比例在健康男性与女性人群中均无明显差异,与早期研究报道相一致。但Heimbeck等[12]研究报道CD14+CD16++单核细胞亚群在健康女性人群中所占比例较男性低,本实验中虽然单核细胞总数及各亚群细胞数量无性别差异,但存在一些具有临界统计学意义的分布特点,如女性单核细胞总数及各亚群细胞数量均低于男性,因此,健康人群中单核细胞各亚群与性别的关系需在更大样本中得到证实。
随着对单核细胞亚群功能研究的深入,单核细胞亚群可能对临床实践中判断病情进展及预测预后具有潜在应用价值。因此,本研究揭示的国人成年健康体检者外周血中各单核细胞亚群的细胞数量和比例的年龄和性别分布特点,对我国健康人群单核细胞亚群的比例和数量正常参考值范围确定和后续人群有关研究具有借鉴价值。
[1] Ziegler-Heitbrock L, Ancuta P, Crowe S,etal. Nomenclature of monocytes and dendritic cells in blood[J]. Blood, 2010, 116 (16): e74-80.
[2] 杨国红,卢芮伊,孙海英,等. 四色流式分析冠心病患者外周血单核细胞亚群及单核细胞-血小板聚集体的变化[J]. 临床心血管病杂志, 2013, 29 (1): 29-33.
[3] Wong K L, Tai J J, Wong W C,etal. Gene expression profiling reveals the defining features of the classical, intermediate, and nonclassical human monocyte subsets[J]. Blood, 2011, 118 (5): e16-31.
[4] Ingersoll M A, Spanbroek R, Lottaz C,etal. Comparison of gene expression profiles between human and mouse monocyte subsets[J]. Blood, 2010, 115 (3): e10-19.
[5] Cros J, Cagnard N, Woollard K,etal. Human CD14 dim monocytes patrol and sense nucleic acids and viruses via TLR7 and TLR8 receptors[J]. Immunity, 2010, 33 (3): 375-386.
[6] Combadiere C, Potteaux S, Rodero M,etal. Combined inhibition of CCL2, CX3CR1, and CCR5 abrogates Ly6C(hi) and Ly6C(lo) monocytosis and almost abolishes atherosclerosis in hypercholesterolemic mice[J]. Circulation, 2008, 117 (13): 1649-1657.
[7] Tapp L D, Shantsila E, Wrigley B J,etal. The CD14++CD16+monocyte subset and monocyte-platelet interactions in patients with ST-elevation myocardial infarction[J]. JTH, 2012, 10 (7): 1231-1241.
[8] Barisione C, Garibaldi S, Ghigliotti G,etal. CD14CD16 monocyte subset levels in heart failure patients[J]. Dis Markers, 2010, 28 (2): 115-124.
[9] Heine G H, Ortiz A, Massy Z A,etal. Monocyte subpopulations and cardiovascular risk in chronic kidney disease[J]. Nat Rev Nephrol, 2012, 8 (6): 362-369.
[10] Seidler S, Zimmermann H W, Bartneck M,etal. Age-dependent alterations of monocyte subsets and monocyte-related chemokine pathways in healthy adults[J]. BMC immunology, 2010, 11:30.
[11] Uluisik D, Keskin E, Ozaydin T. Age and gender related changes in hematological parameters of thoroughbred foals[J]. Biotech Histochem, 2013,88(6):345-349.
[12] Heimbeck I, Hofer T P, Eder C,etal. Standardized single-platform assay for human monocyte subpopulations: Lower CD14+CD16++monocytes in females[J]. Cytometry A, 2010, 77 (9): 823-830.
(2013-05-13收稿 2013-07-20修回)
(责任编辑 郭 青)
AgeandgenderdistributionofcirculatingmonocytesubsetsinhealthyChineseadults
LI Pengjun1, HAN Huiwen1, GE Lan2, SUN Haiying2, LU Ruiyi2, ZHOU Xin2, and LI Yuming2.
1. Medical Examination Center, 2. Institute of Cardiovascular Disease and Heart Center, Affiliated Hospital, Logistics University of the Chinese People’s Armed Police Forces, Tianjin 300162,China
ObjectiveTo determine the age and gender distribution of circulating monocyte subsets in Chinese healthy adults.MethodsConsecutively enrolled 175 adults who underwent routine medical examination in this hospital in May 2012. Sodium citrate anticoagulated blood was collected from all subjects to examine monocyte subsets by flow cytometry.Results45 patients were ruled out because of potential health issues. The counts and percentages of classic CD14++CD16-monocytes (P=0.091 andP=0.701, respectively), intermediate CD14++CD16+monocytes (P=0.082 andP=0.474, respectively), non-classic CD14+CD16++monocytes (P=0.085 andP=0.756, respectively) had no significant differences between men and women. There was no obvious age-dependent changes in the counts and percentages of classic and non-classic monocytes. The counts of intermediate monocytes increased with age [The counts of cells in the youth groups were 11 (6.5, 13.5); in the middle-aged group was 9.5 (7.0,18.0); in the elderly-aged group was 9(7.0,17.5),P=0.012] and the percentages of intermediate monocytes had borderline statistical difference among different age tertiles.ConclusionsThis study demonstrates the age and gender distributions of monocyte subset in healthy Chinese adults, which may provide a basis for future human monocyte targeted researches.
monocyte subsets; age; gender; healthy adults
国家自然科学基金(81070121),天津市自然科学基金(09ZCZDSF04200 11JCYBJC12000)
李彭军,本科学历,主治医师,E-mail: pjli.cardiolab@gmail.com
300162天津,武警后勤学院附属医院:1.健康体检中心,2.心脏中心
李玉明,E-mail:cardiolab@gmail.com
R541.4

