育肥猪血清中猪细小病毒16WS 株的分离与鉴定
吴海超,胡呈才,刘崇灵,李润成,余兴龙
(湖南农业大学动物医学院,湖南 长沙 410128)
猪细小病毒为细小病毒科细小病毒属成员,是一种自主型复制病毒,主要经消化道和呼吸道传播,广泛存在于猪场。猪细小病毒能够引起怀孕母猪流产、产死胎、木乃伊胎、返情等,其中初产母猪症状最明显[2];还能够引起哺乳仔猪非化脓性心肌炎[3]、仔猪皮炎[4–5]、肥育猪间质性肾炎[6]等疾病,并能与猪圆环病毒(porcine circovirus, PCV)、猪伪狂犬病(porcine pseudorabies, PRV)、猪细环病毒(Torque torque sus virus, TTSuV)[7]等多种病毒共同感染,其中与猪圆环病毒感染能够加重仔猪多系统衰竭综合征(postweaning mμltisystemic wasting syndrome,PMWS)[8]。
1966年,Mayr[9]首次于猪瘟组织中分离到PPV病毒,Cartwright[10]等从猪流产胎儿中分离到该病毒并首次证明其致病作用。1982年,中国药监所分离到该病毒,此后在上海、黑龙江、吉林、四川、浙江等地分离到该病毒[11–12]。湖南农业大学动物微生物与免疫实验室从湖南一肥育早、中期生产成绩持续较差的猪场采集了不同周龄段的小猪血清214 份,进行了猪细小病毒检测,并从1 份血清样品中分离到1 株猪细小病毒,对其进行了部分生物学特性研究以及部分基因序列的测序分析,具体报道如下。
1 材料与方法
1.1 材 料
1.1.1 病料及细胞
从湖南某猪场收集的214 份血清,其中2 周龄仔猪血清11 份;4 周龄血清10 份;6、8、9、12周龄血清各15 份;10 周龄血清17 份;14 周龄血清25 份;15 周龄血清10 份;16 周龄血清25 份;17 周龄血清10 份;18 周龄血清13 份;20 周龄血清12 份;22 周龄血清11 份;24 周龄血清10 份。猪睾丸细胞系(ST)由湖南农业大学动物微生物与免疫实验室保存。
1.1.2 主要试剂
DNAOUT提取试剂盒、PCR MIX 3.0 为北京天恩泽基因科技有限公司产品;DMEM(highglucose)培养基、0.25 % Trypsin–EDTA 均为HyClone 公司产品;新生犊牛血清为Gibco 公司产品;配制双抗用青霉素钠(80万单位)为哈药集团制药总厂产品;配制双抗用硫酸链霉素(100万单位)为瑞阳制药有限公司产品;DM2000 Plus DNA marker 为康为世纪生物科技有限公司产品。
1.2 方 法
1.2.1 病原检测
从GenBank 下载多条具有代表性的猪细小病毒全基因序列,用DNAStar 软件对全基因序列进行同源性分析,在其保守区域设计检测引物,上游引物用PPVfp1,序列为5'–AGCGAGCCAACAACAC CAACTTT–3';下游引物用PPVrp1,序列为5'–TCT CGGCGATCTTCTTACCTCTG–3',退 火 温 度 为63℃。用DNAOUT提取试剂盒提取血清中病毒基因组,以提取的DNA 为模板,进行PCR 扩增,20 μL扩增体系如下:PCR MIX 9 μL,10 pmol/L PPVfp1和PPVrp1 各0.5 μL,DNA 模板1 μL,加水补至20 μL,同时设置无模板的阴性对照。反应条件:95℃预变性 5min;95℃变性 5min,63℃退火 30 s,72℃延伸 30 s,30个循环;最后72℃延伸10min,用0.8 %的琼脂糖对PCR 产物进行电泳检测。
1.2.2 病毒分离
将其中1 份PPV 阳性血清用不含犊牛血清DMEM 培养基进行稀释,稀释总体积为1mL,稀释梯度依次为1∶20、1∶30、1∶40、1∶50、1∶60。稀释前在DMEM 培养基中加入1万单位的青霉素钠和1万单位的硫酸链霉素,将稀释好的样品于4℃放置24 h,使青霉素和链霉素充分发挥作用。将生长良好的ST 细胞传代至细胞培养板中,待生长密度为50%时,弃培养板中的培养基,用0.1 mol/L PBS 洗涤2 遍后,将稀释好的1mL 血清样品加入至培养板中,设未加血清样品的ST 细胞为阴性对照,置37℃、含5% CO2恒温箱中孵育1 h 后,每孔加入20 μL 犊牛血清,使每孔培养液犊牛血清终浓度为2%,置于37℃、5% CO2恒温箱中培养。对以上细胞冻融传3 代,取第3 代细胞上清液提取DNA,并进行PCR 检测,如能检测到PPV 则继续进行传代并观察细胞病变情况。
1.2.3 病毒血凝效价的测定
取病变稳定后病毒液置于20℃反复冻融3次,3 000 r/min,离心4min,取50 μL,参照吴宇阳[13]介绍的方法,加入96 孔“V”型反应板(孔中预先加入50 μL0.1 mol/L PBS),加50 μL 0.5%豚鼠红细胞悬液至每孔,在微量振荡器上摇匀10 s,室温 (25℃)下放置2 h,以出现50 %红细胞凝集的最大病毒稀释倍数视为该病毒的血凝效价。
1.2.4 PPV 分离株部分基因序列的测定及同源性分析
从GenBank 上下载多条猪细小病毒全基因序列,利用DNAStar 软件对部分基因序列进行同源性分析,在其保守区域分段设计引物,引物信息见表1。
采用曹果清[14]介绍的饱和苯酚–氯仿抽提法对第5 代病毒液提取DNA,分别用表1 中引物对其进行PCR 扩增,50 μL PCR 扩增体系如下:PCR MIX和超纯水各 23.5 μL,上下游引物各加1 μL,DNA模板1 μL。PCR 反应条件:95℃预变性 5min 95℃变性 5min,55 /59℃ ℃退火 30 s,72℃延伸 30 s,30个循环;最后72℃延伸10min。用0.8 %琼脂糖对PCR 产物进行电泳检测。将鉴定为阳性的PCR产物送往博尚生物有限公司进行测序,将测序结果拼接后,与GenBank 中已知序列进行比对分析,选择的序列信息见表2。

表2 毒株信息 Table 2 Information of isolates
2 结 果
2.1 病原检测结果
收集了湖南某猪场214 份血清,对各周龄猪血清进行PCR 病原检测,其中2~14 周龄、24 周龄的猪血清中未检测到PPV,15、16、17、18、22周龄的PPV 阳性检出率分别为10%、40%、20%、15.4 %、9%。
2.2 病毒分离结果
2.2.1 细胞病变观察
将处理好的血清接种于生长状态良好的ST 细胞,冻融传到第5 代,接毒细胞出现圆缩、脱落、拉网等细胞病变,而未接毒细胞形态正常,没有出现细胞病变(图1)。
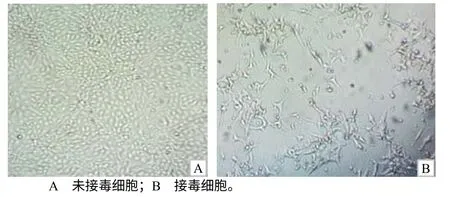
图1 分离株感染ST 细胞产生细胞病变 Fig1 Cytopathogenic effect induced by isolate in ST cell
2.2.2 分离病毒的PCR 鉴定
用特异性的检测引物对本实验PPV 分离株第5代细胞病毒液稀释度为10–1、10–2、10–3的样品进行PCR 检测,结果(图2)表明,扩增条带与目的条带相符,确定分离到的病毒为PPV,并将分离病毒命名为16WS。
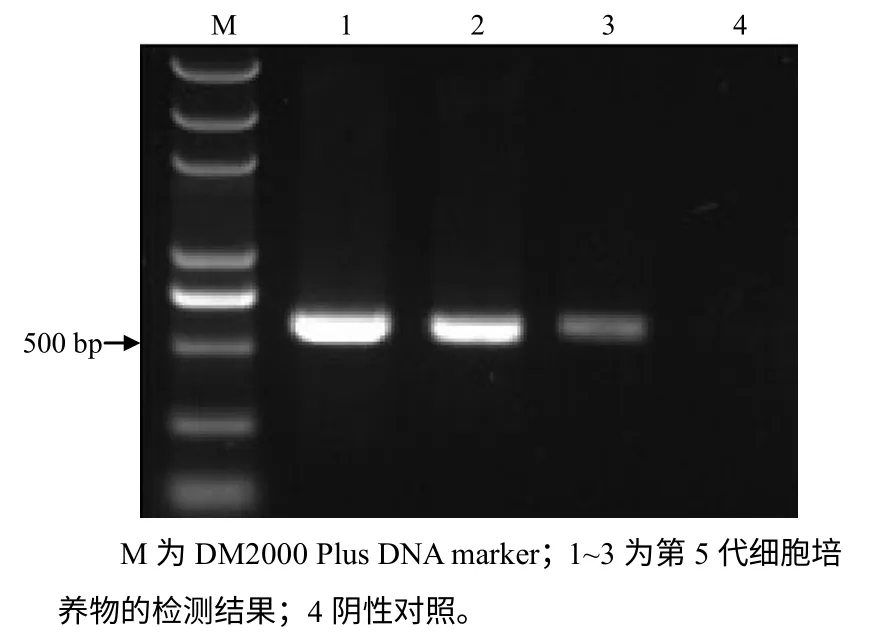
图2 接毒细胞的PCR 检测结果 Fig 2 Cells inoculated with ppv detected by PCR
2.3 分离病毒对豚鼠红细胞的血凝效价测定
取PPV阳性血清冻融传代至第5 代的出现稳定病变的细胞样品(经PCR 检测为细小病毒阳性),进行病毒凝集豚鼠红细胞的特性的检测,结果测出分离病毒血凝效价为28。
2.4 分离病毒的基因组序列的扩增
用猪细小病毒基因组扩增引物对第5 代细胞病毒液基因组进行PCR 扩增,PCR 产物经0.8%琼脂糖凝胶电泳鉴定,结果见图3。由图3 可见,各引物均扩增出了与预期片段大小相符的特异性条带。
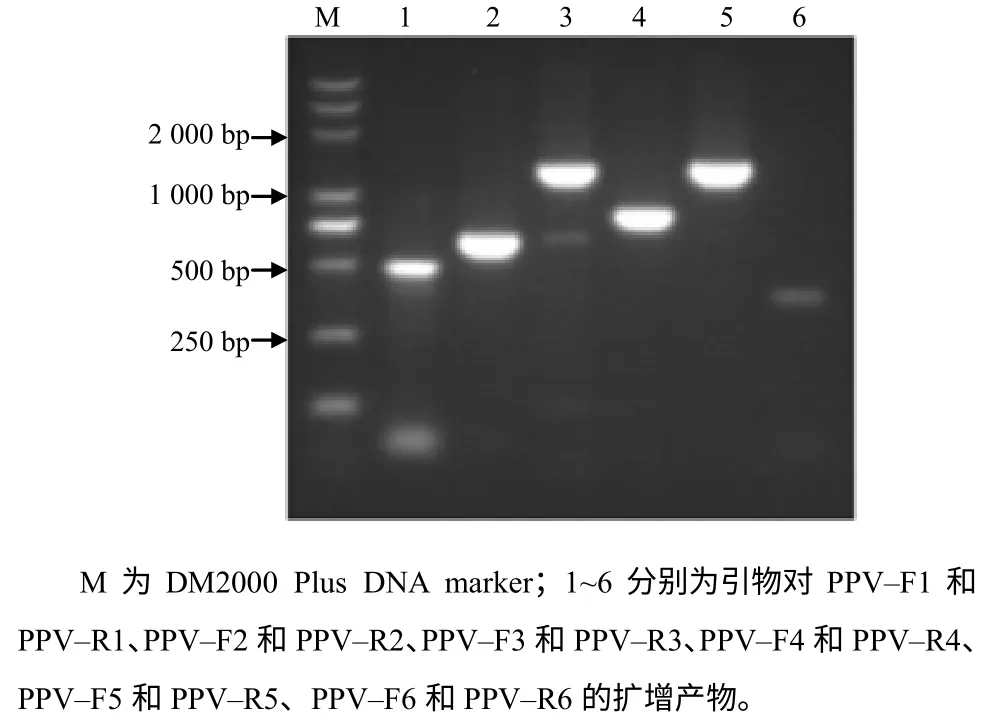
图3 测序引物PCR 结果 Fig 3 Amplification of PPV by sequencing primers
2.5 分离病毒的基因组测序分析
将PCR 产物送往博尚生物有限公司进行序列测定。对序列进行拼接,序列长4 320 bp,利用DNAStar 序列分析软件与GenBank 中10 株(毒株信息见表2)PPV 毒株进行同源性分析,结果表明分离的PPV 的基因序列与其他研究较多的猪细小病毒基因序列同源性在98 %以上,其中,与时乐[1]分离的YL 毒株同源性最高,同源性高达99.1%。
3 讨 论
本实验从一育肥猪早、中期生产水平较差的猪场收集了214 份血清,采用猪细小病毒特异性检测引物进行病毒检测,并在检测完毕后,选取1 份阳性血清接种ST 细胞进行病毒分离,通过PCR 检测、血凝实验、细胞病变观察、全基因序列测定及同源性分析等成功分离到1 株猪细小病毒。大部分的PPV 毒株都是从流产胎儿的肝脏、肾脏、肠系膜淋巴结、肺脏等实质性器官分离,很少有人从育肥猪血清中进行分离。本实验从育肥猪血清分离到1 株猪细小病毒,说明猪产生病毒血症后,可以尝试从血清中分离病毒,为采样及分离病毒提供一种较为简便的方法。
猪细小病毒一般在感染后的1~6 d 内产生病毒血症[15],通过从血清中分离本病毒还可以确定该病毒是否在感染初期还是感染后期。对湖南某规模化猪场的214 份猪血清进行猪细小病毒病原检测,结果发现15、16、17、18、22 周龄均检测到该病毒,检测阳性率依次为10%、40%、20%、15.4%、9%,2~14 周龄及24 周龄未检测到本病毒。针对于目前健康水平较差的猪场,猪蓝耳病毒、猪伪狂犬病毒、猪细小病毒在患有呼吸道疾病及繁殖障碍性疾病的猪群中感染非常普遍,特别是猪感染猪蓝耳病毒、猪伪狂犬病毒后,免疫功能被抑制,抵抗力降低,导致其他病毒乘虚而入。由于育肥猪猪细小病毒母源抗体的消失,又没有免疫猪细小病毒疫苗,而猪场中往往又有该病毒的存在[16],导致育肥猪前、中期容易引起猪细小病毒的感染。由于本实验只针对于一个育肥阶段生产较差的猪场进行了检测,其他生产水平较差的猪场是否也存在这种情况还需进一步研究。
将PPV 分离株与GenBank 登录的10 株PPV 毒株进行同源性分析,发现PPV 分离株与其他PPV 毒株的同源性均在98%以上,其中与2012年西北农林科技大学时乐[1]分离的YL 株同源性达到99.1%,且该分离株与德国强毒株27a、BQ 株、YL 株亲缘关系较近,其他的生物学特征还需进一步研究。
[1] 时乐,黄勇,许信刚,等.猪细小病毒YL 株序列分析及其VP2 基因原核表达[J].西北农业学报,2012,21(6):6–12.
[2] 韦平,秦爱建.重要动物病毒分子生物学[M].北京:科学出版社,2008.
[3] Bolt D M,Hani H,Muller E,et al.Non-suppurative myocarditis in piglets associated with porcine parvovirus infection[J].J Comp Pathol,1997,117(2):107–118.
[4] 张超范,崔尚金,戚亭,等.猪细小病毒细胞适应株的培育及鉴定[J].中国预防兽医学报,2008,30(5):362–366.
[5] Choi C S,Molitor T W,Joo H S,et al.Pathogenicity of a skin isolate of porcine parvovirus in swine fetuses[J]. Vet Microbiol,1987,15(1/2):19–29.
[6] Drolet R,D'Allaire S,Larochelle R,et al.Infectious agents identified in pigs with multifocal interstitial nephritis at slaughter[J].The Veterinary Record,2002,150(5):139–143.
[7] Nieto D,Aramouni M,Grau-Roma L,et al.Dynamics of Torque teno sus virus 1 (TTSuV1) and 2 (TTSuV2) DNA loads in serum of healthy and postweaning multisystemic wasting syndrome (PMWS) affected pigs[J].Veterinary Microbiology,2011,152(3/4):284–290.
[8] Choi C,Chae C.Distribution of porcine parvovirus in porcine circovirus 2–infected pigs with postweaning multisystemic wasting syndrome as shown by in-situ hybridization[J].Journal of Comparative Pathology,2000,123(4):302–305.
[9] Mayr A,Bachmann P A,Siegl G,et al.Characterization of a small porcine DNA virus[J].Archiv frdiegesamte Virusforschung,1968,25(1):38–51.
[10] 斯特劳.猪病学[M].北京:中国农业出版社,2000.
[11] 李英霞,李长宏,朱琪,等.黑龙江省猪细小病毒感染的流行病学调查[J].中国兽医杂志,2001,37(1):22.
[12] 杨待建,金升藻,荣俊,等.湖北省猪细小病毒病流行的调查[J].中国预防兽医学报,1999,21(5):67–70.
[13] 吴宇阳,陈龙彪,崔保安,等.猪细小病毒河南地方株HP104 的分离与生物学特性鉴定[J].中国兽医学报,2013,33(10):1498–1503.
[14] 曹果清,莫清珊,陈凤仙.酚/氯仿抽提法提取绵羊凝血块中基因组 DNA[J].安徽农业科学,2009,37(34):16771–16772.
[15] 陈溥言.兽医传染病学[M].北京:中国农业出版社,2006.
[16] 王娟萍,姚敬明,丁馥香,等.猪蓝耳病,猪细小病毒病和猪伪狂犬病混合感染的多重 PCR 诊断与防制[J].养猪,2008(5):70–72.

