1 株广谱拮抗菌的分离鉴定及其抗菌活性成分分析
郭照辉,黄军, 魏小武,罗 容珺 , 伍善东,刘清术,3*
(1.湖南省微生物研究院,湖南 长沙410009;2.湖南省农用微生物应用工程技术研究中心,湖南 长沙410009; 3.湖南农业大学植物保护学院,湖南 长沙410128)
选用抗病品种和采用轮作的种植制度,并不能有效抑制某些土传病害的为害;施用化学农药的效果虽好,但对环境和食品安全会造成巨大威胁[1–3]。有研究表明,利用植物根际有益微生物能有效降低植物病原菌的危害,且对环境友好,具有很好的应用前景[4–6]。
笔者从烟–稻–(油)轮作10年以上的耕地土壤中筛选得到了1 株拮抗菌HMI–23,该菌株对水稻纹枯菌、烟草青枯菌、油菜核盘菌都具有显著的抑菌效果。对该菌株抗菌物质的稳定性进行了测试,并对主要抑菌成分进行了检测和分析,初步确定了该菌株产生的抗菌活性物质的种类。现将结果报道如下。
1 材料与方法
1.1 材 料
2010年5月中旬,从湖南浏阳沙市、郴州宜章烟草–水稻轮作10年以上的田间,采集烟草根际土样20 余份。
水稻纹枯病病原菌(立枯丝核菌(Rhizoctonia solani))、油菜菌核病病原菌(核盘菌(Sclerotinia sclerotiorum))由湖南农业大学植物保护学院陈武博士提供;烟草青枯病病原菌(雷尔氏菌(Ralstonia solanacearum ))由福建省农业科学院刘波研究员提供。
常规细菌培养基采用LB 培养基,病原真菌培养基采用PDA 培养基,青枯雷尔氏菌采用TTC 培养基,液体发酵培养基采用Landy 培养基[7]。除PDA培养基外,其余培养基pH 均为7.0~7.2。
1.2 方 法
1.2.1 拮抗菌的分离与筛选
拮抗菌的分离参照文献[10]方法进行。
病原真菌拮抗试验采用对峙培养法[8],青枯病拮抗试验,采用双层平板法[11]。
1.2.2 拮抗菌发酵液抑菌活性测定
拮抗菌菌株接种于Landy培养基,培养48 h后,高速离心,上清液经0.22 μm滤膜过滤除菌,发酵滤液采用杯碟法进行抑菌活性测定[9]。
1.2.3 拮抗菌发酵液抑菌活性的稳定性测定
1) 热稳定性试验。拮抗菌发酵滤液分别用20、40、60、80℃水浴处理1 h,100、120℃高温蒸气处理30min,再用杯碟法进行抑菌活性测定,与未经处理的发酵滤液的抑菌活性进行比较。
2) 蛋白酶K 稳定性试验。发酵滤液加入终质量浓度1μg/mL 的蛋白酶K,室温(25℃)处理1 h,再用杯碟法进行抑菌活性测定,与未经处理的发酵滤液的抑菌活性进行比较。
3) 紫外线照射稳定性试验。遮光布遮挡自然光,发酵滤液紫外灯照射10、20、30、40、50、60min,再用杯碟法进行抑菌活性测定,与未经处理的发酵滤液的抑菌活性进行比较。
1.2.4 拮抗菌 16S rDNA 序列测定
以拮抗菌的基因组DNA 为模板,用细菌16S rDNA 通用引物27F 和1492R 对拮抗菌菌株的16S rDNA 进行PCR 扩增,产物送至上海生工测序。利用NCBI 数据库的BLASTn 程序对序列进行同源性检索,与GenBank 数据进行比对分析,再利用软件Mega 5 进行多序列同源性分析,构建系统进化树。
1.2.5 拮抗菌脂肽类抗生素合成相关基因的检测
以拮抗菌基因组为模板,根据其他芽孢杆菌已鉴定的mycosubtilinB[10]、fengycinB[11]、iturinA[12]脂肽合成基因簇中的保守区域及脂肽合成必须的关键酶编码基因sfp[13](磷酸泛酰巯基乙胺基转移酶基因),设计4 对PCR 引物探针,序列为:mycBF,
–ATGTCGGTGTTTAAAAATCAAGTAACG–,myc BR,–TTAGGACGCCAGCAGTTCTTCTATTGA–;fenBF,–CTATAGTTTGTTGACGGCTC–,fenBR,–CAGCACTGGTTCTTGTCGCA–;ituAF,–ATGTA TACCAGTCAATTCC–,ituAR,–GATCCGAAGCTG ACAATAG–;sfpF,–ATGAAGATTTACGGAATTTA–,sfpR,–TTATAAAAGCTCTTCGTACG–)。PCR 检测拮抗菌基因组中是否存在mycB、fenB、ituA、sfp脂肽合成基因,并将PCR 产物送至上海生工测序,利用NCBI 数据库的BLASTn 程序对序列进行同源性检索,与GenBank 数据进行比对分析。
1.2.6 拮抗菌脂肽类物质的提取与抑菌活性测定
脂肽类物质提取按照文献[14]方法进行,粗提液经0.22 μm 滤膜过滤,采用杯碟法测定稀释10倍后的脂肽粗提液对水稻立枯丝核菌、油菜核盘菌和青枯雷尔氏菌的抑菌活性。
1.2.7 拮抗菌脂肽粗提取物成分分析
取脂肽过滤液进行HPLC–ESI/MS 检测,色谱条件参照文献[14]。
2 结果与分析
2.1 拮抗菌的分离和筛选结果
从20 多份土壤样品中分离、筛选拮抗菌的结果来看,1 株筛选自浏阳沙市镇烟草根际土壤的菌株HMI–23,对水稻立枯丝核菌、油菜核盘菌和青枯雷尔氏菌均具有强拮抗作用(图1),抑菌圈直径分别为16.5、32.8、22.3 mm。对稻曲病病原菌、辣椒疫病病原菌、西瓜枯萎病病原菌等的抑菌圈直径都在20 mm 以上(数据未列出),显示出较广的抑菌谱。HMI–23 在LB 平板培养基上,菌落呈淡黄色,显微镜下菌体为杆状,可形成芽孢。
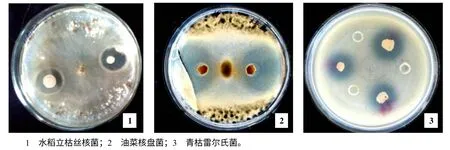
图1 拮抗菌HMI–23 对病原菌的抑菌活性 Fig.1 The inhibition activity of antagonistic bacteria strain HMI-23 to plant pathogens
2.2 拮抗菌HMI–23 发酵液的抑菌效果
HMI–23 菌发酵液对水稻立枯丝核菌、油菜核盘菌和青枯雷尔氏菌的抑制作用较强,其抑菌圈平均直径分别达19.6、27.0、30.2 mm,表明HMI–23菌株发酵滤液中含有抑制真菌和细菌的活性成分。
2.3 拮抗菌HMI–23 发酵液抑菌成分的稳定性
2.3.1 温度对发酵液抗真菌活性的影响
以油菜核盘菌为测试靶标,测试不同温度热处理后,HMI–23 发酵滤液抗真菌活性的变化情况。结果(表1)显示,20~80℃处理时,发酵滤液的抗真菌活性基本保持不变,100~120℃处理后,活性有所下降,但仍能保留60%以上的抗真菌活性,表明抗真菌活性物质具有较高的热稳定性。
2.3.2 蛋白酶K 和紫外线处理对发酵液抗真菌活性的影响
蛋白酶K 处理后的发酵滤液所产生的抑菌圈直径与对照基本相等(表1),表明HMI–23 菌株发酵液中的抗真菌活性物质不能被蛋白酶K 水解而失活,可能不是蛋白类物质。紫外线处理后的发酵滤液所产生的抑菌圈直径也与对照基本相等(表1),表明紫外线照射对抗菌物质基本没有影响。
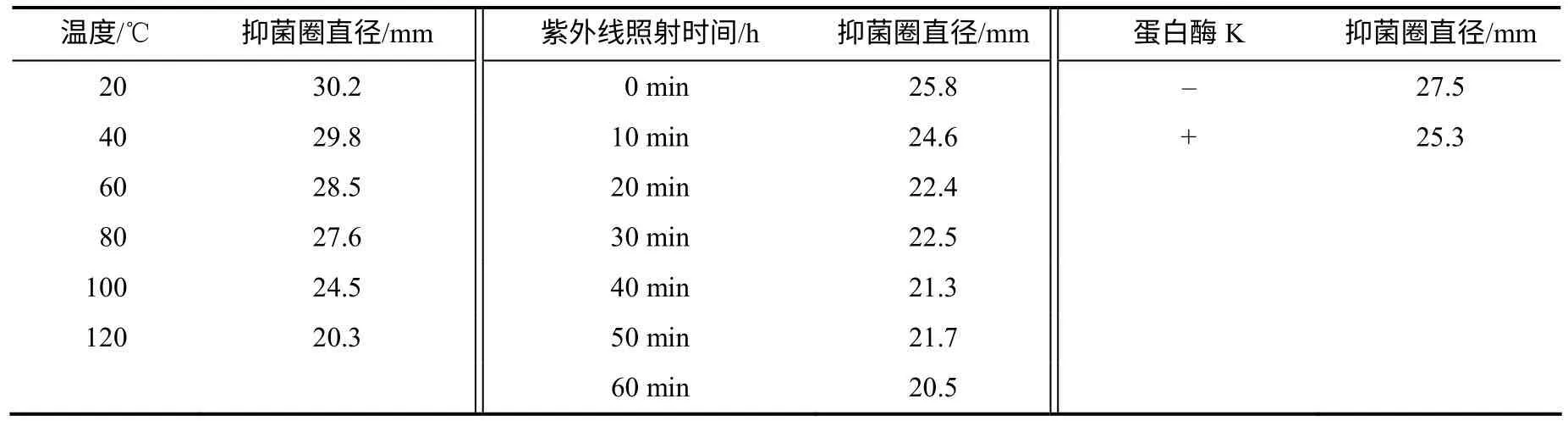
表1 拮抗菌HMI–23 发酵滤液抗真菌活性的稳定性 Table 1 The stabilization of antifungal activity of strain HMI-23 fermentation broth supernatant
2.4 拮抗菌HMI–23 的16S rDNA 序列分析
以 HMI–23 菌株基因组为目标,以引物27F/1492R 成功扩增到了1.5 kb 左右的条带,测序后序列已经登录到GenBank(ID:JX964996.1)。以此序列及同源序列构建系统发育树(图2),显示HMI–23 与解淀粉芽孢杆菌FZB42 亲缘关系最近。
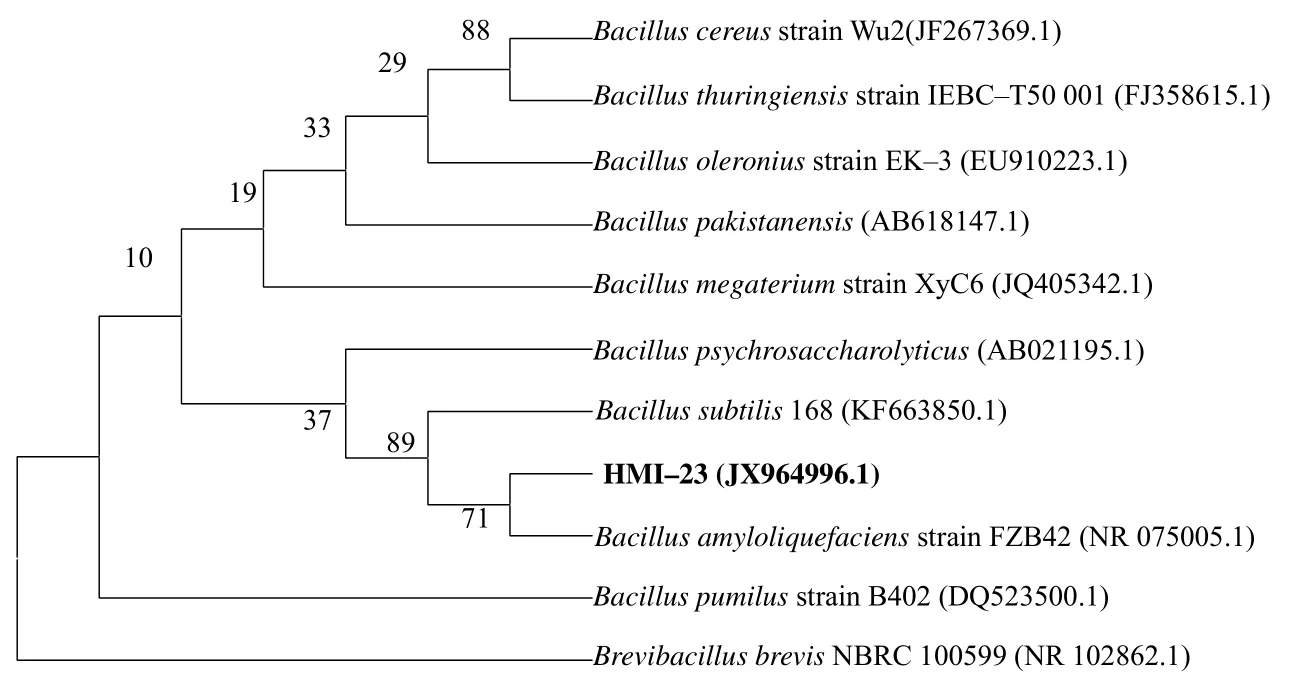
图2 拮抗菌HMI–23 的16S rDNA 系统进化树 Fig. 2 16S rRNA based phylogeny tree of antagonistic bacteria HMI–23
2.5 拮抗菌HMI–23 脂肽合成相关基因的PCR 扩增结果
以基因组为模板,利用4 对特异引物进行PCR 扩增,获得4 条目标片段(图3),其相对分子质量与已知的脂肽抗生素合成基因相符合,即抗霉枯草菌素B(mycosubtilin B)合成基因mycB、丰原素B(fengycin B)合成基因fenB、伊枯草菌素A (iturin A)合成基因ituA 和脂肽抗生素合成关键基因sfp,大小分别为2.0、1.4、1.1 和0.6 kb。序列跟解淀粉芽孢杆菌FZB42 基因组[15]中同源基因的同源性分别为98%、98%、95%、96%,说明 菌株HMI–23 基因组中可能含有相应抗菌脂肽类的完整的生物合成基因簇,也进一步证明了其与解淀粉芽孢杆菌FZB42 具有很近的亲缘关系。
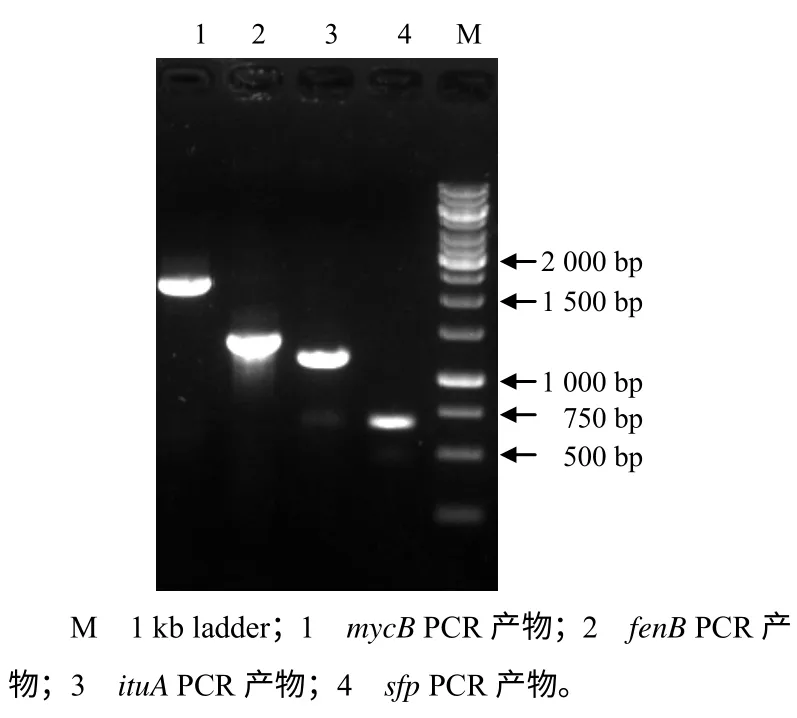
图3 脂肽合成基因的PCR 扩增结果 Fig.3 PCR results forgenes coding for lipopeptides
2.6 拮抗菌HMI–23 脂肽粗提物的抑菌作用和活性成分
拮抗菌脂肽粗提物抗菌活性测定结果显示,对水稻立枯丝核菌、油菜核盘菌和青枯雷尔氏菌的抑菌圈平均直径分别达25.8、29.3、35.5 mm。
利用HPLC–ESI/MS 对粗提物进行定性定量分析(表2、图4),结果表明,HMI–23 的脂肽粗提物中含有与已知抗菌脂肽iturin A、mycosubtilin B、fengycin B 和bacillomycin D 相对分子质量相同的化合物,表明该菌可能具有产生这4 种抗菌脂肽的能力。除了以上4 种已知化合物外,脂肽粗提物中还含有多个未知相对分子质量的组分(数据未列出)。
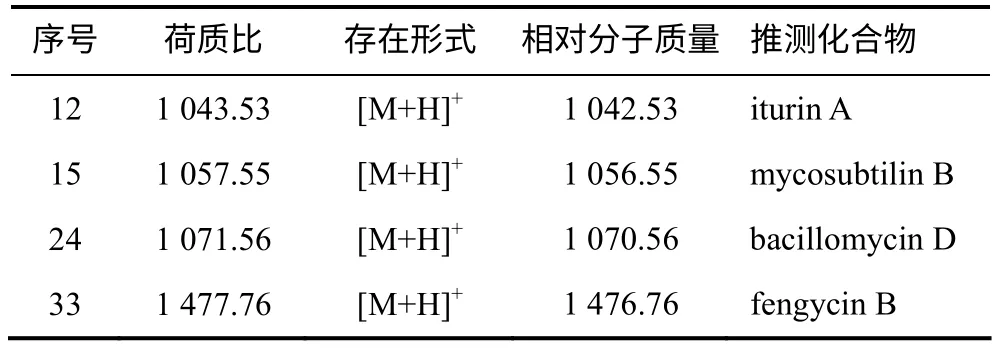
表2 脂肽粗提物中可能存在的脂肽类化合物 Table 2 Detection of known lipopeptides from crude extract
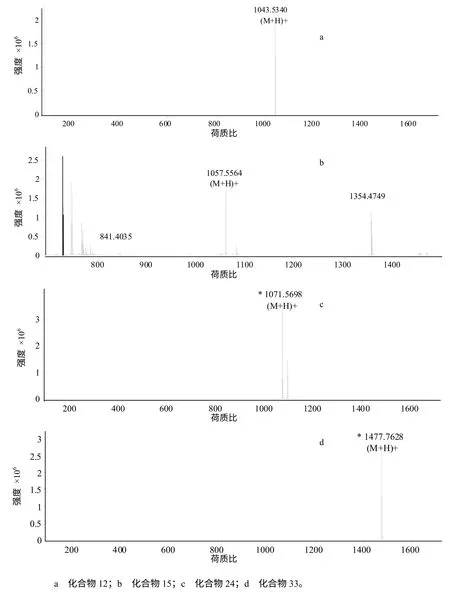
图4 脂肽粗提物中化合物12、15、24、33 号在质谱分析中对应的离子峰 Fig.4 The ion peak of lipopeptide compound 12(a),15(b),24(c),33(d) analyzed by MS
3 讨 论
文献[16–18]报道的拮抗菌大多只是针对某种作物病害进行筛选,对多种作物病原菌都具有较好抑菌活性的拮抗菌并不多见,能同时抑制植物病原真菌和植物病原细菌的拮抗菌更少。本研究分离筛选得到的拮抗菌HMI–23,对水稻立枯丝核菌、油菜核盘菌等植物病原真菌和青枯雷尔氏菌等植物病原细菌都有较强的抑制活性,抑菌谱较广,具有开发成广谱抗病生物农药或生物肥料的潜力。菌株HMI–23 经16S rDNA 比对分析,认为该菌株可能是解淀粉芽孢杆菌,与目前研究和应用较多的PGPR(plantgrowth promoting rhizobacteria)解淀粉芽孢杆菌FZB42 亲缘关系非常接近[15]。通过稳定性试验、PCR 检测和质谱检测发现,与大部分已经报道的芽孢杆菌类拮抗细菌一样,HMI–23 的抑菌活性主要来自于脂肽类抗生素[19–20]。与解淀粉芽孢杆菌FZB42 一样,拮抗菌HMI–23 基因组中也含有多种脂肽抗生素的生物合成基因簇,如mycosubtilin B、fengycin B 和bacillomycin D[21]。此外, HMI–23可能还产生FZB42 不能产生的抗真菌脂肽Iturin A[22],能在一定程度上提高拮抗菌的抗真菌效果[12]。HMI–23 发酵液中还含有多种未知组分,最终确定HMI–23 抗菌活性物质的种类以及探索菌株是否产生新抗菌化合物,还有待进一步的分离、纯化、鉴定,以及全基因组测序、基因组发掘、基因敲除等一系列试验进行探索。
[1] Leistra M,Matser A M.Adsorption,transformation,and bioavailability of the fungicides carbendazim and iprodione in soil,alone and in combination [J].J Environ Sci Health B,2004,39(1):1–17.
[2] Wang Y S,Wen C Y,Chiu T C,et al.Effect of fungicide iprodione on soil bacterial community[J].Ecotoxicol Environ Saf,2004,59(1):127–132.
[3] Alabouvette C,OlivainC,Steinberg C.Biological control of plant diseases:The European situation[J].Eur J Plant Pathol,2006,114(3):329–341.
[4] Kazempour M N.Biological control of Rhizoctonia solani,the causal agent of rice sheath blight by antago- nistics bacteria ingreen house and field conditions[J]. Plant Pathol,2004(3):88–96.
[5] Scherwinski K,Grosch R,Berg G.Effect of bacterial antagonists on lettuce:Active biocontrol of Rhizocto- niasolani and negligible,short-term effects on nontarget microorganisms[J].FEMS Microbiol Ecol,2008,64(1):106–116.
[6] Andrews M,Cripps M G,Edwards G R.The potential of beneficial microrganims in agricultural systems[J].Ann Appl Biol,2012,160(3):1–5.
[7] Akpa E,Jacques P,Wathelet B,et al.Influence of culture conditions on lipopeptide production by Bacillus subtilis [J].Appl Biochem Biotechnol,2001,91~93:551–561.
[8] 兰时乐,陈海荣,肖宏英,等.稻曲病菌拮抗菌的筛选及拮抗活性测定[J].植物保护,2004,30(2):69–72.
[9] 易有金,刘如石,尹华群,等.烟草青枯病拮抗内生细菌的分离、鉴定及其田间防效[J].应用生态学报,2007,18(3):554–558.
[10] Duitman E H,Hamoen L W,Rembold M,et al.The mycosubtilin synthetase of Bacillus subtilis ATCC6633:A multifunctional hybrid between a peptide synthetase,an amino transferase,and a fatty acid synthase [J].Proc Natl Acad Sci,1999,96(23):13294–13299.
[11] Lin T P,Chen C L,Chang L K,et al.Functional and transcriptional analyses of a fengycin synthetasegene,fenC,from Bacillus subtilis[J].J Bacteriol,1999,181(16):5060–5067.
[12] Tsuge K,Akiyama T,Shoda M.Cloning,sequencing,and characterization of the iturin A operon[J].J Bacteriol,2001,183(21):6265–6273.
[13] Tsuge K,Ano T,Hirai M,et al.Thegenes degQ,pps,and lpa–8 (sfp) are responsible for conversion of Bacillus subtilis 168 to plipastatin production[J].Antimicrob Agents Chemother,1999,43(9):2183–2192.
[14] SUN Li–jun,LU Zhao–xin,Bie Xiao–mei,et al. Influence of medium on antimicrobial lipopeptide production by Bacillus amyloliquefaciens ES–2[J]. Scientia Agricultura Sinica,2008,41(10):3389–3398.
[15] CHEN Xiao-hua,Koumoutsi A,Scholz R,et al. Comparative analysis of the completegenome sequence of the plantgrowth-promoting bacterium Bacillus amyloliquefaciens FZB42[J].Nature Biotechnology,2007,25(9):1007–1014.
[16] 程亮,游春平,肖爱萍.拮抗细菌的研究进展[J].江西农业大学学报,2003,25(5):732–735.
[17] 于淑池,张利平,王立安.拮抗细菌作为生物防治手段研究进展[J].河北农业科学,2004,8(1):62–65.
[18] 邱德文.我国植物病害生物防治的现状及发展策略[J].植物保护,2010,36(4):15–18.
[19] 赵新林,赵思峰.枯草芽孢杆菌对植物病害生物防治的作用机理[J].湖北农业科学,2011,50(5):3025–3028.
[20] 徐刘平,尹燕妮,李师默,等.拮抗细菌对土传病原菌的作用机理[J].中国生物防治,2006,22(1):10–14.
[21] Koumoutsi A,Chen X H,Henne A,et al. Structural and functional characterization ofgene clusters directing nonribosomal synthesis of bioactive cyclic lipopeptides in Bacillus amyloliquefaciens strain FZB42[J].J Bacteriol,2004,186(4):1084–1096.
[22] Chen X H,Koumoutsi A,Scholz R,et al.Genome analysis of Bacillus amyloliquefaciens FZB42 reveals its potential for biocontrol of plant pathogens[J].J Biotechnol,2009,140(1/2):27–37.

