手足口病合并脑炎患儿脑脊液和血清细胞因子的测定及意义
李新成 王宏伟 申保生 宋新文
手足口病合并脑炎患儿脑脊液和血清细胞因子的测定及意义
李新成 王宏伟 申保生 宋新文
目的探讨手足口病(HFMD)合并脑炎(VE)患儿脑脊液和血清肿瘤坏死因子α(TNF-α)、神经元特异性烯醇化酶(NSE)及S100B的含量及其临床意义。方法采用酶联免疫吸附试验双抗体夹心法对38例HFMD合并VE、40例单纯HFMD和20例非神经系统疾病患儿的脑脊液和血清TNF-α、NSE、S100B进行检测。结果HFMD合并VE组脑脊液和血清TNF-α、NSE、S100B水平高于单纯HFMD组和对照组(P<0.01), 且患儿脑脊液TNF-α、NSE、S100B与血清TNF-α、NSE、S100B含量呈正相关(r=0.75, 0.83, 0.81, P均<0.01)。单纯HFMD组TNF-α水平高于对照组(P<0.05), 且脑脊液TNF-α与血清TNF-α含量呈正相关(r=0.71, P<0.01), 而NSE、S100B与对照组相比差异无统计学意义(P>0.05)。结论脑脊液及血清TNF-α、NSE、S-100B水平检测对手足口病合并脑炎的诊断具有一定的临床意义, NSE、S100B可作为手足口病患者脑损伤的标记物。
手足口病;脑炎;肿瘤坏死因子α;神经元特异性烯醇化酶;S100B
手足口病(HFMD)是由肠道病毒引起的常见传染病, 主要表现为发热和手、足、口腔等部位皮疹, 轻型患者预后良好, 但合并病毒性脑炎(VE)后可引起神经源性肺水肿和心肌损害, 严重的可导致死亡。肿瘤坏死因子α(TNF-α)由活化的单核-巨噬细胞分泌, 在机体免疫调节中发挥关键作用。研究表明神经元特异性烯醇化酶(NSE)及S100B在反映脑损伤程度和预后方面具有重要价值。本研究拟通过检测HFMD合并VE患儿血清和脑脊液中TNF-α、NSE及S100B水平,探讨其在HFMD合并VE发病机制中的意义。
1 资料与方法
1.1一般资料 78例HFMD患儿为新乡医学院第一附属医院感染科住院患儿, 诊断均符合卫生部《手足口病诊疗指南》(2010年版), 分为HFMD合并VE组(38例)和单纯HFMD组(40例)。同时选择无感染、肿瘤、神经系统损害等而需外科手术的患儿作为对照组(20例)。各组患儿在性别、年龄等方面差异无统计学意义(P>0.05)。
1.2方法 各组患儿留取脑脊液2 ml及血清1 ml, -70℃保存备检。TNF-α、NSE和及S100B应用ELISA法(深圳晶美生物工程有限公司产品)检测, 操作严格按照说明书进行。
1.3统计学方法 数据通过SPSS17.0软件分析, 计量资料以均数±标准差( x-±s)表示, 组间比较应用单因素方差分析(one-way ANOVA);相关性应用Pearson相关分析。P<0.05表示差异有统计学意义。
2 结果
2.1各组脑脊液和血清TNF-α水平比较 单因素方差分析显示3组脑脊液及血清TNF-α水平差异明显(P<0.01),其中单纯HFMD组及HFMD合并VE组患儿脑脊液和血清TNF-α水平明显高于对照组(P<0.01), 且HFMD合并VE组患儿脑脊液及血清TNF-α水平高于单纯HFMD组(P<0.01)。见表1。
2.2各组脑脊液和血清NSE水平比较 单因素方差分析显示3组脑脊液及血清NSE水平差异有统计学意义(P<0.01),其中HFMD合并VE组患儿脑脊液和血清NSE水平高于单纯HFMD组及对照组(P<0.01), 但单纯HFMD组患儿脑脊液及血清NSE水平与对照组相比差异无统计学意义(P>0.05)。见表2。
2.3各组脑脊液和血清S100B水平比较 单因素方差分析显示3组脑脊液及血清S100B水平差异有统计学意义(P<0.01), 其中HFMD合并VE组患儿脑脊液和血清S100B水平高于单纯HFMD组及对照组(P<0.01), 但单纯HFMD组患儿脑脊液及血清S100B水平与对照组相比差异无统计学意义(P>0.05)。见表3。
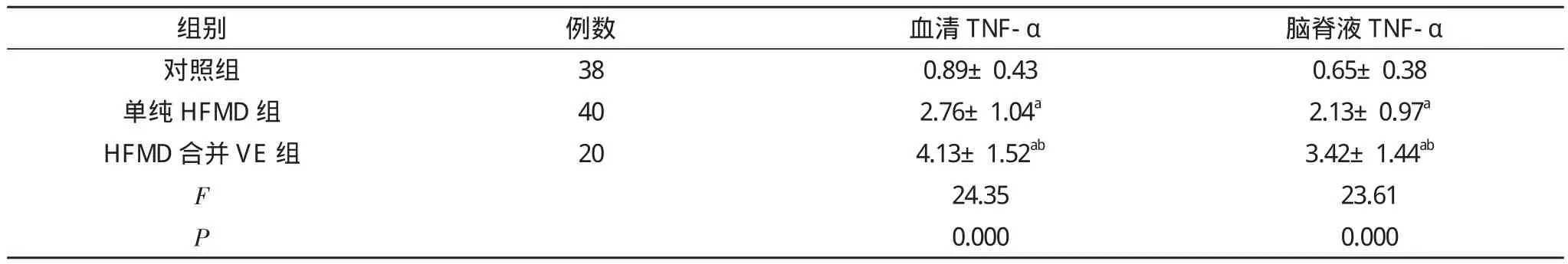
表1 脑脊液和血清TNF-α水平比较( x-±s, μg/L)
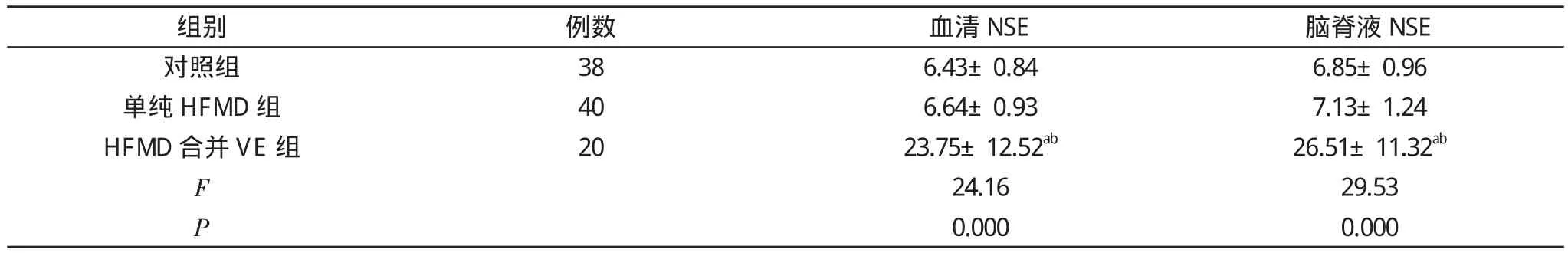
表2 脑脊液和血清NSE水平比较( x-±s, μg/L)

表3 脑脊液和血清S100B水平比较( x-±s, μg/L)
2.4脑脊液与血清TNF-α、NSE、S100B水平间的相关分析 相关分析显示HFMD患儿脑脊液TNF-α水平与血清TNF-α水平呈正相关(r=0.71, P<0.01);HFMD合并VE患儿脑脊液与血清TNF-α、NSE、S100B水平呈正相关(r=0.75, 0.83, 0.81, P均<0.01)。
3 讨论
HFMD是由多种肠道病毒引起的急性传染病[1], 主要致病原是肠道病毒71型和柯萨奇病毒A组16型, 多发生于学龄前儿童, 大多数症状轻微, 预后良好, 但重症病例多合并脑炎, 导致致命性损伤, 少数遗留后遗症[2]。TNF-α是一种由多核巨细胞产生的具有广泛生物学活性的细胞因子, 一方面它具有调节机体的免疫功能, 能使某些肿瘤细胞坏死;另一方面则介导炎症过程、组织损伤、休克等病理生理反应。本研究结果表明, HFMD患者脑脊液和血清TNF-α水平明显高于对照组, 且脑脊液与血清TNF-α水平呈正相关, 说明感染手足口病毒后, 病毒通过多种途径启动了炎症反应的瀑布反应, 而TNF-α在其中起了重要作用。本研究结果同时表明, 合并VE后的HFMD患儿脑脊液和血清中TNF-α水平明显升高, 提示TNF-α通过激活细胞因子网络系统而诱发全身炎性反应, 进而破坏血脑屏障的完整性并增加其通透性, 上调诱导型一氧化氮合酶在神经细胞的表达, 诱导其凋亡, 从而引起中枢神经系统广泛性损害[3,4]。
NSE是γ型烯醇化酶, 特异性地存在于神经元及神经内分泌细胞中, 而脑胶质细胞和其他神经组织中不含这种酶, 故称NSE。NSE是一种大分子物质, 正常情况下血液和脑脊液中含量甚少。在颅脑损伤、脑梗死、脑出血、脑炎等[5,6]多种中枢神经系统疾病中, 部分神经元变性、坏死和崩解, NSE可释放入脑脊液中, 同时血脑屏障的破坏及通透性升高, 导致NSE易于透过血脑屏障进入脑脊液及血液,且神经元损伤程度越重, 血脑屏障破坏程度越高, 脑脊液和血液中NSE水平就越高。因此, NSE是评判颅脑损伤程度和预后的一项特异性敏感生化指标[7]。本研究结果表明, 单纯HFMD患者脑脊液和血清NSE水平无升高, 而合并VE后脑脊液及血清NSE水平明显升高, 且脑脊液与血清NSE水平呈正相关, 提示因NSE特异性地存在于中枢神经系统, 故无合并脑炎的HFMD患儿含量无升高。而合并VE后由于手足口病毒的直接侵犯以及免疫性损害, 导致神经系统炎症反应,神经元水肿、坏死和脱髓鞘[8], 脑脊液NSE水平显著升高。血脑屏障破坏及通透性增高, NSE透过血脑屏障渗漏到血液,血液中NSE水平也显著增加。
S100B是一种酸性钙结合蛋白, 其特异性地存在于中枢神经胶质细胞内, 具有调节细胞生长、能量代谢和参与细胞内信号传导的作用, 是胶质细胞与神经元相互作用的桥梁[9]。当胶质细胞和神经元被破坏时, S100B蛋白就进入脑脊液,被认为是脑损伤程度和预后判断的标记物[10]。本研究结果表明, 单纯HFMD患者脑脊液和血清S100B水平无升高, 而合并VE后脑脊液及血清S100B水平明显升高, 且脑脊液与血清S100B水平呈正相关, 提示因S100B特异性地存在于中枢神经系统, 故无合并脑炎的HFMD患儿含量无升高。而合并VE后S100B可能通过糖基化终产物受体(RAGE)依赖激活JNK通道, 同时激活NF-κB和AP-1, 诱发细胞因子瀑布链反应, 上调COX-2、IL-1β和TNF-α的表达在脑胶质细胞的表达, 引起神经细胞的脱髓鞘改变、星形细胞的凋亡,参与大脑炎症性疾病的病理生理过程, 脑脊液S100B水平显著升高[11]。同时由于血脑屏障破坏及通透性增高, S100B透过血脑屏障渗漏到血液, 血液中NSE水平也显著增加[12]。
本研究结果提示TNF-α与HFMD炎症反应密切相关,而NSE及S100B在HFMD合并VE的颅脑损伤及血脑屏障破坏的发病机制中可能起重要作用。NSE及S100B可特异性地作为判断HFMD是否合并VE的敏感指标, 从而指导临床早期诊断及治疗, 改善患儿的预后。
[1] Lee JJ, Seah JB, Chow VT, et al.Comparative proteome analyses of host protein expression in response to Enterovirus 71 and Coxsackievirus A16 infections.J Proteomics, 2011, 74(10):2018-2024.
[2] Griffiths MJ, Ooi MH, Wong SC, et al.In enterovirus 71 encephalitis with cardio-respiratory compromise, elevated interleukin 1β, interleukin 1 receptor antagonist, and granulocyte colonystimulating factor levels are markers of poor prognosis.J Infect Dis, 2012, 206(6):881-892.
[3] Kushibiki S.Tumor necrosis factor-α-induced inflammatory responses in cattle.Anim Sci J, 2011, 82(4):504-511.
[4] Hernández-Romero MC, Delgado-Cortés MJ, Sarmiento M, et al.Peripheral inflammation increases the deleterious effect of CNS inflammation on the nigrostriatal dopaminergic system.Neurotoxicology, 2012, 33(3):347-360.
[5] Ahmad O, Wardlaw J, Whiteley WN.Correlation of levels of neuronal and glial markers with radiological measures of infarct volume in ischaemic stroke: a systematic review.Cerebrovasc Dis, 2012, 33(1):47-54.
[6] Roka A, Kelen D, Halasz J, et al.Serum S100B and neuron-specific enolase levels in normothermic and hypothermic infants after perinatal asphyxia.Acta Paediatr, 2012, 101(3):319-323.
[7] Hiihara T, Miyake T, Izumi S, et al.Serum and cerebrospinal fluid S100B, neuron-specific enolase, and total tau protein in acute encephalopathy with biphasic seizures and late reduced diffusion: a diagnostic validity.Pediatr Int, 2012, 54(1):52-55.
[8] Zhang YC, Jiang SW, Gu WZ, et al.Clinicopathologic features and molecular analysis of enterovirus 71 infection: report of an autopsy case from the epidemic of hand, foot and mouth disease in China.Pathol Int, 2012, 62(8):565-570.
[9] Villarreal A, Aviles Reyes RX, Angelo MF, et al.S100B alters neuronal survival and dendrite extension via RAGE-mediated NF-κB signaling.J Neurochem, 2011, 117(2):321-332.
[10] Yardan T, Erenler AK, Baydin A, et al.Usefulness of S100B protein in neurological disorders.J Pak Med Assoc, 2011, 61(3):276-281.
[11] Bianchi R, Kastrisianaki E, Giambanco I, et al.S100B protein stimulates microglia migration via RAGE-dependent upregulation of chemokine expression and release.J Biol Chem, 2011, 286(9):7214-7226.
[12] Leis AA, Stokic DS, Petzold A.Glial S100B is elevated in serum across the spectrum of West Nile virus infection.Muscle Nerve, 2012, 45(6):826-830.
Clinical significance of determination of cerebrospinal fluid and serum cytokines in children with hand
foot and mouth disease and viral encephalitis
LI Xin-cheng, WANG Hong-wei, SHEN Bao-sheng, et al.Department of Infection Diseases, Huixian People's Hospital, Huixian, 453600, China
ObjectiveTo investigate content of cerebrospinal fluid and serum levels of tumor necrosis factorα(TNF-α), nenron specific enolase(NSE) and S100B in children with hand foot and mouth disease(HFMD)and viral encephalitis(VE).MethodsSeventy-eight cases of children with HFMD were divided into two groups: HFMD with VE case and HFMD only case.And 20 age-matched healthy children were enrolled in this study.The levels of TNF-α, NSE and S100B of cerebrospinal fluid and serum were measured bv enzyme-linked immunosorbent assay.ResultsCerebrospinal fluid and serum TNF-α, NSE and S100B levels of HFMD with VE group were significantly higher than HFMD only group and control group(P<0.01), and cerebrospinal fluid levels of TNF-α, NSE and S100B were positively correlated with the serum levels of TNF-α, NSE and S100B(r=0.75, 0.83, 0.81, P<0.01, respectively).Cerebrospinal fluid and serum TNF-αlevels of HFMD only group were significantly higher than control group(P<0.01), and cerebrospinal fluid levels of TNF-αwere positively correlated with the serum levels of TNF-α(r=0.71, P<0.01).Cerebrospinal fluid and serum NSE, S100B levels of HFMD only group were not higher than control group(P>0.05).ConclusionLevels of TNF-α, NSE and S100B in serum and cerebrospinal fluid was valuable for diagnosis in children with HFMD and VE.NSE and S-100B can be used as a marker for patients with brain injury in children with HFMD.
Hand foot and mouth disease; Encephalitis; Tumor necrosis factor-α; Nenron specific enolase; S100B
453600 河南省辉县市人民医院感染疾病科(李新成);新乡医学院第一附属医院感染疾病科(王宏伟申保生 宋新文)

