2012年安徽省药品生产企业GMP跟踪检查及飞行检查缺陷项目分析
罗京京,胡士高,陈 菡,窦颖辉,杨士友
(安徽省食品药品审评认证中心,安徽 合肥 230051)
2012年安徽省药品生产企业GMP跟踪检查及飞行检查缺陷项目分析
罗京京,胡士高,陈 菡,窦颖辉,杨士友
(安徽省食品药品审评认证中心,安徽 合肥 230051)
目的 该文通过对安徽省2012年药品生产企业 GMP跟踪及飞行检查中存在的缺陷项目采用统计学方法进行汇总分析,找出企业在实施2010版 GMP中易出现的缺陷项目,并分析成因,探讨对策。方法 对2012年安徽省食品药品审评认证中心认证的48家生产企业的企业类型、缺陷项目数在企业中的分布、缺陷项目在标准条款中的分布以及缺陷项目出现的频次等相关项目进行统计学汇总分析。结果 实验室管理不足、质量控制与质量保证中的概念未能有效的应用到生产中、不注重人员培训、各种文件未完善、厂房设施维护保养不到位、清场不彻底是药品生产企业的缺陷项目频发的原因。结论 企业需要通过强化对硬件实施的维护保养,完善文件系统,加强企业间交流与员工培训等措施进一步加强质量管理。
药品质量管理;GMP;实证研究
根据国家食品药品监督管理局《药品生产质量管理规范(2010年修订)》(卫生部令第79号)(以下简称“2010版GMP”),2010版GMP 2011年3月1日起实施[1],安徽省食品药品审评认证中心于2011年7月正式实行2010版 GMP认证检查工作。2012年是2010版 GMP与98版 GMP实施的过渡期,针对2012年现场检查报告中的缺陷项目进行汇总分析,对企业提高 GMP实施水平和药品生产质量管理水平具有重要意义,同时也可作为检查员进行现场检查的参考。
1 被检查企业的基本情况
2012年,安徽省食品药品审评认证中心对安徽省46家药品生产企业按 2010版 GMP进行了现场检查,其中跟踪检查35家、飞行检查11家,现以其中记录完整、电子文档齐全的 42份检查报告为材料进行统计分析,其中包含33份跟踪检查报告与9份飞行检查报告。跟踪检查企业的生产范围主要涉及非无菌制剂生产企业13家,无菌制剂生产企业20家,中药饮片生产企业2家(其中有两家企业生产非无菌制剂与中药饮片,此类情况按对应的生产企业重复计算),飞行检查企业 9家均为中药饮片生产企业。图1为被检查企业的类型分布。

图1 企业类型分布
2 缺陷项目分布情况
2.1 缺陷项目数在企业中的分布 42家已进行GMP现场检查的企业共发现缺陷项目423项,其中23项严重缺陷项(平均每家企业 0.55项),400条一般缺陷项(平均每家企业9.52项)。
在 33家跟踪检查企业中,存在严重缺陷项的有3家并且均为非无菌制剂生产企业,占本年度跟踪检查企业总数的 9%,9家中药饮片生产企业的飞行检查中均存在严重缺陷项,占本年度飞行检查企业总数的 100%;跟踪检查及飞行检查中存在的严重缺陷项分别为4项、19项,占总缺陷项目的0.95%、4.49%。由此可见在飞行检查中更易发现企业中存在的缺陷项,中药饮片生产企业在实施2010版 GMP中更易出现生产问题。
一般缺陷项目数在被检查的 42家企业中呈近似正态分布,平均每家企业一般缺陷项目 10条,大部分企业存在的缺陷项目数为 6~13条,缺陷项目数在企业中的分布情况见图2。除对极个别药品生产和质量管理存在较大风险的企业建议暂控其《药品 GMP证书》、限期整改外,绝大部分现场检查报告结论为“基本符合《药品生产质量管理规范》”,但实际上在各企业发现的缺陷项目数量及种类存在明显的差异,通过GMP检查的企业其药品生产质量管理水平和质量风险是不同的。综合分析现场检查报告可以认为,一般情况下,缺陷项目少于 6条的企业实施GMP的情况较好、药品生产管理和质量管理水平较高;缺陷项目多于13条的企业存在较多的隐患和风险,中药饮片生产企业在实施GMP时易出现严重问题;应严格加强管理。

图2 一般缺陷项目数
2.2 缺陷项目在标准条款中的分布 国家食品药品监督管理局对检查标准的条款设置采用非均匀设计,依照对药品质量的影响程度和我国药品生产发展的现状,对GMP不同章节赋予了不同权重、不同的条款数量[2],如“质量控制与质量保证”部分设计了检查项目61条,而“自检”部分仅4条。将42份现场检查报告中的 423条缺陷项目按GMP章节进行分类统计,结果不同部分出现缺陷项目的发生次数存在明显不同,见表1。

表1 缺陷项目在检查标准条款中的分布
发生次数与发生比率呈正相关,所以其中任何一项高,都表明该部分很容易出现问题,是企业实施 GMP中普遍存在的薄弱环节,如“质量管理及质量控制与质量保证”部分,应给予高度重视。“文件管理”的发生频率仅次于“质量控制与质量保证”,缺陷项目中也多表现为某些质量标准及工艺规程等内容未适应2010版 GMP修订,表明企业对标准规程这一方面不够重视。
2.3 缺陷项目出现的频次 42家企业共发现缺陷项目423项,其中严重缺陷 23项,占检查发现总缺陷项目数5.43%;一般缺陷中,出现 6次以上(含 6次)的缺陷内容共有 16条,合计缺陷项数目 220项,占检查发现总缺陷项目数52.01%。表2~4分别对23项严重缺陷和 400项一般缺陷的出现频次进行汇总统计。
3 讨论
3.1 存在问题及原因 由表 2、表 3、表 4可知,缺陷项目相对集中在质量控制与质量保证、文件管理、厂房与设施、机构与人员、设备这五部分,占总缺陷项目的75.23%;中药饮片生产企业主要存在检验记录不全、留样不足、部分药品无质量标准及工艺规程等;大多数企业普遍存在的缺陷项目为人员培训、温湿度与压差、批记录、样品管理、供应商评估以及货位卡管理等。由此可以看出企业在实施2010版GMP中存在的一些共性问题:
3.1.1 实验室管理不足 检验实验室通过规范的取样、严格执行国家标准、获取公正可靠的数据,为质量控制的决策提供了有力、直观地支撑,是质量控制活动的核心[3]。如表 3所示,严重缺陷中出现频次最高的两项缺陷均为实验室管理中的检验记录和留样问题,分析其产生原因有以下几点:一是检验所需的对照品、对照药材往往价格昂贵、数量大,企业在实际购买中有困难;二是企业质量管理及检验人员实际操作能力欠缺,不能保证检验的准确性;三是每批原料、每批成品都要全检,检验量大、检验周期长,费用昂贵[4]。正是以上原因,有些认证通过的企业因为检验成本过高,人员操作不够熟练而降低检验标准的现象才会普遍存在。

表2 跟踪检查严重缺陷项目出现频次情况
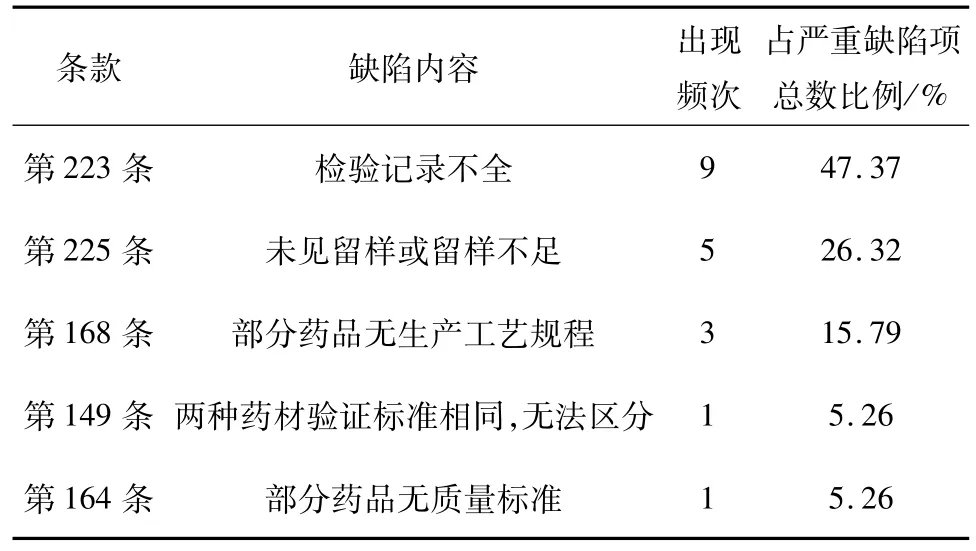
表3 飞行检查严重缺陷项目出现频次情况

表4 一般缺陷项目出现频次情况
3.1.2 质量控制与质量保证中的概念未能有效的应用到生产中 2010版 GMP细化了有关变更控制、偏差处理、纠正预防措施、风险管理、供应商审计等质量管理方面的内容,这些方面也是企业实施2010版 GMP的难点,占缺陷的比例最高。质量管理是一个系统的工作,需要企业管理层以及 QA、QC、生产、验证、工程等多个部门的参与和分工协作,需要企业制订一系列完整、详细、可操作性强的计划、方案、程序和操作规程,并且质量管理内部各个部分以及与生产、验证等其他部分内容存在千丝万缕的联系,然而,部分企业存在质量管理比较粗放、质量体系系统性联系不足、质量体系覆盖的广度与实施的深度欠缺等问题,具体表现为年度质量回顾、供应商审计、风险管理等流于形式,偏差调查不够深入,纠正预防措施滞后等。
3.1.3 不注重人员培训 人是药品生产过程中药品质量的主宰者,其数量和素质的不足是影响 GMP实施的重要因素[5]。每一项操作活动都要在一定的规程下进行,如此才能保证生产出的产品是质量可控的,而培训的任务就是规范操作人员在药品生产过程中的活动,所以人员培训是生产企业进行生产活动的基础。但光有培训是远远不够的,还要考虑培训的内容是否系统,培训的时间是否充足,培训的效果是否显著等等问题[6],目前的人员培训仅仅流于形式,不能指导实际的工作,殊不知由此引起的级联影响的损失远大于对人员培训的支出,从表4可以看到,批生产记录内容不全、货位卡记录内容不全、检验记录不规范、工艺规程的内容不全、使用日志记录不全以及记录与操作规程不一致等等关于规范记录的内容,也许一开始有一个完备的培训计划与详实的培训内容就可以避免这些高频次的缺陷项目出现。
3.1.4 各种文件未完善 文件包括质量标准、生产处方和工艺规程、操作规程以及记录等文件[1],它是企业进行各种操作活动的准则,所以内容严谨、细致、全面和可操作性强的文件是企业赖以发展的基础,然而文件的完善是一项细致、繁重、长期的工程[7],企业应针对 2010版GMP中有关文件管理、变更控制、偏差处理、纠正与预防措施等要求,修订文件规程、操作规范,其调查深度和执行力度方面还需要摸索和实践。
3.1.5 厂房设施维护保养不到位 跟踪及飞行检查的企业大部分是一些老厂区,建厂时间久,一些温控、湿控和空调系统年久未及校准,导致温湿度、压差不符合要求,还有一部分很大的原因是企业负责人未对厂区环境足够重视;墙壁的损坏、破裂、脱落不能及时修复和洁净区渗水也是厂区内主要存在的问题。厂区是药品进行一系列生产活动的外部环境,这些缺陷的存在是药品生产中的极大隐患。
3.1.6 清场不彻底 每批产品生产结束后都应进行清场,这是对前一批次产品的清洁,也是防止进行下一批次生产时发生交叉污染的有效措施。然而,往往由于企业的清场规程不完备与 QA人员的素质问题导致清场的不彻底,具体为清场后对相应厂区、设备未悬挂相应的标识、送风口与照明灯具上仍有明显积尘和清场合格证未填写完整等。
3.2 措施与建议
3.2.1 强化质量管理 企业应对自己要求严格,尽管中药饮片品种多、批次多、批量少、价值低、检验负担重,但对中药饮片进行全检是保证中药饮片质量的必要手段,也是对人员素质和硬件设施的全面提高,全检的指标一般包括形状、鉴别、检查项、有效成分检测、重金属含量、农药残留等。全检指标少的有四五项,多的有十多项甚至更多。从目前的统计结果来看,中药饮片生产企业的质量检验与控制方面还有很大的改进空间,考虑到中药饮片生产企业的实际情况,2010版GMP对委托检验也有所规定,所以如何最大限度地利用社会资源,同时保证中药饮片的质量,是生产企业面临的新挑战。3.2.2 加强企业间交流与员工培训 企业应加强与药监部门的联系,了解最新的动态信息,积极推进2010版GMP的实施。企业间关键人员经常交流讨论,并提出各自对质量管理相关概念的理解以及将这些概念付诸实施的操作要求,将被动执行转变为主动实施,自觉提升质量管理水平,增强企业整体竞争力。
从目前现场检查情况来看,企业关键人员的素质问题仍是2010版 GMP实施过程中的主要制约因素。部分企业关键人员对2010版GMP理念认识不到位,管理经验不足,直接影响了企业质量管理体系的正常运行。同时检验人员,尤其是中药检验人员资质和能力不足也是企业普遍存在的问题。人和企业是相互依存的关系,即只有人得到提高了,企业才有进步的空间;只有企业提供良好的培训和锻炼的平台,人才有可能得到提高。制订切实可行的培训内容,有计划、有考核、有记录的进行人员培训[8],使员工明白自己的任务与操作标准,长此以往,为企业实行规范化管理打下坚实的基础。
3.2.3 完善文件系统 在原有文件系统的基础上,定期审查、修订文件中不适应现有生产活动的内容,提高人员积极性与生产效率;在实践中探索最佳的工艺规程以及其他操作文件,使其内容上更加细致并具有较高的可操作性,把操作人员的各种操作活动都放在规范的标准下进行,以保证药品生产质量的稳定性。以上几点则需要基层操作人员参与意见,避免文件中有与实际不相符和操作性不强的情况发生[9]。引进其他管理相对完备的企业和国外成熟的文件管理模式,结合企业自身实际提出新的管理方式并在以后的实践中完善。
3.2.4 强化对硬件实施的维护保养 及时对厂房内墙壁的损坏、破裂、脱落进行修复,并对修复后的厂房进行验证。定期对压差指示装置、仪器、仪表及量具等校验,空气净化系统作为防止药品生产污染的基本保证,压差指示装置是最直观的体现,应对压差进行监控,使净化状态始终处于控制范围内,用于检验、稀释的仪器、仪表、量具等应与其他量器区别对待,校验要求更加严格以保证制品的标准。
4 结语
对于缺陷项目数在企业和标准条款中的分布规律及高频次的缺陷项目情况,本文仅针对2012年跟踪及飞行检查报告作了初步的统计分析,反映了实施GMP的一些现状,通过分析我们可以看出,企业在今后的质量管理工作中应强化风险管理及验证的意识[10],从人、机、料、法、环五个方面入手,确保持续稳定地生产出符合预定用途和注册要求的药品,为进一步深入推进药品GMP实施力度提供保证。
[1] 药品生产质量管理规范(2010年修订)[S].卫生部令第 79号,2010.
[2] 陈鹭颖.2009年福建省药品生产企业GMP认证及跟踪检查情况分析[J].海峡药学,2010,22(12):313-314.
[3] 胡士高,储德全.2009年安徽省药品生产企业 GMP认证缺陷项目分析[J].安徽医药,2011,15(2):243-244.
[4] 申丽莎,胡启飞,陈国庆.药品生产质量管理规范(GMP)在我国的实施与展望[J].重庆中草药研究,2010(61):33-37.
[5] 张继辉,邵 蓉.新版 GMP实施过程中亟需关注的问题与对策[J].中国药事,2012,26(1):88-91.
[6] 马东光,张爱萍.2008-2010年我国生物制品生产企业 GMP检查缺陷项目分析[J].中国药事,2011,25(7):729-739.
[7] 邓 萍,梁 毅.新版GMP要求下的文件管理解析[J].机电信息,2011(26):22-25.
[8] 马小华,焦保辉,马晓峰.2009-2011年新疆药品生产企业GMP实施情况[J].中国药师,2012,15(11):1644-1646.
[9] 张 炜,任锐龙.对药品生产企业实施 GMP的调查与思考[J].中国药事,2011,25(2):187-189.
[10]范俊安.2008年重庆市药品生产质量管理规范现场检查情况分析[J].中国药业,2009,18(18):8-9.
10.3969/j.issn.1009-6469.2014.03.068
2013-06-20,
2013-10-10)

