黄芪多糖诱导的树突状细胞疫苗对S180荷瘤小鼠Th1/Th2类细胞因子的影响
荆雪宁邱 波战文翔武继彪
黄芪多糖诱导的树突状细胞疫苗对S180荷瘤小鼠Th1/Th2类细胞因子的影响
荆雪宁1邱 波2战文翔1武继彪1
目的 探讨黄芪多糖诱导成熟的树突状细胞(DC)肿瘤疫苗对S180荷瘤小鼠的抗肿瘤作用及作用机制。方法体外培养小鼠骨髓来源的DC,加入黄芪多糖诱导成熟,以S180肿瘤抗原致敏获得DC肿瘤疫苗。建立S180荷瘤小鼠模型,分为模型组、环磷酰胺组、黄芪多糖组、细胞因子组,在荷瘤第5天和第10天分别给予相应治疗。荷瘤第12天摘取肿瘤组织、胸腺、脾脏称质量,计算抑瘤率、胸腺指数、脾脏指数;ELISA法检测小鼠血清白细胞介素(IL)-4、干扰素(IFN)-γ水平。结果黄芪多糖组、细胞因子组的抑瘤率高于环磷酰胺组(64.25%、64.10%vs 35.11%),胸腺指数高于环磷酰胺组(1.69±0.26、1.74±0.38 vs 1.45±0.22),脾脏指数高于环磷酰胺组(5.44±0.76、5.31± 0.81 vs 3.54±0.52),IL-4水平(ng/L)低于环磷酰胺组(15.66±2.57、14.72±4.84 vs 23.95±6.07),IFN-γ水平(ng/L)高于环磷酰胺组(16.54±3.71、17.20±2.03 vs 10.37±2.19),差异均有统计学意义。结论黄芪多糖诱导的DC疫苗可有效发挥抑瘤作用,其机制可能与提高荷瘤小鼠胸腺指数与脾脏指数,调节细胞因子表达,促进Th1/Th2失衡向Th1细胞占优势的细胞免疫偏移,增强机体的抗肿瘤免疫功能有关。
黄芪多糖;树突细胞;白细胞介素4;干扰素Ⅱ型;抑瘤率;胸腺指数;脾脏指数;Th1/Th2
黄芪多糖是中药黄芪的主要活性成分之一,具有显著的免疫调节和抗肿瘤作用。树突状细胞(dendritic cell,DC)是机体功能最强大的抗原递呈细胞,捕获抗原后可有效递呈可溶性肿瘤抗原,激活静息T细胞,在特异性抗肿瘤方面发挥重要作用。基于DC具有诱导初始免疫应答、增强机体特异性抗肿瘤免疫反应的能力,选择DC作为载体制备肿瘤疫苗被认为是最具潜力的肿瘤免疫治疗手段[1]。黄芪多糖的抗肿瘤和免疫调节作用已在体内外实验中得到证实[2],但是关于黄芪多糖对DC影响的研究较少。本研究以黄芪多糖代替肿瘤坏死因子-α(tumor necrosis factor,TNF-α)诱导小鼠来源的DC成熟,以S180肿瘤抗原致敏,制备DC肿瘤疫苗,通过对S180荷瘤小鼠进行免疫治疗,探讨黄芪多糖诱导成熟的DC肿瘤疫苗的体内抑瘤效果及机制,为开拓中药治疗肿瘤的途径提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物和瘤株 雄性昆明种小鼠,6~8周龄,体质量18~20 g。购于山东大学实验动物中心,动物许可证号为SCXK(鲁)20090001。小鼠肛门肉瘤细胞S180购自南京凯基生物科技发展有限公司。
1.1.2 主要药品和试剂 黄芪多糖,纯度>98%,天津赛诺制药有限公司生产。环磷酰胺,江苏恒瑞医药公司产品。RPMI1640,Gibco公司生产;胎牛血清,Hyclone公司生产;小鼠淋巴细胞分离液购自北京索宝来科技有限公司,Hanks液购自南京凯基生物科技发展有限公司。重组粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)、重组白细胞介素-4(rmIL-4)、重组TNF-α(rmTNF-α)购自PeproTech公司,小鼠IL-4、干扰素(IFN)-γ ELISA试剂盒购自RayBiotech公司。FITC标记大鼠抗小鼠CD80、PE标记大鼠抗小鼠CD86抗体购自BD公司。
1.2 方法
1.2.1 DC肿瘤疫苗的制备 (1)小鼠骨髓单个核细胞的获取。昆明种小鼠用颈椎脱位法处死,浸入75%乙醇浸泡10 min。无菌环境取双侧股骨、胫骨,剥离附着的肌肉软组织,用无血清RPMI1640冲洗,剪开骨两端,用1 mL注射器抽取无血清RPMI1640,插入骨髓腔反复冲洗至红色变浅。将收集的骨髓冲洗液以1 500 r/min离心10 min。以RPMI1640培养液重悬骨髓细胞,用淋巴细胞分离液密度梯度离心法获得小鼠骨髓来源的单个核细胞。(2)DC的体外诱导与鉴定。用含10%胎牛血清的RPMI1640培养液将细胞浓度调至2×106/mL,加入细胞培养瓶,每孔6 mL,于37℃、5%CO2培养箱中培养。4 h后吸出悬浮细胞,留取贴壁细胞即为单核细胞。向培养瓶加入含rmGM-CSF 100 μg/L、rmIL-4 100 μg/L、10%胎牛血清的RPMI1640培养液6 mL,继续培养。第2天、第4天行半量换液,第5天分别加入黄芪多糖100 mg/L和rm TNF-α 20 μg/L诱导成熟。第7天收集2种方法诱导的DC细胞,调细胞浓度为1×106/mL,向细胞中加入FITC标记的CD80和PE标记的CD86抗体,终浓度为5 mg/L。4℃避光保存30 min。用PBS洗涤2次,用流式细胞仪进行检测。(3)负载S180肿瘤全抗原的DC疫苗的制备。离心收集S180腹水瘤小鼠腹水中的S180细胞,调整细胞浓度为1× 108/mL,液氮反复冻融4次,制备成肿瘤完全抗原。各组DC培养的第8天,向培养体系加入S180肿瘤抗原0.2 mL,DC与肿瘤抗原的比例为1∶20(抗原的量按冻融前肿瘤细胞的量计)。第9天,收集细胞,获得负载肿瘤抗原的DC疫苗,调细胞数为1×106/mL。
1.2.2 S180荷瘤小鼠模型的建立及动物分组 将小鼠肛门肉瘤S180细胞接种于小鼠腹腔,待腹部膨出时,抽取腹水,以生理盐水稀释,进行细胞计数,调整细胞浓度为1×107/mL,于小鼠右腋筋膜下接种0.2 mL,每次接种40只。将荷瘤第5天的小鼠随机分为模型组、环磷酰胺组、黄芪多糖组、细胞因子组,每组10只。
1.2.3 荷瘤小鼠免疫治疗 模型组腹腔注射生理盐水0.2 mL,其余3组分别经荷瘤部位和腹腔注射,环磷酰胺组注射环磷酰胺50 mg/kg,黄芪多糖组注射经黄芪多糖诱导的DC疫苗0.2 mL,细胞因子组注射经TNF-α诱导的DC疫苗0.2 mL。5 d后再注射1次。
1.2.4 检测指标 (1)胸腺指数、脾脏指数、抑瘤率。荷瘤第12天,颈椎脱位法处死小鼠。剥离小鼠胸腺、脾脏及肿瘤组织,用滤纸吸干并称质量,分别计算胸腺指数、脾脏指数及抑瘤率。胸腺指数=胸腺质量(mg)/体质量(g),脾脏指数=脾脏质量(mg)/体质量(g),抑瘤率(%)=(模型组平均瘤质量-实验组平均瘤质量)/模型组平均瘤质量×100%。(2)IL-4、IFN-γ的检测。荷瘤第12天,各组小鼠经眼球摘除法采血,4℃静置过夜,次日3 000 r/min离心10 min,收集血清,用ELISA法检测小鼠血清IL-4、IFN-γ水平,严格按照ELISA试剂盒操作说明进行。
2 结果
2.1 DC的形态与表型鉴定 单个核细胞形态规则呈球形,透光度好,细胞膜表面光滑。加入细胞因子后第3天,细胞呈半贴壁,部分细胞悬浮,体积增大,形状不规则似星形、梭形,有少量突起。第5天,细胞变圆,有大量突起,可见不太规则的树突状外形。第7天,悬浮细胞增多,胞浆透明,胞体增大,有毛刺样突起,呈典型的DC形态。见图1。DC培养第7天,黄芪多糖组细胞表面CD80阳性、CD86阳性及CD80和CD86双阳性的表达率显著高于细胞因子组(P<0.05),见表1。

Fig.1 The morphology of DC induced by cytokines and astragalus polysaccharide(×200)图1 细胞因子和黄芪多糖诱导的DC形态(×200)
Tab.1 Expressions of CD80 and CD86 on DC induced by cytokines and astragalus polysaccharide表1 细胞因子和黄芪多糖诱导的DC表面CD80、CD86表达情况 (n=10,%,±s)
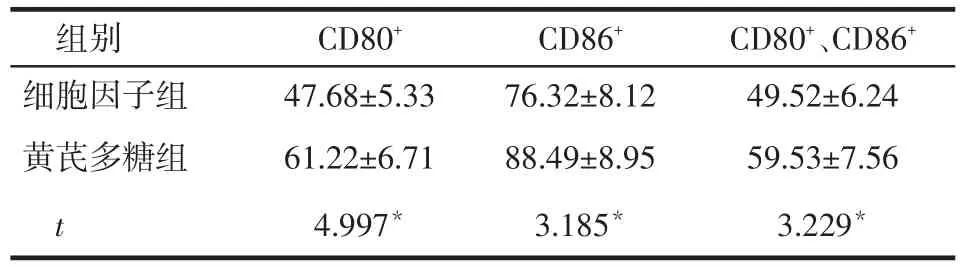
Tab.1 Expressions of CD80 and CD86 on DC induced by cytokines and astragalus polysaccharide表1 细胞因子和黄芪多糖诱导的DC表面CD80、CD86表达情况 (n=10,%,±s)
*P<0.05
?
2.2 黄芪多糖诱导的DC疫苗对S180荷瘤小鼠的抑瘤作用 环磷酰胺组、细胞因子组、黄芪多糖组的瘤体质量低于模型组,抑瘤率分别为35.11%、64.10%、64.25%,黄芪多糖组瘤体质量低于环磷酰胺组(P<0.05),而与细胞因子组无明显差异(P>0.05),见表2。
2.3 黄芪多糖诱导的DC疫苗对S180荷瘤小鼠免疫器官指数的影响 与环磷酰胺组相比,黄芪多糖组、细胞因子组小鼠的胸腺指数、脾脏指数均显著提高(P<0.05),而黄芪多糖组与细胞因子组之间无明显差异(P>0.05),见表2。
Tab.2 Comparison of tumor weight and immune organ index between four groups of mice表2 各组荷瘤小鼠的瘤体质量与免疫器官指数(n=10,±s)
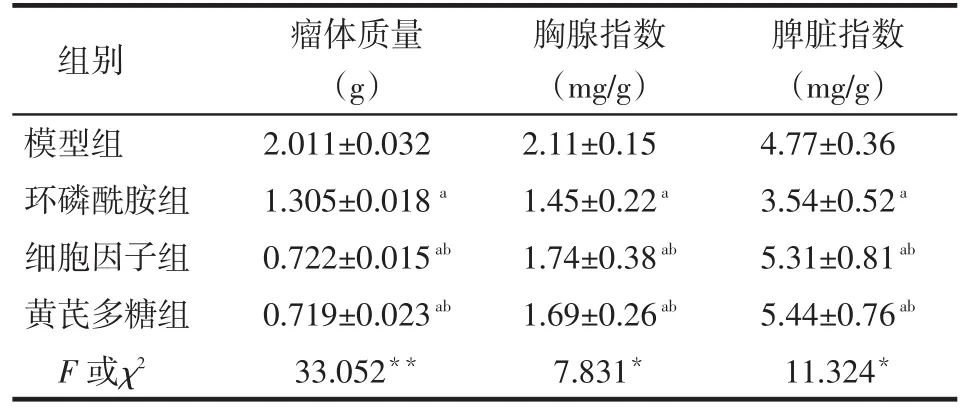
Tab.2 Comparison of tumor weight and immune organ index between four groups of mice表2 各组荷瘤小鼠的瘤体质量与免疫器官指数(n=10,±s)
*P<0.05,**P<0.01;a与模型组比较,b与环磷酰胺组比较,P<0.05
组别模型组环磷酰胺组细胞因子组黄芪多糖组F或χ2瘤体质量(g)2.011±0.032 1.305±0.018a0.722±0.015ab0.719±0.023ab33.052**胸腺指数(mg/g)2.11±0.15 1.45±0.22a1.74±0.38ab1.69±0.26ab7.831*脾脏指数(mg/g)4.77±0.36 3.54±0.52a5.31±0.81ab5.44±0.76ab11.324*
2.4 黄芪多糖诱导的DC疫苗对S180荷瘤小鼠血清IL-4、IFN-γ水平的影响 与模型组比较,黄芪多糖组、细胞因子组小鼠血清IL-4水平显著下降,IFN-γ水平明显增加(P<0.05)。黄芪多糖组与细胞因子组相比,IL-4、IFN-γ水平差异无统计学意义,见表3。
Tab.3 Comparison of serum levels of IL-4 and IFN-γ between four groups of mice表3 各组小鼠血清IL-4、IFN-γ水平比较(n=10,ng/L,±s)

Tab.3 Comparison of serum levels of IL-4 and IFN-γ between four groups of mice表3 各组小鼠血清IL-4、IFN-γ水平比较(n=10,ng/L,±s)
**P<0.01;a与模型组比较,b与环磷酰胺组比较,P<0.05
组别模型组环磷酰胺组细胞因子组黄芪多糖组F IL-4 19.08±3.11 23.95±6.07a14.72±4.84a15.66±2.57a10.253**IFN-γ 11.23±0.77 10.37±2.19 17.20±2.03ab16.54±3.71ab17.560**
3 讨论
黄芪多糖对肝癌、乳腺癌、胃癌等肿瘤细胞具有明显的抑制作用,可以增强实验动物的免疫功能,发挥抗肿瘤的作用。很多研究结果提示黄芪多糖可通过抑制肿瘤细胞生长[3]、促进抗肿瘤细胞因子分泌[4]、诱导细胞周期停滞[5]、降低端粒酶活性[6]等机制发挥抗肿瘤作用。邓旻等[7]研究发现黄芪多糖体可在体外诱导脐血单核细胞定向分化为成熟的DC,但关于黄芪多糖诱导的DC体内抗肿瘤作用的研究较少。
本研究发现黄芪多糖诱导小鼠骨髓来源的未成熟DC呈典型的DC形态,其表面协同刺激分子CD80、CD86的表达显著高于细胞因子诱导的成熟DC,提示黄芪多糖可以有效诱导DC表达协同刺激分子,利于DC提呈抗原。用S180肿瘤全抗原致敏的DC肿瘤疫苗对S180荷瘤小鼠进行免疫治疗,结果显示黄芪多糖组、细胞因子组小鼠的瘤体质量低于模型组和环磷酰胺组,而胸腺指数、脾脏指数显著高于阳性对照环磷酰胺组,与细胞因子组相比,黄芪多糖组的各项指标均无明显差异,提示黄芪多糖诱导的DC肿瘤疫苗在抗肿瘤的同时,能改善荷瘤小鼠的免疫功能。
Th1介导的细胞免疫在机体抗肿瘤免疫中占有重要地位。正常情况下,Th1和Th2处于相对稳定状态,并相互制约,以维持机体正常的免疫功能[8]。很多肿瘤患者体内发生Th1细胞受到抑制而Th2细胞占优势的现象,即Th1/Th2漂移,机体的抗肿瘤免疫受到严重抑制[9]。目前尚无区分Th1和Th2细胞的表面标志物,通常以IFN-γ评判Th1细胞功能,IL-4评判Th2细胞功能。本研究显示,黄芪多糖组、细胞因子组小鼠血清IFN-γ水平显著升高,IL-4水平显著下降,提示黄芪多糖诱导的DC疫苗能纠正荷瘤小鼠的Th1/Th2失衡,改善免疫状态,增强抗肿瘤的免疫功能。
[1]Nouri-Shirazi M,Banchereau J,Fay J,et al.Dendritic cell based tumor vaccines[J].Immunol Lett,2000,74(1):5-10.
[2]Zhao Xiaoning,Mi Hhaining,Li Xingwen,et al.Analysis on the curative effects of astragalus polysaccharides integrated with chemotherapy on 78 patients with middle-late gastric cancer[J].Chinese Journal of Basic Medicine in Traditional Chinese Medicine,2012, 18(9):994-996.[赵晓宁,弥海宁,李兴文,等.黄芪多糖联合化疗对54例中晚期胃癌的临床疗效分析[J].中国中医基础医学杂志,2012,18(9):994-996.]
[3]Liu Guilian,Zhang Chengyu,Liu Xiaoni,et al.Study on the antir prolifbration effect of astragalus polysaccharides on the human gastric cancer cell line sgc-7901 in vitro[J].China Prac Med,2007,2 (13):8-9.[刘桂莲,张承玉,刘晓霓.黄芪多糖对人胃癌SGC-7901细胞增殖抑制作用的体外研究[J].中国实用医药,2007,2 (13):8-9.]
[4]Xu Dujuan,Chen Minzhu.Antitumor activity of APS and its mechanism of action[J].China Journal of Hospital and Pharmacy,2005, 25(10):923-925.[许杜娟,陈敏珠.黄芪多糖的抑瘤作用及其机制[J].中国医院药学杂志,2005,25(10):923-925.]
[5]Chao Lei,Zhou Jie,Zhu Xuanxuan,et al.Effect of astragalus polysaccharides on proliferation and cell cycle of human gastric carcinoma cell line MKN45[J].Chinese archives of Traditional Chinese Medicine,2012,30(11):2474-2477.[巢蕾,周杰,朱萱萱,等.黄芪多糖对人胃癌细胞系MKN45的生长抑制作用及细胞周期的影响[J].中华中医药学刊,2012,30(11):2474-2477.]
[6]Yao Jinfeng,Wu Chunli,Chen Huixia,et al.Effect of Astragalus Polysaccharide on telomerase activity in HL-60 cell[J].Henan Journal of Oncology,2005,18(4):247-248.[姚金风,吴春丽,陈慧霞,等.黄芪多糖对HL-60细胞端粒酶活性的作用[J].河南肿瘤学杂志,2005,18(4):247-248.]
[7]Deng Min,Dou Xiaobing,Shi Yiqian,et al.Astragalus polysaccharides(APS)induces the cord blood monocytes into mature dendritic cells(DCs)directly and its impact on T cells proliferation[J].Chinese Journal of Immunology,2007,23(6):539-544.[邓旻,窦晓兵,史亦谦,等.黄芪多糖定向诱生脐血来源树突状细胞及其对T细胞增殖作用的研究[J].中国免疫学杂志,2007,6(23):539-544.]
[8]Ye Xin,Li Yi,Liu Lixia,et al.Alteration of serum th1/th2 cytokines in colorectal cancer and its clinical significance[J].Bulletin of Chinese Cancer,2005;14(12):834-836.[叶欣,李毅,刘丽霞,等.大肠癌患者血清Th1/Th2细胞因子水平变化及其临床意义[J].中国肿瘤,2005,14(12):834-836.]
[9]Wang SM,Zhao HP.The inhibitory effect of xiaoaiping injection conbined with octretide on the expression of cytokines Th1/Th2 in H22 liver cancer in mice[J].Tumor,2011,31(9):783-788.[王书敏,赵和平.消癌平联合奥曲肽对H22肝癌荷瘤小鼠Th1/Th2类细胞因子的影响[J].肿瘤,2011,31(9):783-788.]
(2014-05-10收稿 2014-06-30修回)
(本文编辑 闫娟)
The Inhibitory Effect of Dendritic Cell Tumor Vaccine Induced by Astragalus Polysaccharides on the Expression of Cytokines Th1/Th2 in S180 Tumor-Bearing Mice
JING Xuening1,QIU Bo2,ZHAN Wenxiang1,WU Jibiao1
1 Shandong College of Traditional Chinese Medicine,Yantai 264199,China;2 Yantai Central Hospital of Laiyang City
ObjectiveTo study the antitumor effects of dendritic cell vaccine induced by astragalus polysaccharides on S180 tumor-bearing mice,and its possible mechanism.MethodsDendritic cells derived from mouse bone marrow were induced maturation by astragalus polysaccharides and loaded with S180 tumor antigen to prepare tumor vaccine.Tumor-bearing mice were divided into four groups and treated on day-5 and day-10 respectively.Group A was injected with NS,Group B with CTX(50 mg/kg),Group C with dendritic cells induced by astragalus polysaccharides and Group D with dendritic cells induced by tumor necrosis factor(TNF)-α.After 12 days of tumor-bearing,the animals were killed.The subcutaneous sarcoma,thymus and spleen were separated and weighted.The inhibitory rate,thymus index and spleen index were then calculated.ELISA assay was used to detect the levels of interleukin(IL)-4,interferon(IFN)-γ in serum of tumor bearing mice.ResultsThe tumor inhibition rate was higher in astragalus polysaccharide group and cytokine group than that of CTX group(64.25%,64.10%vs 35.11%).The thymus index was higher in astragalus polysaccharide group and cytokine group than that of CTX group(1.69±0.26,1.74±0.38 vs 1.45±0.22).The spleen index was higher in astragalus polysaccharide group and cytokine group than that of CTX group(5.44±0.76,5.31±0.81 vs 3.54±0.52).The level of IL-4 was lower in astragalus polysaccharide group and cytokine group than that of CTX group(15.66±2.57,14.72±4.84 vs 23.95± 6.07).The level of IFN-γ was higher in astragalus polysaccharide group and cytokine group than that of CTX group(16.54± 3.71,17.20±2.03 vs 10.37±2.19).All the differences were statistically significant(P<0.05).ConclusionDendritic cell vaccine induced by astragalus polysaccharides can effectively inhibit tumor growth.Its mechanism may be associated with the promotion spleen index and thymus index of S180 tumor-bearing mice,the effective correction of Th1/Th2 imbalance induced by tumor,and the enhancement of antitumor immune responses.
astragalan;dendritic cells;interleukin-4;interferon typeⅡ;tumor inhibition rate;thymus index;spleen index;Th1/Th2
R730.3
A
10.3969/j.issn.0253-9896.2014.11.007
山东省中医药科学技术研究项目(2009-254)
1山东烟台,山东中医药高等专科学校(邮编264199);2烟台市莱阳中心医院

