老年急性脑梗死患者血浆8-异前列腺素F2α与神经功能缺失程度的关系
郑海建谢燕张化民秦华
应用研究
老年急性脑梗死患者血浆8-异前列腺素F2α与神经功能缺失程度的关系
郑海建1谢燕2张化民1秦华1
目的探讨老年急性脑梗死患者血浆8-异前列腺素F2α(8-iso-PGF2α)的变化及与神经功能缺失程度的关系。方法将67例急性脑梗死患者分为中青年组30例(<60岁)和老年组(≥60岁)37例,另择30例健康体检者(≥60岁)为老年对照组。采用ELISA法检测脑梗死患者血浆8-iso-PGF2α水平,采用美国国立卫生研究院脑卒中量表(NIHSS)评分进行神经功能缺损评估。结果老年组血浆8-iso-PGF2α水平(506.38±138.63)ng/L高于老年对照组(369.98±99.81)ng/L和中青年组(420.18±132.72)ng/L,中青年组与老年对照组差异无统计学意义(F=9.272,P<0.05)。老年组NIHSS评分高于中青年组[(19.78±3.66)vs(17.73±2.70),t=2.539,P<0.05]。老年组血浆8-iso-PGF2α 与NIHSS评分呈正相关(r=0.504,P=0.001)。结论氧化应激在老年急性脑梗死患者的发生、发展过程中起着重要的作用,尽早合理的抗氧化治疗可以减轻临床症状,促进病情恢复。
脑梗死;异前列腺素;氧化应激;8-异前列腺素F2α;老年
随着人口逐渐老龄化,脑梗死(cerebral infarction,CI)的发病率逐年升高。研究表明氧化应激损伤是大脑缺血性损伤的重要原因[1],大脑是对氧化应激非常敏感的器官,与其他器官相比,脑组织更容易生成活性氧,并受到活性氧的攻击。有研究认为,脑缺血2 h后进行再灌注引起的氧自由基生成过多和抗氧化酶活性降低可能是造成脑缺血再灌注损伤发生机制之一[2]。血浆8-异前列腺素F2α(8-iso-PGF2α)是一种类似于前列素的稳定的脂质过氧化物,它可以准确地反映缺血缺氧-再灌注后的脂质过氧化水平,是评估氧化损伤程度的理想的生化指标[3]。本研究从氧化应激方面着手,探讨老年急性脑梗死患者血浆8-iso-PGF2α水平的变化与临床神经功能缺损评分的关系。
1 对象与方法
1.1 研究对象选择2012年1月—2013年3月我院神经内科缺血性脑卒中(脑梗死)住院患者67例,年龄38~81岁,平均(61.96±9.72)岁;其中男35例,女32例。将患者分为中青年组30例(<60岁)和老年组(≥60岁)37例。中青年组平均(53.23±4.79)岁;男19例,女11例。老年组平均(69.03±6.32)岁;男16例,女21例。另择同期门诊健康体检者30例作为老年对照组,年龄60~80岁,平均(66.50±5.73)岁;男17例,女13例。中青年组年龄低于老年组和老年对照组,老年组与老年对照组差异无统计学意义(F=69.868,P<0.05)。3组性别构成差异无统计学意义(χ2=2.852,P>0.05)。
1.2 纳入和排除标准纳入标准:(1)既往无脑卒中病史。(2)发病72 h内就诊。(3)脑梗死诊断均以1995年全国第四届脑血管病会议制定的《各诊断要点》为标准。(4)经头颅CT证实。排除标准:(1)既往脑卒中病史。(2)存在急性炎症,肿瘤,糖尿病,严重心、肝、肾及血液系统疾病。(3)手术及外伤史。(4)弥漫性肌肉疾病史。(5)自身免疫性疾病。(6)就诊前6个月服用抗氧化及他汀类药物。(7)腔隙性脑梗死。
1.3 指标测量受试者均隔夜禁食12 h,于清晨安静状态下留取空腹静脉血3 mL,枸橼酸钠抗凝,静置1 h内,3 000 r/min离心10 min,保留血浆并放入-30℃冰箱保存。采用酶联免疫吸附测定(ELISA)法测定血浆8-iso-PGF2α,试剂购自上海丰翔生物科技有限公司。留静脉血3 mL注入生化专用试管,3 000 r/min离心10 min并分离血清,全自动生化分析仪检测三酰甘油、总胆固醇等指标。采用美国国立卫生研究院脑卒中量表(NIHSS)评分进行神经功能缺损评估。
1.4 统计学方法应用SPSS 16.0软件进行统计分析,计量资料以均数±标准差(x± s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。正态分布资料相关分析采用Pearson相关分析,非正态分布资料采用Spearman相关分析。计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组一般资料比较老年组收缩压水平高于老年对照组和中青年组(P<0.05);中青年组和老年组三酰甘油水平均高于老年对照组(P<0.05),老年组与中青年组差异无统计学意义;3组舒张压、总胆固醇水平差异无统计学意义,见表1。
2.2 各组血浆8-iso-PGF2α比较老年组血浆8-iso-PGF2α水平为(506.38±138.63)ng/L,高于老年对照组(369.98±99.81)ng/L和中青年组(420.18±132.72) ng/L,中青年组与老年对照组差异无统计学意义(F= 9.272,P<0.05)。
2.3 中青年组和老年组NIHSS评分比较中青年组、老年组NIHSS评分分别为(17.73±2.70)、(19.78± 3.66)分,老年组高于中青年组(t=2.539,P<0.05)。
2.4 老年组血浆8-iso-PGF2α水平与临床指标的关系老年组血浆8-iso-PGF2α与NIHSS评分呈正相关(r=0.504,P=0.001),与年龄(r=0.242,P= 0.149)、收缩压(r=-0.012,P=0.942)、舒张压(r= 0.050,P=0.770)、总胆固醇(r=-0.961,P=0.572)、三酰甘油(r=-0.570,P=0.737)均无相关性。
Tab.1 Comparison of basic information between three groups表1 各组一般资料比较(±s)
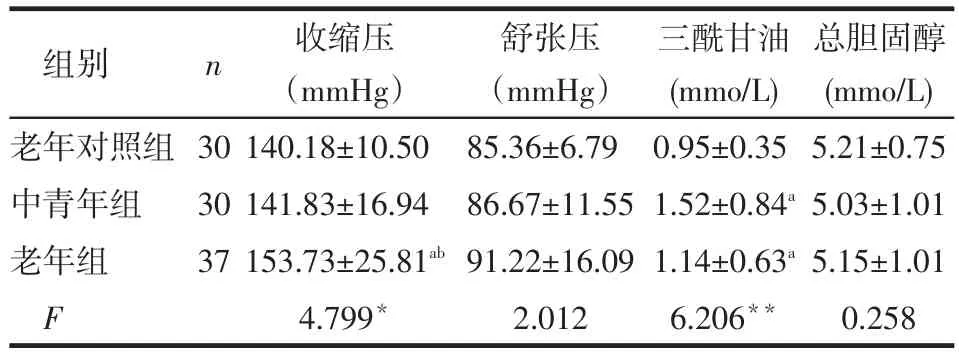
Tab.1 Comparison of basic information between three groups表1 各组一般资料比较(±s)
1 mmHg=0.133 kPa;*P<0.05,**P<0.01;a与老年对照组比较,b与中青年组比较,P<0.05
组别老年对照组中青年组老年组F n 30 30 37收缩压(mmHg)140.18±10.50 141.83±16.94 153.73±25.81ab4.799*舒张压(mmHg)85.36±6.79 86.67±11.55 91.22±16.09 2.012三酰甘油(mmo/L) 0.95±0.35 1.52±0.84a1.14±0.63a6.206**总胆固醇(mmo/L) 5.21±0.75 5.03±1.01 5.15±1.01 0.258
3 讨论
长期以来,氧化应激反应作为脑卒中后神经元损伤级联反应中重要的一环一直备受人们的关注,尤其在急性脑缺血的研究中,氧化应激被认为是细胞损伤的主要机制。脑组织发生梗死后会在缺血周围迅速产生氧化应激反应[4],产生大量的氧自由基,这些氧自由基对内皮细胞具有一定的损害作用,甚至引起凋亡,从而限制了缺血区周围的血管新生,限制了对缺血半暗带的血供[5],同时也会影响到内皮细胞分泌神经营养因子对受损神经元的功能修复。
有研究表明年龄老化是促进缺血的脑组织进展为梗死组织的协变量,年老伴随氧自由基的增加,使得脑组织对缺血耐受性差,从而更容易发生脑梗死[6]。Buga等[7]研究发现,与年轻大鼠相比,脑损伤后老年大鼠缺乏足够的能量应对氧化应激的损害作用。本研究结果显示,老年组血浆8-iso-PGF2α水平高于老年对照组和中青年组,而中青年组与老年对照组无明显差异,提示一方面老年患者细胞能量系统受损和氧自由基大量增加,导致组织对缺血刺激的承受能力下降。另一方面老年患者发生急性脑梗死后,氧化应激反应增强更加明显,脂质过氧化程度明显增高,超过机体抗氧化能力,增高的自由基加重脑的缺血缺氧,从而促进了梗死的发生和发展。
Popa-Wagner等[8]通过建立脑缺血大鼠模型发现20个月龄的大鼠较3个月龄的大鼠出现的神经功能障碍更严重,功能恢复情况也更差。Hermann等[9]研究发现,随年龄增长发生脑梗死的危险性也增加,而且发生脑梗死的群体中,年龄越大梗死症状越严重,残障级别越大。本研究结果显示,老年组NIHSS评分高于中青年组,且其血浆8-iso-PGF2α水平与NIHSS评分呈正相关,这与年老增强的氧化应激导致血液流变学的减弱和脑血流量的减少,进一步引起脑组织氧供应的减少有关[10];提示老年发生脑梗死后,体内自由基产生明显增多,一些抗氧化作用的酶类活性降低,使得氧化应激及脂质过氧化的水平显著增高,由于自由基作用所生成的一些脂质过氧化物本身也具有很强的毒性作用,进一步加重了缺血脑组织的再灌注损伤,从而加重了脑梗死的病情,给患者造成神经功能损伤。
[1]Candelario-Jalil E.Injury and repair mechanisms in ischemic stroke:considerations for the development of novel neurotherapeutics[J].Curr Opin lnvestig Drugs,2009,10(7):644-654.
[2]肖爱娇,陈日新,康明非,等.热敏灸对脑缺血再灌注损伤大鼠SOD、MDA的影响[J].天津医药,2014,42(1):51-53.doi:10.3969/j. issn.0253-9896.2014.01.016.
[3]Morrow JD.Quantification of isoprostanes as indices of oxidant stress and the risk of atherosclerosis in humans[J].Arterioscler Thromb Vasc Biol,2005,25(2):279-286.
[4]Jackson CA,Hutchison A,Dennis MS,et al.Differing risk factor profiles of ischemic stroke subtypes:evidence for a distinct lacunar arteriopathy[J]?Stroke,2010,41(4):624-629.doi:10.1161/STROKE AHA.109.558809.
[5]Domínguez C,Delgado P,Vilches A,et al.Oxidative stress after thrombolysis-induced reperfusion in human stroke[J].Stroke,2010, 41(4):653-660.doi:10.1161/STROKEAHA.109.571935.
[6]Schwamm LH,Ali SF,Reeves MJ,et al.Temporal trends in patient characteristics and treatment with intravenous thrombolysis among acute ischemic stroke patients at get with the guidelines-stroke hospitals[J].Circ Cardiovasc Qual Outcomes,2013,6(5):543-549.
[7]Buga AM,Dunoiu C,Bălşeanu A,et al.Cellular and molecular mechanisms underlying neurorehabilitation after stroke in aged subjects[J].Rom J Morphol Embryol,2008,49(3):279-302.
[8]Popa-Wagner A,Badan I,Walker L,et al.Accelerated infarct development,cytogenesis and apoptosis following transient cerebral ischemia in aged rats[J].Acta Neuropathol,2007,113(3):277-293.
[9]Hermann DM,Chopp M.Promoting brain remodelling and plasticity for stroke recovery:therapeutic promise and potential pitfalls of clinical translation[J].Lancet Neurol,2012,11(4):369-380.doi: 10.1016/S1474-4422(12)70039-X.
[10]Zhang DW,Zhang L,Liu JG,et al.Protective effect of fosinopril sodium pretreatment combined with ischemic postconditioning on rat heart underwent myocardial ischemia/reperfusion injury[J].Zhonghua Xin Xue Guan Bing Za Zhi,2010,38(7):633-637.
(2013-09-01收稿2014-02-24修回)
(本文编辑陈丽洁)
Correlation of Serum 8-iso-PGF2α Level and the Severity of Neurological Deficits in Elderly Patients with Cerebral Infarction
ZHENG Haijian1,XIE Yan2,ZHANG Huamin1,QIN Hua1
1 Department of Geriatrics,Ganyu People’s Hospital,Jiangsu 222100,China;2 Special Requirement Ward,the First Affiliated Hospital of Soochow University
ObjectiveTo investigate the relationship between the level of 8-iso-prostaglandin(8-iso-PG)F2α and the neural functional deficit in patients with acute cerebral infarction(ACI).MethodsSixty-seven ACI patients were selected in Neurological Department of Ganyu People’s Hospital.According to the age,these subjects were divided into two groups:the old group(≥60 years,n=37)and middle-young group(<60 years,n=30).Thirty healthy subjects were selected as controls(≥60 years).The age,gender and anamnesis were matched in two groups of elderly people.The ELISA was used to detect the plasma levels of 8-iso-PGF2α in two groups of patients.And NIHSS score was used to evaluate the severity of clinical neurological deficit.ResultsThe plasma levels of 8-iso-PGF2α were significantly higher in old ACI group (506.38±138.63)ng/L than those of middle-young ACI group(420.18±132.72)ng/L and old control group(369.98±99.81) ng/L.There was no significant difference in plasma level of 8-iso-PGF2α between middle-young ACI group and old control group(F=9.272,P<0.05).The NIHSS score was significantly higher in old group(19.78±3.66)than that of middle-young group(17.73±2.70,t=2.539,P<0.05).There was a positive correlation between plasma 8-iso-PGF2α level and NIHSS score in old group(r=0.504,P=0.001).ConclusionThe oxidative stress plays an important role in the occurrence and development process of ACI in elderly patients.The earlier and reasonable antioxidant therapy plays a positive role to alleviate the clinical symptoms and promote the recovery of illness.
brain infarction;isoprostanes;oxidative stress;8-iso-PGF2α;old age
R743
A
10.3969/j.issn.0253-9896.2014.07.022
连云港市“科教兴卫工程”青年科技项目(Q1214)
1江苏省赣榆县人民医院老干部科(邮编222100);2苏州大学附属第一医院特需病房

