微小RNA-1在缺氧心肌细胞凋亡中的作用
郑君毅 王霁翔 肖健勇 丛洪良
微小RNA-1在缺氧心肌细胞凋亡中的作用
郑君毅 王霁翔 肖健勇 丛洪良△
目的研究微小RNA(miR)-1在缺氧心肌细胞凋亡中的作用。方法将培养的H9C2心肌细胞分为5组,正常对照组、阴性对照组、H2O2组、miR-1组和H2O2+miR-1组。用实时荧光定量PCR方法证实miR-1转染成功后,MTT法和流式细胞术检测细胞存活率和凋亡情况,用PCR和Western Blot的方法检测抗凋亡因子bcl-2的mRNA和蛋白表达情况。结果与正常对照组相比,阴性对照组各个指标的变化差异均无统计学意义。其他3组细胞的miR-1表达水平显著升高,细胞存活率下降,凋亡率增加,Bcl-2的mRNA和蛋白表达水平均明显降低。结论微小RNA-1可通过降低抗凋亡因子Bcl-2的表达水平诱导缺氧心肌细胞的凋亡。
微RNAs;缺氧;肌细胞,心脏;细胞凋亡;miR-1
微小RNA(microRNA,miR)是一类长18~25 nt的小分子单链非编码RNA。它们在生物体内高度保守,具有调节作用,可通过特异性识别靶mRNA的 3′非编码区(3′-UTR),抑制靶mRNA的蛋白表达或者直接降解靶mRNA调节机体蛋白质的水平,人类约30%的基因受到miR的调节[1-2]。miR-1是心肌细胞中含量最高的miR,具有调控心肌细胞分化、维持心脏功能的重要作用[3],并且参与心肌肥厚[4]、心肌梗死和心律失常[5]以及血管病变等病理生理变化过程。心肌缺氧是各种心脏疾病共同的病理损害,可引起心肌细胞氧化应激,导致心肌坏死、炎症、病理改变、左心室功能障碍等。本实验在心肌细胞缺氧模型的基础上,通过转染miR-1 mimic片段,观察miR-1的含量与细胞凋亡的情况,并通过研究抗凋亡基因Bcl-2的mRNA和蛋白水平变化,探讨miR-1在缺氧心肌细胞凋亡中的作用机制。
1 材料与方法
1.1 试剂与仪器H9C2大鼠心肌细胞株购自中科院上海细胞库。Lipofectamine 2000(转染试剂)、Trizol(RNA提取试剂)、M-MLV(逆转录酶)、RNase Inhibitor(RNA酶抑制剂)、实时荧光定量PCR试剂盒均为美国Invitrogen公司产品。DMEM培养基(高糖)、胎牛血清(FBS)和胰蛋白酶均为美国Gibco公司产品。上海吉玛公司设计并合成miR-1 mimic和miRNA阴性对照片段。四甲基偶氮唑蓝(MTT)、一抗bcl-2、β-actin和二抗购自天津联星生物公司。总蛋白提取试剂盒和BCA蛋白定量试剂盒为北京索来宝公司产品。凋亡试剂盒和流式细胞仪为BD公司产品。电泳系统和PCR仪为伯乐公司产品。其余均为国产分析纯。
1.2 细胞培养和分组H9C2大鼠心肌细胞株在高糖DMEM培养基(含10%FBS)中,置于37℃培养箱中,5%CO2条件下湿润培养。将培养好的细胞分为5组。正常对照组:H9C2细胞培养条件不做任何改变;阴性对照组:H9C2细胞转染随机合成的miRNA阴性对照片段;H2O2组:细胞培养液中加入终浓度为0.4 mmol/L的H2O2,持续培养48 h;miR-1组:细胞转染miR-1 mimic片段;H2O2+miR-1组:细胞转染miR-1 mimic片段后,细胞培养液中加入终浓度为0.4 mmol/L的H2O2。于48 h后收集细胞进行各项指标的检测。
1.3 各组细胞中miR-1的水平根据试剂说明书,用Trizol提取细胞总RNA,逆转录合成cDNA后-20℃冰箱保存进行miR-1水平的检测,U6作为内参。miR-1引物上游5′-CGGCGGTGGAATGTAAAGAAGT-3′,下游5′-GTGCAGGGTCCGAGGT-3′;U6引物上游5′-CTCGCTTCGGCAGCACA-3’,下游5′-AACGCTTCACGAATTTGCGT-3′。反应条件为:变性95℃10 min;95℃15 s,60℃30 s,进行40个循环;延伸72℃5 min。根据公式2-△Ct计算得到实验观察值(△Ct=Ct1-Ct2,Ct1:样品待测基因的临界循环数;Ct2:样品内参基因的临界循环数),用以表示起始模板浓度,并以此值进行统计学分析。实验重复3次。
1.4MTT法检测细胞生存率实验结束后,向各组细胞中加入20µL MTT(5 g/L),37℃孵育4 h。轻轻吸净各孔液体,加入150µL DMSO,置于水平摇床上使结晶充分溶解。待结晶完全溶解后,于490 nm波长下测定各孔吸光度(A)值。以正常对照组的细胞生存率为100%,计算各组细胞生存率。细胞生存率(%)=实验组A值/正常对照组A值×100%。实验重复3次。
1.5 流式细胞术检测细胞凋亡48 h后,吸净各组细胞培养液,加入胰酶消化至细胞形态为圆形时,轻轻吹打使细胞脱落,加入DMEM培养液终止消化,1 000 r/min离心10 min,弃掉上清。将细胞沉淀用PBS洗涤2次,并重悬于binding buffer中,调整细胞浓度为1×106/mL。按照凋亡试剂盒说明书,向细胞悬液中加入荧光标记的Annexin V和PI试剂,避光孵育15 min,然后加入binding buffer,1 h之内上机,用流式细胞仪检测各组细胞的凋亡率。实验重复3次。
1.6 各组bcl-2 mRNA表达水平的检测细胞总RNA的提取和逆转录操作同上。目的基因Bcl-2和内参基因β-actin的引物均由北京Invitrogen生物公司合成。bcl-2引物上游5′-GGGAGATCGTGATGAAGTAC-3′,下游5′-GGAA GGAGAAGATGCCAG-3′,扩增产物为120 bp;β-actin引物上游5′-GAACCCTAAGGCCAACCGTG-3′,下游5′-AGGCATACAGGGACAACACAG-3′,扩增产物为105 bp。PCR条件为:95℃预变性5 min;94℃变性15 s,60℃退火45 s,扩增40个循环;72℃延伸5 min。实验重复3次。
1.7 各组bcl-2蛋白表达水平的检测根据说明书,提取各组细胞总蛋白,用BCA蛋白定量试剂盒对总蛋白进行定量。调整蛋白浓度至5 g/L,取8µL总蛋白上样,进行电泳、转膜。转膜完成后将膜放入5%奶粉中封闭2 h,按照1∶500和1∶1 000的比例分别加入一抗bcl-2和β-actin,置于4℃摇床上孵育过夜。然后TBST洗膜3次,加入1∶500的二抗室温孵育2 h。吸净液体,加入1 mL发光液,于成像系统中进行扫描。bcl-2蛋白条带与内参β-actin蛋白条带灰度值的比值表示样本中bcl-2蛋白的相对表达量,实验重复3次。
1.8 统计学方法应用SPSS 11.5录入数据并进行统计学分析,用Kolmogorov-Smirnov法检验数据的正态分布情况,如符合则采用单因素方差分析(One-way ANOVA),组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞中miR-1的水平正常对照组和阴性对照组miR-1基因表达水平差异无统计学意义,其他3组miR-1基因的表达水平均高于正常对照组(P<0.05),见表1。
Tab.1 Comparison of data between five groups表1 各组细胞检测指标结果比较(n=3,±s)

Tab.1 Comparison of data between five groups表1 各组细胞检测指标结果比较(n=3,±s)
**P<0.01;a与正常对照组比较,P<0.05
组别正常对照组阴性对照组H2O2组miR-1组H2O2+miR-1组F miR-1 0.66±0.14 0.71±0.16 2.34±0.74a3.46±1.28a4.53±1.31a10.969**细胞生存率(%)100.00±8.61 97.87±10.21 52.82±9.98a45.69±8.13a35.28±8.53a66.568**细胞凋亡率(%)3.13±0.45 3.33±0.70 12.03±1.15a15.70±2.82a28.60±0.60a160.552**组别正常对照组阴性对照组H2O2组miR-1组H2O2+miR-1组F bcl-2 mRNA 2.38±0.13 2.39±0.15 1.82±0.11a1.45±0.08a0.94±0.24a50.254**蛋白0.95±0.05 0.94±0.11 0.68±0.12a0.50±0.10a0.28±0.10a26.208**
2.2MTT法检测各组细胞生存率阴性对照组细胞生存率与正常对照组相比,差异无统计学意义(P>0.05)。细胞培养液中加入H2O248 h后,细胞生存率较正常对照组下降(P<0.01),转染miR-1 mimic片段或转染miR-1 mimic片段后加入H2O2使细胞的生存率进一步降低(P<0.01),见表1。
2.3 流式细胞术检测各组细胞凋亡率阴性对照组细胞凋亡率与正常对照组相比,差异无统计学意义(P>0.05)。其他3组细胞凋亡明显,H2O2+miR-1组细胞凋亡率最高,见表1、图1。
2.4 各组bcl-2 mRNA和蛋白的表达正常对照组和阴性对照组抗凋亡基因bcl-2的mRNA和蛋白表达差异均无统计学意义(P>0.05),其他3组bcl-2的mRNA和蛋白表达水平明显降低(P<0.05),见表1、图2。
3 讨论
近年来,miRNA在心血管疾病中的调控作用已成为研究的热点,尤其在心肌缺血性损伤中,已有大量文献报道miRNA在其中发挥着关键的作用。Dong等[6]发现,冠脉闭塞6 h后,与非缺血区域相比,缺血区域38个miRNA发生了改变,其中21个上调17个下调;缺血边缘区域33个miRNA发生了改变,其中19个上调14个下调。Roy等[7]研究了C57BL/6小鼠的缺血再灌注模型中microRNA表达谱的变化,发现再灌注2 d后,13个miRNA发生了上调,而再灌注7 d后,9个miRNA发生了上调,但是两个时间点都是6个miRNA发生了下调。这不仅说明miRNA参与了心血管疾病的病理生理过程,而且不同的心脏疾病miRNA表达谱的变化是不同的。

Fig.1 The apoptotic rate of cells in five groups图1 流式细胞术检测各组细胞凋亡率
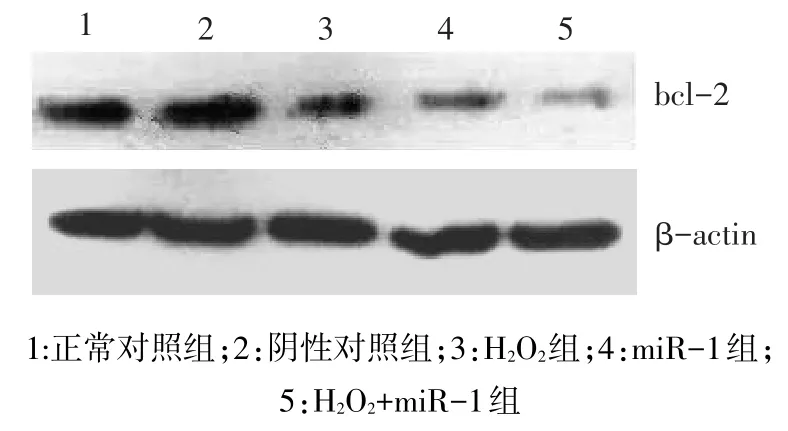
Fig.2 Results of bcl-2 protein levels detected by Western blot assay图2 Western Blot检测不同组bcl-2蛋白表达水平
在这些变化的miRNA中,miR-1被认为最具有心肌特异性,但对于其作用机制仍不清楚,甚至出现了相反的研究结果。Xu等[8]通过转染技术将体外合成的miR-1 mimic导入心肌细胞,发现高表达miR-1的心肌细胞Caspase3活性升高、出现明显的细胞凋亡。进一步研究发现,miR-1可以降低热休克蛋白60/70的蛋白表达水平(此两者为心肌细胞重要的抗凋亡因子),从而诱导心肌细胞的凋亡。
细胞凋亡主要涉及两条信号通路,一条是死亡受体通路;一条是线粒体信号通路,即线粒体在细胞凋亡中处于枢纽地位,各种凋亡刺激信号引起线粒体肿胀、膜流动性降低、通透性增加,从而释放细胞色素C(cytC)等凋亡诱导因子,启动Caspase蛋白酶级联反应,引起细胞凋亡。bcl-2家族是线粒体凋亡途径中最重要的一组凋亡基因,其中bcl-2是这个家族中最重要的抗凋亡基因,通过抑制细胞死亡调控细胞的发生和发展。本研究用microRNA靶基因预测软件targetscan和miRBase预测到bcl-2为miR-1作用的一个靶基因。为了进一步研究miR-1在缺血心肌细胞凋亡中的作用,笔者根据文献[9]用H2O2诱导心肌细胞缺氧模型的建立,并将体外合成的miR-1 mimic转染入心肌细胞,通过研究缺氧心肌细胞中miR-1与bcl-2的变化关系,探讨microRNA-1在心肌细胞凋亡的作用。结果显示,缺氧组细胞miR-1的表达水平升高、细胞凋亡明显、bcl-2的mRNA和蛋白水平均降低,说明miR-1不仅参与了细胞凋亡过程,而且具有促凋亡的作用。单纯转染miR-1 mimic组也出现了缺氧组细胞的凋亡现象,说明无论是什么原因引起的miR-1水平升高都会引起细胞的凋亡。同时,细胞内转染的miR-1 mimic还可以进一步加重缺氧心肌细胞的凋亡。本研究证实,miR-1在缺氧心肌细胞凋亡中具有重要的作用,bcl-2只是其作用机制之一,为全面了解miR-1的作用机制奠定了基础。
[1]Cannell IG,Kong YW,Bushell M.How do microRNAs regulate gene expression[J]?Biochem Soc Trans,2008,36(Pt6):1224-1231.doi:10.1042/BST0361224.
[2]文通,魏云峰,王梦洪,等.microRNA-1诱导大鼠骨髓间充质干细胞向心肌样细胞分化[J].基础医学与临床,2011,31(1):41-46.
[3]Zhao Y,Ransom JF,Li A,et al.Dysregulation of cardiogenesis,cardiac conduction,and cell cycle in mice lacking miRNA-1-2[J]. Cell,2007,129(2):303-317.doi:10.1016/j.cell.2007.03.030.
[4]Li Q,Song XW,Zou J,et al.Attenuation of microRNA-1 derepresses the cytoskeleton regulatory protein twinfilin-1 to provoke cardiac hypertrophy[J].J Cell Sci,2010,123(14):2444-2452.doi: 10.1242/jcs.067165.
[5]Yang BF,Lin HX,Xiao JN,et al.The muscle-specific microRNA miR-1 regulates cardiac arrhythmogenic potential by targeting GJA1 and KCNJ2[J].Nat Med,2007,13(4):486-491.doi:10.1038/ nm1569.
[6]Dong S,Cheng Y,Yang J,et al.MicroRNA expression signature and the role of microRNA-21 in the early phase of acute myocardial infarction[J].J Biol Chem,2009,284(43):29514-29525.doi:10.1074/ jbc.M109.027896.
[7]Roy S,Khanna S,Hussain SR,et al.MicroRNA expression in response to murine myocardial infarction:miR-21 regulates fibroblast metalloprotease-2 via phosphatase and tensin homologue[J]. Cardiovasc Res,2009,82(1):21-29.doi:10.1093/cvr/cvp015.
[8]Xu CQ,Lu YJ,Pan ZW,et al.The muscle-specific microRNAs miR-1 and miR-133 produce opposing effects on apoptosis by targeting HSP60,HSP70 and caspase-9 in cardiomyocytes[J].J Cell Sci,2007, 120(Pt 17):3045-3052.doi:10.1242/jcs.098830.
[9]Glass C,Singla DK.ES cells overexpressing microRNA-1 attenuate apoptosis in the injured myocardium[J].Mol Cell Biochem,2011, 357(1-2):135-141.doi:10.1007/s11010-011-0883-5.
(2013-08-26收稿2014-02-28修回)
(本文编辑魏杰)
Apoptotic Effects of MicroRNA-1 on Hypoxemic Cardiomyocytes
ZHENG Junyi,WANG Jixiang,XIAO Jianyong,CONG Hongliang Tianjin Chest Hospital,Tianjin 300222,China
CONG Hongliang,E-mail:hongliangcong@163.com
ObjectiveTo investigate the apoptotic effect of microRNA-1(miR-1)on hypoxemic cardiomyocytes.MethodsThe cultured H9C2 cells were divided into 5 groups:normal control group,negative control group,H2O2group, miR-1 group and H2O2+miR-1 group.After verified the success of transfection by real time PCR,MTT and flow cytometry methods were used to test the cell vitality and apoptotic rate,while the mRNA and protein expression level of Bcl-2 were detected by real time PCR and Western blot methods.ResultsCompared with normal control group,there were no significant differences in all indexes in negative control group.The application of H2O2and miR-1 respectively or together significantly increased the miR-1 level and apoptotic rate,and reduced the cell vitality and Bcl-2 expression level.ConclusionmicroRNA-1 can induce cardiomyocyte apoptosis by downregulating anti-apoptosis factor Bcl-2.
microRNAs;anoxia;myocytes,cardiac;apoptosis;miR-1
R542.2
A
10.3969/j.issn.0253-9896.2014.07.005
天津市胸科医院心内科(邮编300222)△
E-mail:hongliangcong@163.com

