S.suis 2溶血素SLY的分子克隆及溶血活性和免疫学特性研究
孙 雯,潘秀珍
(1.扬州市职业大学医学院,江苏扬州225000;2.南京军区军事医学研究所,江苏南京210002)
S.suis 2溶血素SLY的分子克隆及溶血活性和免疫学特性研究
孙 雯1,潘秀珍2*
(1.扬州市职业大学医学院,江苏扬州225000;2.南京军区军事医学研究所,江苏南京210002)
目的 克隆并表达猪链球菌2型(S.suis 2)溶血素重组蛋白SLY,对其溶血活性及免疫学特性进行研究,为探讨SLY在S.suis 2感染中的致病机理及筛选有效的疫苗预防和控制猪链球菌病奠定基础。方法 对S.suis 2 05ZYH33全基因序列进行生物信息学分析,构建p ET32a-sly原核表达质粒并诱导表达出S.suis 2重组溶血素SLY蛋白;采用高浓度尿素裂解包涵体和His-Tag亲和层析对重组SLY蛋白进行纯化并复性;免疫保护实验检验SLY的免疫保护作用。结果 SDS-PAGE显示70 kD的SLY蛋白条带;重组SLY蛋白具有溶血活性并受多种因素的影响;SLY对感染S.suis 2的Balb/c小鼠有一定的免疫保护作用。结论 优化原核表达体系可以有效提高SLY蛋白的表达量,经提纯并复性的重组SLY具有较高的溶血价,为进一步纯化及分析SLY蛋白的特性提供了必要的前提。
猪链球菌2型(S.suis 2);溶血素SLY;包涵体;溶血活性
猪链球菌(Streptococcus suis,S.suis)是人兽共患病的病原菌,有35个血清型。迄今,猪链球菌2型(S.suis 2)先后在20多个国家及地区引起多起人感染猪链球菌的恶性事件,被认为毒力最强,主要引起的疾病包括败血症、脑膜炎以及突发性死亡等[1]。在中国,1998年江苏省和2005年的四川省曾暴发了大规模的人感染S.suis 2公共卫生事件,患者出现了极其罕见的中毒性休克综合征(STSS)。此后,人感染S.suis 2的散发疫情时有发生,近年呈现明显上升趋势,引起了公共卫生领域的广泛关注[2-3]。
目前,关于S.suis 2致病的具体机制知之甚少,主要集中在毒力因子的研究,例如溶血素(SLY)、荚膜多糖(CPS)、溶菌酶释放蛋白(MRP)及胞外因子(EF)等。当前,研究者[1]普遍认为溶血素SLY是S. suis 2的一个重要毒力相关因子。研究的初步结果显示,引起我国STSS疫情的S.suis 2的强毒株05ZYH33在体外条件下表现出高的溶血活性。溶血素(SLY)作为S.suis 2的一种分泌性蛋白质,能够分泌于细菌的培养上清中,引起人喉癌上皮细胞(HEp-2)的裂解,SLY抗体可抑制这种作用。研究[4]还发现SLY阳性的S.suis 2菌株能黏附脑微细血管内皮细胞、巨噬细胞及上皮细胞,并导致所黏附细胞的裂解。相反,不产生SLY的S.suis 2突变株则丧失了溶血性以及对小鼠的毒力[5],这表明SLY在S.suis 2侵袭和裂解细胞的过程中发挥着关键的作用。因此,对于SLY与S.suis 2致病性之间关系的深入探讨,既有助于进一步了解S.suis 2的致病机制,同时对于开发有效的S.suis 2免疫学检测方法、筛选更有效的疫苗也奠定了基础。
鉴于S.suis 2细菌培养上清中的SLY蛋白含量低且提纯困难,我们构建了中国强毒株S.suis 2 05ZYH33 SLY蛋白的基因工程菌,通过分子克隆和蛋白表达获得纯度高且具有生物学活性的SLY融合蛋白,进一步对SLY进行了溶血活性的检测和免疫学特性的分析与研究,为深入探讨SLY在S.suis 2感染过程中的致病机理及筛选有效的疫苗来预防和控制猪链球菌病提供参考。
1 材料和方法
1.1 材料
菌株S.suis 2 05ZYH33(分离自四川省资阳市的中毒性休克综合征患者);质粒p ET32a及其宿主菌E.coli DH5α、E.coli BL21(实验室保存);质粒p MD-18T、DNA胶回收试剂盒、PCR扩增试剂盒、限制性内切酶Sal I和Bam H I、T4连接酶(日本Ta KaRa公司产品);DNA Marker和蛋白Marker (深圳晶美生物工程有限公司产品);SPF级Balb/c小鼠(购自北京)。
1.2 方法
1.2.1 分子克隆溶血素基因 利用BLAST和Clustal W程序筛选实验室保存的S.suis 2 05ZYH33菌株全基因组序列中可能存在的溶血素编码序列(sly),设计引物,进行PCR扩增。5′端引物的序列:5’-CAC GGATCCATGAGAAAAAGT TCGCAC-3’,画线部分为限制性内切酶Bam H I酶切位点;3′端引物的序列:5’-CG GTCGAC TTACTCTATCACCTCATCCGCA-3’,画线部分为限制性内切酶Sal I酶切位点。引物由上海基康生物公司合成。PCR程序反应体系:95℃,5 min; 95℃,40 s;56℃,1 min;72℃,1 min;共30个循环,最后72℃延伸10 min。
1.2.2 构建重组质粒p MD-18T-sly PCR产物经10 g/L琼脂糖凝胶电泳后回收目的片段,将片段克隆于p MD-18T载体中,转化至感受态E.coli DH5α细菌。通过限制性内切酶Bam H I和Sal I双酶切筛选并鉴定阳性转化子,送往上海英骏生物技术有限公司进行DNA序列测定,并验证其阅读框。双酶切体系为:10×T Buffer 1.5μL,p MD-18T-sly质粒2μL,Bam H I 0.5μL,Sal I 0.5μL,dd H2O 5.5μL,37℃水浴6 h。
1.2.3 构建重组表达质粒p ET32-sly 质粒p MD-18T-sly和p ET32a载体经Bam H I、Sal I双酶切的产物用胶回收试剂盒回收后,经T4 DNA ligase连接后克隆至感受态E.coli BL21细菌,构建重组原核表达载体p ET32-sly。菌液经PCR检测为阳性者进行质粒提取,酶切,10 g/L琼脂糖凝胶电泳鉴定。
1.2.4 优化重组蛋白表达的时间 重组菌在37℃下分别诱导2、3、4、5 h,超声波裂解,12 000 r/min离心10 min,用120 g/L SDS-PAGE电泳鉴定诱导的效果,选取最佳诱导时间。
1.2.5 分析重组蛋白的可溶性 重组菌在37℃下培养3 h后,OD达0.6,此时加入终浓度为1 mmol/L的IPTG进行诱导至最佳诱导时间,进行超声波裂解,12 000 r/min离心10 min,分别取裂解上清液和沉淀,用120 g/L SDS-PAGE电泳对重组蛋白进行定位分析。
1.2.6 优化重组蛋白表达的培养温度 选取28℃和37℃对重组菌进行诱导培养,诱导至最佳诱导时间,分别取沉淀、上清进行120 g/L SDS-PAGE电泳鉴定诱导的效果,比较在28℃和37℃温度下蛋白的表达量,从而选取最佳的诱导温度。
1.2.7 纯化和复性重组蛋白 洗涤包涵体:收集重组菌液,缓冲液Buffer A(20 mmol/L p H 7.5的Tris HCl,10 mmol/L Triton X-100,10 mmol/L EDTA)重悬,超声波裂解30 min后10 000 g离心20 min,收集包涵体,用上述缓冲液洗2次。溶解包涵体:以每克包涵体加入5 m L缓冲液Buffer B (8 mol/L尿素,0.01 mol/L Tris HCl,0.1 mol/L Na H2PO4,p H 8.0),再加入终浓度体积分数为0.1%的β-巯基乙醇,4℃下裂解过夜。纯化重组蛋白:包涵体裂解液经0.22μm滤膜过滤后与1 m L Ni2NTA His Bind Resins置摇床培养1 h,装入空层析柱中,用缓冲液B平衡层析柱,然后用缓冲液C (8 mol/L尿素,10 mmol/L Tris-Hcl,100 mmol/L Na H2PO4·2H2O,p H 6.3)洗脱非特异性结合在柱子上的蛋白质,最后用缓冲液D(8 mol/L尿素, 10 mmol/L Tris Hcl,100 mmol/L Na H2PO4· 2H2O,p H 4.5)洗脱吸附在柱子上的融合蛋白,采用120 g/L SDS-PAGE电泳对不同收集管中洗脱的目的蛋白含量进行分析。复性重组蛋白:用300 m L复性液A(2 mol/L尿素,1 mmol/L还原型谷胱甘肽,20 mmol/L Tris HCl,0.2 mmol/L氧化型谷胱甘肽,p H 8.0)4℃下透析12 h,期间换液2次,之后用300 m L复性液B(0.5 mol/L尿素,1 mmol/L还原型谷胱甘肽,20 mmol/L Tris HCl,0.2 mmol/L氧化型谷胱甘肽)继续透析12 h,期间换液2次,再用10 mmol/L Tris HCl(p H 8.0)300 m L透析3 h以上,最后用去离子水继续透析3 h以上。
1.2.8 鉴定重组蛋白的溶血活性 测定溶血价:在96孔细胞培养板中加入2%人红细胞(150μL/孔),再加入等体积的复性重组蛋白(经生理盐水倍比稀释),置37℃下作用2 h,100 g离心2 min后取上清液,分光光度计540 nm下测定其吸光值,以红细胞与等体积生理盐水共同孵育的孔作为阴性对照;能够导致50%红细胞溶解的待测样品的最高稀释倍数即为重组蛋白SLY所含的溶血单位数(即SLY的溶血价)。热敏感性实验:将-20℃保存的重组蛋白SLY分别置4℃、37℃、65℃温度下处理20 min后,对溶血价进行测定。活化和抑制实验:在适当稀释的重组蛋白SLY中分别加入二硫苏糖醇(DTT)、氧化剂过氧化氢、β-巯基乙醇、抑制剂蛋白酶K,使之终浓度分别为5 mmol/L、体积分数0.1%、体积分数0.1%、100 mg/L,置室温20 min,测定溶血价。活性保存实验:分别经抑制剂蛋白酶K、65℃及氧化剂过氧化氢处理后的重组蛋白SLY蛋白样品另加入体积分数为2%β-巯基乙醇作用20 min,测溶血价。
1.2.9 动物保护实验 将4周龄的20只Balb/c小鼠,分为实验组和对照组,每组各10只。在接种S. suis 2 05ZHH33菌株之前,实验组小鼠先进行SLY蛋白免疫。具体步骤为每只小鼠皮下注射用福氏完全佐剂乳化的25 mg/L SLY蛋白100μL;两周后,每只小鼠皮下注射用福氏不完全佐剂乳化的25 mg/L SLY蛋白100μL;一周后,每只小鼠皮下注射用福氏不完全佐剂乳化的25 mg/L SLY蛋白100μL。实验组小鼠进行SLY蛋白免疫期间,对照组小鼠则同步注射PBS。一周后,空白组和实验组小鼠均腹腔注射1×108CFU/m L S.suis 2 05ZYH33各1 m L。
2 结果
2.1 构建并鉴定重组质粒p MD-18T-sly和p ET32a-sly
构建重组质粒p MD-18T-sly,将目的片段sly连接到表达载体pET32a中。重组表达载体pET32a-sly经Bam H I、Sal I双酶切后,经10 g/L琼脂糖电泳显示S.suis 2中sly片段全长约为1 500 bp,与预期长度一致。DNA序列测定显示该sly片段长度为1 491 bp,共编码497个氨基酸。见图1。
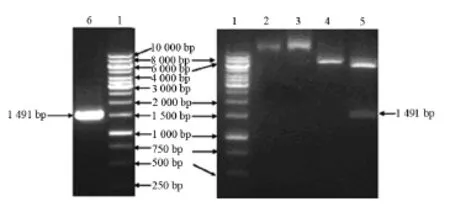
图1 重组质粒p ET32a-sly双酶切鉴定1:1 000 bp DNA marker;2、3:质粒p ET32a-sly; 4:Bam H I单酶切;5:Bam H I、Sal I双酶切;6:PCR。
2.2 IPTG诱导培养时间对SLY表达的影响
为比较不同诱导时间下SLY表达量的区别,在37℃下分别用IPTG对重组菌诱导2、3、4、5 h,取诱导产物进行120 g/L SDS-PAGE鉴定分析。结果显示,IPTG诱导培养达4 h时重组菌中SLY表达量最高。见图2。
2.3 分析重组蛋白的可溶性
重组菌在37℃下培养至最佳诱导时间4 h,超声波裂解诱导物,经离心后获取裂解上清液及沉淀,120 g/L SDS-PAGE电泳鉴定分析,发现表达产物主 要存在于包涵体中。见图3。
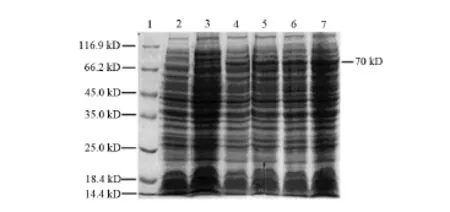
图2 不同诱导时间表达产物的SDS-PAGE结果1:蛋白Marker;2:p ET32a-sly/BL21; 3:未诱导重组菌裂解蛋白; 4~7:分别诱导2、3、4、5 h的表达产物。
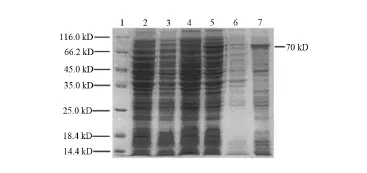
图3 超声波裂解蛋白的SDS-PAGE1:蛋白质marker;2:BL21全菌裂解蛋白;3:p ET32a-sly/BL21; 4:未诱导重组菌裂解蛋白;5:诱导4 h的表达产物; 6:重组菌超声破碎裂解上清蛋白;7:裂解沉淀(包涵体蛋白)。
2.4 不同培养温度对SLY表达的影响
为进一步比较不同培养温度对SLY表达的影响,重组菌分别采用28℃和37℃的培养温度培养至最佳诱导时间4 h,比较重组菌SLY表达量的不同。120 g/L SDS-PAGE结果显示,在28℃和37℃不同培养温度条件下,可溶性SLY表达量均较低,主要以包涵体的形式存在,以37℃包涵体蛋白量较高。见图4。
2.5 提纯重组蛋白
对以包涵体形式存在的重组蛋白SLY提纯并复性,经120 g/L SDS-PAGE电泳后显示获得了唯一条带的纯化蛋白。见图5。
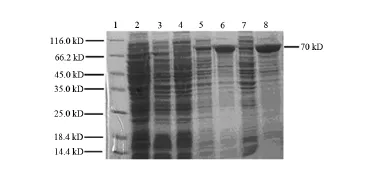
图4 温度对SLY蛋白表达的影响1:蛋白质marker;2:BL21全菌裂解蛋白; 3:p ET32a;4:未诱导重组菌裂解蛋白; 5:28℃诱导4 h的上清;6:28℃诱导4 h的包涵体; 7:37℃诱导4 h的上清;8:37℃诱导4 h的包涵体。
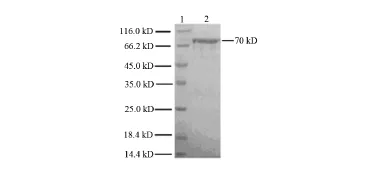
图5 纯化的包涵体的SDS-PAGE1:蛋白标记;2:重组蛋白SLY包涵体在SDS-PAGE上的条带。
2.6 重组蛋白的溶血活性
2.6.1 测定溶血价 测定SLY溶血价为210,随着蛋白稀释度的增大,溶血活力呈现逐步下降的趋势。说明重组蛋白SLY具有明显的裂解红细胞的能力。2.6.2 热敏感和活性不可逆恢复 培养的温度对重组SLY的溶血价有显著的影响,表现为37℃时溶血价最高;65℃处理20 min,溶血价则显著的降低; 65℃处理后即使加入β-巯基乙醇或DTT室温作用30 min,仍没有显示活性。见图6。
2.6.3 活性的丢失与可逆恢复 SLY在氧化物过氧化氢和抑制剂蛋白酶K的 作用下,溶血价明显的下降;加入β-巯基乙醇或DTT室温作用30min后,丢失的活性可基本恢复。见图6。
2.7 动物保护实验
注射SLY的Balb/c小鼠作为实验组,注射PBS的Balb/c小鼠作为对照组。给2组小鼠注射相同剂量的S.suis 2 05ZYH33细菌,监控48 h,对死亡的小鼠数量进行记数。在接种1×108CFU/m L S.suis 2 05ZYH33菌株第2天,对照组10只小鼠全部死亡,实验组小鼠状态良好。实验结果显示,SLY对感染S.suis 2的Balb/c小鼠有一定的免疫保护作用。见图7。
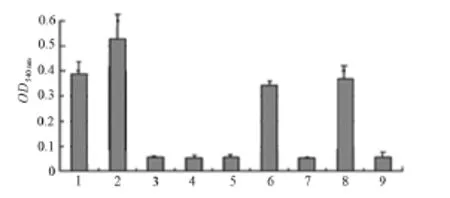
图6 溶血活性实验1:4℃处理;2:37℃处理;3:65℃处理; 4:65℃处理后加β-巯基乙醇;5:双氧水处理; 6:双氧水处理后加β-巯基乙醇;7:蛋白酶K处理; 8:蛋白酶K处理后加β-巯基乙醇;9:空白对照。
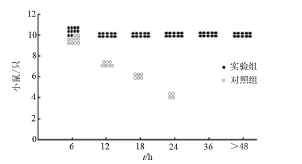
图7 SLY免疫保护实验
3 讨论
溶血素是细菌中十分常见的毒力因子,如A群链球菌的O溶血素、嗜水气单胞菌的HEC毒素以及单核细胞李氏杆菌的溶血素[6]。近几年,美国、新西兰和加拿大等多个研究小组对S.suis 2 SLY进行了深入的研究。溶血素SLY分泌于上清中,属于硫醇激活的穿毒素家族,同时是一种胆固醇结合类细胞毒素[7],有利于其攻击膜上具有胆固醇的真核细胞。实验[8-9]证明,S.suis 2的SLY对人红细胞最为敏感,SLY阳性菌株上清及纯化的SLY均具有细胞毒性作用,经游离的胆固醇预处理抑制其毒性作用,进一步在细胞水平证明了SLY在致病过程中发挥的重要作用。猪链球菌的SLY能增强细菌接触上皮细胞和内皮细胞的能力,同时刺激机体产生免疫反应,如刺激人内皮细胞产生IL-6、IL-8和MCP-1等细胞因子,它们可调整血脑屏障的完整性和通透性以利于猪链球菌在血液中传播和穿过血脑屏障[10]。应用S.suis 2江苏分离株HA9801所产生的SLY进行实验,不仅能引致Vero细胞发生病变,还能致死豚鼠[11]。这些研究结果均表明SLY在致病的过程中扮演着重要的角色。
我们的研究从S.suis 2中国强毒株05ZYH33中克隆sly基因进行原核表达,并通过亲和层析纯化获得重组蛋白。研究表明,温度对SLY表达量的高低有重要影响,较高诱导温度常常会使一些蛋白累积形成包涵体,并且由于表达的SLY有毒性,高温诱导时往往会导致表达菌停止生长甚至死亡。但考虑到37℃诱导温度下包涵体蛋白量较低温诱导下可溶性蛋白量甚多且纯度较高,所以实验选用37℃作为诱导温度。同时发现,IPTG诱导蛋白表达的最适宜时间为4 h,诱导时间过长和过短都会影响蛋白的积累量。通过优化原核表达体系可以有效提高SLY蛋白的表达量,这为进一步研究SLY蛋白的特性提供了必要的前提条件。通过检测SLY的活性,发现经提纯并复性的重组SLY具有较高的溶血价,进一步发现SLY蛋白在高温作用下极易失活,并且是不可逆的,氧化剂和蛋白酶K可完全抑制其活性,但只是一种可逆失活,加入还原剂,活性可恢复,这为纯化该毒素提供了技术手段。免疫保护实验显示,SLY对感染S.suis 2的Balb/c小鼠有一定的免疫保护作用,SLY有可能作为猪链球菌疫苗的候选分子。
SLY在S.suis 2侵袭宿主的过程中如何发挥重要的角色及如何引起宿主细胞病变的问题将有待进一步探讨。我们的研究结果,为进一步探索S.suis 2在感染宿主过程中的致病机理、建立快速可靠的免疫学检测方法及开发有效预防猪链球菌病的疫苗提供了思路,对于本病的早期诊断、流行病学监测、预警和疾病防控具有重要的意义。
[1]Lun S,Willson P J.Putative mannose-specific phosphotransferase system component IID represses expression of suilysin in serotype 2 Streptococcus suis[J].Veteri Microb,2005,105(3/4):169-180.
[2]Tang J,Wang C,Feng Y,et al.Streptococcal toxic shock syndrome caused by streptococcus suis serotype 2[J]. PLoS Med,2006,3(5):151.
[3]Chen C,Tang J,Dong W,et al.A glimpse of streptococcal toxic shock syndrome from comparative genomics of S.suis 2 Chinese Isolates[J].PLoS ONE,2007,2(3): 315.
[4]Martinez G,Harel J,Lacouture S.Cloning and partial characterization of the gene encoding the putative elongation factor Ts of Streptococcus suis serotype 2[J].Arch Microbiol,2003,180(4):298-302.
[5]Allen A,Bolitho S,Lindsay H,et al.Generation and characterization of a defined mutant of Streptococcus suislacking suilysin[J].Infect Immun,2001,69:(4):2 732-2 735.
[6]雷祚荣.细菌毒素分子生物学[M].北京:中国科学技术出版社,1993:179-188.
[7]Lun S,Perez-Casal J,Connor W,et al.Role of suilysin in pathogenesis of Streptococcus suis capsular serotype 2[J]. Microb Pathog,2003,34(1):27-37.
[8]Gottschalk M G,Lacouture S,Dubreuil J D.Characterization of Streptococcus suis capsular type 2 haemolsin [J].Microbiology,1995,141(1):189-195.
[9]Segura M,Gottschalk M.Streptococcus suis interactions with the murine macrophage cell line J774:adhesion and cytotoxicity[J].Infect Immun,2002,70(8):4 312-4 322.
[10]Norton P M,Rolph C,Ward P N,et al.Epithelial invasion and cell lysis by virulent strains of Streptococcus suis is enhances by the presence of suilysin[J].FEMS Immunol Med Microbiol,1999,26(1):25-35.
[11]唐泰山,郭爱珍,陆承平.细菌DNA可显著增强豚鼠接种猪链球菌溶血素的免疫效果[J].中国免疫学杂志, 2004,20(7):477-479.
[责任编辑 姬 荷]
Molecular Cloning,Hemolytic activity,and Immunological characterization of Suilysin from S.suis 2
SUN Wen1,PAN Xiuzhen2*
(1.Medical College of Yangzhou Vocational University,Yangzhou,Jiangsu 225127 China;2.Institute of Military Medical Sciences,Nanjing Command,Nanjing Jiangsu 210002,China)
Objective To understand Streptococcus suis serotype 2(S.suis 2)suilysin(SLY)display which function in the severe infection of S.suis 2 and identify vaccine candidates,molecular cloned and analyzed hemolytic activity and immunological characterization of SLY.Methods Bioinformatics was adopted to analyze the whole genome sequence of the Chinese strain 05ZYH33 of S.suis 2.A recombinant plasmid p ET32a-sly carrying sly gene was developed and transformed into prokaryotic expression host BL21(DE3)strain.Using chelating chromatography to purify SLY.Immunity test was used to test the immune protective effect of SLY.Results Protein expression analysis showed that a 70 k D protein can be observed in SDS-PAGE.After being purified by chelating chromatography,SLY showed clear hemolytic activity and affected by many factors.In an animal model system,we demonstrated that the mice immunized with SLY become to be protected against lethal doses of bacteria.Conclusion Successfully constructed prokaryotic expression system,SLY showed clear hemolytic activity which would be useful for future research on function of SLY.Animal model system means the successful application of proteomics may as a technique for identifying vaccine candidates.
Streptococcus suis 2(S.suis 2,SS2);Suilysin(SLY);inclusion body;hemolytic activity
R392.1
A
1672-7606(2014)03-0179-06
2014-04-30
国家自然科学基金项目(30670105、30600533);国家863项目(2006AA0Z455)。
孙雯(1983—),女,江苏扬州人,讲师,从事微生物学及免疫学的教学与科研工作。
*通讯作者:潘秀珍(1963—),女,江苏南京人,研究员,硕士生导师,从事流行病学的科研工作。

