4期神经母细胞瘤手术切除范围对预后的影响
李鹏飞 刘均澄 甄子俊 刘卓炜 高远红 朱 佳 王 娟路素英 孙斐斐 张 飞 蔡瑞卿 郭晓芳 孙晓非
·临床研究与应用·
4期神经母细胞瘤手术切除范围对预后的影响
李鹏飞①刘均澄②甄子俊①刘卓炜①高远红①朱 佳①王 娟①路素英①孙斐斐①张 飞①蔡瑞卿①郭晓芳①孙晓非①
目的:探讨4期神经母细胞瘤(neuroblstoma,NB)原发肿瘤手术切除程度与生存率的关系,分析不同手术切除程度对预后的影响。方法:回顾分析2000年1月至2011年12月中山大学肿瘤防治中心收治的96例4期NB患者临床资料。根据原发灶手术切除程度将患者分为:A组:未手术或仅活检或手术切除<50%的原发肿瘤;B组:手术切除50%~90%的原发肿瘤;C组:手术切除>90%的原发肿瘤;D组:手术肉眼完全切除原发肿瘤。结果:96例4期NB患者,3年PFS和OS分别为32.8%和36.7%。A组24例,B组10例,C组23例,D组39例。A组和B组间PFS比较差异无统计学意义(P=0.352),C组和D组间PFS比较差异无统计学意义(P=0.792)。但C组+D组生存率高于A组+B组,3年PFS分别为42.2%和17.8%(P<0.001)。结论:4期NB原发肿瘤90%以上完全切除联合化疗和(或)放疗可提高生存率,少量肉眼残留或镜下残留并不影响生存率。
神经母细胞瘤 4期 手术 生存率 切除率
神经母细胞瘤(neuroblstoma,NB)是儿童最常见的颅外实体肿瘤,常起源于肾上腺髓质及交感神经系统[1]。神经母细胞瘤恶性程度高,起病隐匿,易早期发生转移,70%以上患者出现症状时已发生转移,死亡率高[2]。目前4期神经母细胞瘤治疗主要包括化疗、手术切除原发肿瘤、放疗及免疫治疗等[3]。手术是神经母细胞瘤重要的治疗手段,手术切除原发灶对预后意义重大[4]。但由于神经母细胞瘤原发灶大多位于后腹膜,包绕血管神经,手术难以完全切除,临床上不少医生仅是采用部分切除或者90%以上切除。有研究认为神经母细胞瘤化疗敏感,尽管肿瘤已转移,但化疗可以控制转移灶,缩小原发病灶,手术完全切除原发肿瘤有助于提高其生存率[5-7]。有研究认为4期神经母细胞瘤肿瘤已经广泛转移,手术完全切除原发肿瘤并不能进一步提高4期神经母细胞瘤生存率,原发灶切除意义不大[8-9]。原发灶部分切除、90%切除和完全切除对转移性神经母细胞瘤生存率是否有影响至今仍有争论[5-10]。本研究对中山大学肿瘤防治中心治疗的4期神经母细胞瘤患者进行回顾性分析,探讨手术切除原发肿瘤程度对预后的影响。
1 材料与方法
1.1 材料
1.1.1 病例资料 收集自2000年1月至2011年12月中山大学肿瘤防治中心收治的神经母细胞瘤患者96例。入选标准:1)组织病理学确诊为神经母细胞瘤;2)临床诊断神经母细胞瘤4期;3)年龄≤18岁;4)既往未接受抗肿瘤治疗;病例资料完整。排除标准:1)未接受原发肿瘤手术活检或切除的患者;2)临床诊断为神经母细胞瘤4期患者。本研究经中山大学肿瘤防治中心伦理委员会审查批准,所涉及的临床和病理资料,均经过患者或其家属知情同意。
全组男性61例,女性35例;中位年龄4.4(1.2~18.8)岁。原发肿瘤部位:头颈部1例,纵隔12例,肾上腺51例,后腹膜26例,盆腔6例(包括腹部+盆腔2例)。肿瘤转移部位:骨髓69例,骨单个或多发48例,远处淋巴结24例,肝脏11例,胸部6例,脑5例,皮肤3例,其他器官13例(表1)。原发肿瘤最长径>10 cm 44例,5~10 cm 44例,<5 cm 8例。84例(87.5%)患者神经特异性烯醇化酶(NSE)高于正常值(>15 μg/L)。共44例患者行N-myc癌基因检测,其中N-myc扩增阳性16例(36.4%)。
1.1.2 分期 参照国际神经母细胞瘤分期系统(INSS分期)[11],4期定义为肿瘤播散至远处淋巴结、骨髓、骨、肝脏、皮肤或其他脏器。
1.2 方法
1.2.1 治疗方法 1)化疗:术前化疗采用环磷酰胺+吡柔比星+长春新碱与足叶乙甙+顺铂(CAV/EP)交替化疗方案,每21天为1个周期,每2个疗程评估疗效,至原发肿瘤未再继续缩小时,作为最佳手术时机,行手术切除原发灶,术后继续化疗和(或)放疗,完全缓解后行维持治疗。若原发肿瘤无明显缩小或病情进展,则更改为异环磷酰胺+卡铂(IC)方案化疗,每21天为1个周期。每2个疗程评估疗效,原发肿瘤缩小行手术切除原发灶。
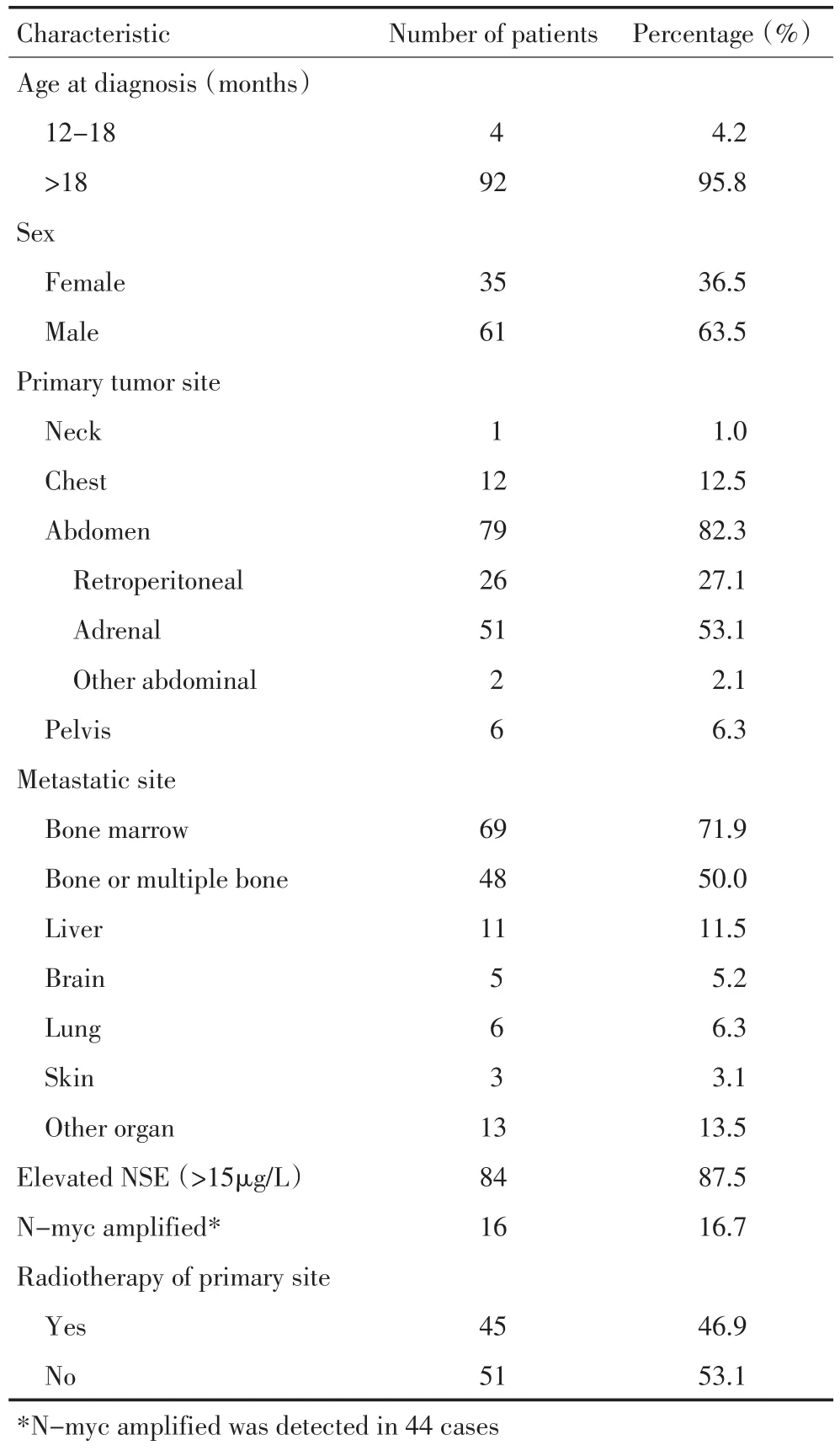
表 1 96例4期神经母细胞瘤患者临床病理特点Table 1 Clinical characteristics of 96 patients with stage-Ⅳneuroblastoma
2)手术:根据原发肿瘤切除范围分为:A组:活检或手术切除范围<50%;B组:手术切除范围50%~90%;C组:手术切除范围>90%;D组:手术完全切除。原发肿瘤手术切除范围评价依据包括手术前后影像学检查[12]、手术记录、术后病理报告等。
3)放疗:术后根据肿瘤残留情况,给予原发灶总剂量10.8~33.6 Gy局部放疗。
4)其他:化疗、手术和(或)放疗后行13-顺式维甲酸和(或)α-干扰素维持治疗。
1.2.2 疗效与不良反应评价 采用WHO实体肿瘤疗效评价标准,分为完全缓解(CR):肿瘤完全消失;部分缓解(PR):原发肿瘤体积缩小≥50%,转移瘤体积缩小>50%;病情稳定(SD):现有肿瘤体积缩小<50%或增加<25%,无新病灶出现;病情进展(PD):原发肿瘤体积增加>25%或出现新发病灶[13]。按美国国家癌症研究所不良反应评价标准2.0版本(NCICTC2.0)进行不良反应评价。
1.2.3 随访 全组96例患者7例失访,随访率92.7%。末次随访时间为2013年12月。
1.3 统计学方法
采用SPSS 19.0软件进行统计分析。采用Kaplan-Meier计算无进展生存率(progression-free survival,PFS)、局部无复发生存率(local recurrence-free survival,LRFS)、总生存率(overall survival,OS)并行Log-rank检验。无事件生存时间定义为初次诊断至首次任何事件出现日期之间的时间段。事件指进展、复发、疾病相关的死亡。局部控制时间定义为神经母细胞瘤诊断至局部进展或复发或疾病相关的死亡日期之间的时间段。总生存时间定义为诊断至出现疾病相关的死亡或生存病例末次随访日期之间的时间段。P<0.05为差异有统计学意义。
2 结果
本研究共纳入96例4期NB患者,中位生存时间为21(2~112)个月。其中,化疗8例(8.3%),化疗联合手术切除43例(44.8%),化疗联合手术切除及放疗45例(46.9%)。
2.1 化疗
共75例患者接受了术前化疗,其中CR 2例,PR 59例,SD 6例,PD 8例。术前化疗总有效率81.3%。中位化疗疗程6(2~10)个,化疗后接受了原发灶手术切除患者66例,其中CR 0例,PR 58例,SD 6例,PD 2例。9例患者化疗后未进一步手术治疗,其中CR 2例,PR 1例,PD 6例。
2.2 手术
96例患者,其中87例行原发肿瘤切除术,9例仅行活检(手术切除率90.6%)。初诊时手术切除21例(24.1%),化疗后手术切除66例(75.9%)。96例患者根据手术切除范围分为:A组24例,B组10例,C组23例,D组39例。D组中包括肉眼完全切除有镜下残留22例,肉眼完全切除无镜下残留17例。此外,A组有2例患者接受了2次手术,B组中有1例患者接受了3次手术。此3例患者未纳入生存分析。
2.3 放疗
共45例接受术后瘤床和转移灶放疗。中位放疗剂量21.6(10.8~33.6)Gy。其中A组4例,B组7例,C组10例,D组24例。其余51例患者由于各种原因未接受放疗。
2.4 其他
10例患者接受了自体造血干细胞移植,其中B组1例,C组2例,D组7例。50例患者接受了13-顺式维甲酸联合α-干扰素维持治疗。
2.5 不良反应
大部分患者化疗期间出现3~4级骨髓抑制,对症处理可恢复。87例手术患者均未发生手术相关性死亡及严重并发症。45例术后接受局部原发灶放疗患者亦未观察到放疗相关性死亡及严重并发症。
2.6 综合治疗后疗效
96例4期NB患者均接受化疗联合手术和(或)放疗等综合治疗。其中CR 66例,PR 3例,SD 2例,PD 25例。66例CR患者中43例治疗后复发,其中单纯原发灶复发1例,单纯转移复发34例,原发灶和转移灶同时复发8例(表2)。接受原发灶放疗患者45例中,2例发生局部复发。
2.7 生存
96例4期NB患者中位随访时间53(24~112)个月。3年PFS和OS分别为(32.8±5.4)%和(36.7± 5.4)%。亚组分析:A、B、C组和D组3年PFS分别为(17.5±8.5)%、(20.0±12.6)%、(45.1±12.1)%和(40.5± 9.1)%(图1);3年OS分别为(18.5±8.2)%、(15.0± 12.8)%、(54.1±11.4)%和(46.7±9.1)%(图2)。C组和D组3年LRFS分别为(51.8±11.7)%和(49.7±9.0)%。A组+B组和C组+D组3年PFS分别为(17.8±6.9)%和(42.2±7.3)%(P<0.001);3年OS分别为(17.9±6.9)%和(47.4±7.1)%(P<0.001)。而A组和B组间PFS和OS差异无统计学意义(P=0.352和P=0.394)。C组和D组间PFS、LRFS和OS差异无统计学意义(P=0.792、P=0.831和P=0.850)。对完全切除组亚组分析,肉眼完全切除伴镜下残留(22例)与肉眼完全切除且镜下未见残留(17例)比较,两组间PFS、LRFS和OS比较差异无统计学意义(P=0.904、P=0.872和P=0.812)。
45例患者接受了术后原发灶局部放疗。其中D组24例:3年PFS和LRFS分别为(44.0±12.5)%和(46.6±12.4)%;C组10例:3年PFS和LRFS分别为(54.0±20.5)%和(47.6±22.5)%。C组术后放疗患者和D组术后放疗患者间PFS和LRFS差异均无统计学意义(P=0.551和P=0.259)。C组术后放疗患者与D组术后未放疗患者间PFS和LRFS差异均无统计学意义(P=0.220和P=0.144)。D组术后放疗患者与D组术后未放疗患者间PFS和LRFS差异均无统计学意义(P=0.200和P=0.106)。A、B、C、D各组接受术后放疗患者间PFS和LRFS差异均无统计学意义(P=0.512和P=0.186)。
此外,10例接受了自体造血干细胞移植患者与86例未行自体造血干细胞移植患者间PFS和OS差异无统计学意义(P=0.464和P=0.491)。

表2 4期神经母细胞瘤患者不同组别治疗疗效及复发情况Table 2 Treatment responses and recurrence based on the degree of resection in the four groups with stage-ⅣNB

图1 各组患者PFS生存曲线Figure 1 Progression-free survival curves of patients with stage IV neuroblastoma
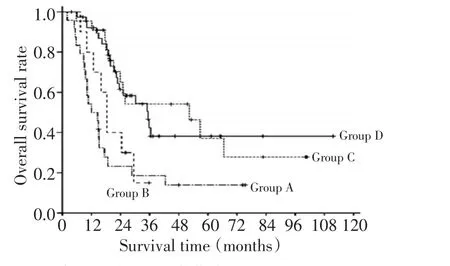
图2 各组患者OS生存曲线Figure 2 Overall survival curves of patients with stage IV neuroblastoma among the groups
3 讨论
手术是治疗神经母细胞瘤的重要手段之一。对于4期转移性NB患者,虽然肿瘤已经扩散,但原发肿瘤局部控制对其生存率提高仍有重要意义。在目前多学科综合治疗的策略下,手术切除原发肿瘤的必要性已经得到公认[14]。然而,原发肿瘤手术切除程度与预后的关系仍不清楚[5-10]。有研究报道手术完全切除原发肿瘤有利于延长4期NB患者生存期[5-6,15]。McGregor等[7,10]则认为只有在化疗有效控制转移灶的前提下,手术完全切除原发肿瘤才可能改善生存。另有研究认为在多学科综合治疗的策略下,手术切除范围大小并不影响预后[8-9]。
本研究中96例4期NB患者,66例初诊时无法手术切除原发肿瘤,在接受新辅助化疗4~6个周期后,原发肿瘤体积缩小至稳定,转移灶消失或缩小至稳定,75%的患者获得原发肿瘤手术切除机会。化疗后接受手术切除的66例患者,18例患者获得90%以上手术切除,28例患者获得完全切除。分析结果证明:4期NB患者术前化疗能提高原发肿瘤手术切除率。与国外研究相似[7,16]。Adkins等[10]认为术前化疗可提高原发肿瘤完全切除率,通过有效术前化疗,原发肿瘤完全切除率从27%提高至45%,本研究患者接受术前化疗后手术完全切除率为42%,结果相似。事实上对于多数4期NB患者而言,确诊时往往原发肿瘤位于腹膜后,体积较大且包绕邻近血管或黏连周围脏器。尽管积极化疗,肿瘤也是紧紧包绕着血管缩小,手术完全切除仍然困难[17]。因此,临床上大多数患者接受了大体完全切除,即90%以上切除术。此外,对于诱导化疗抵抗的患者,仍然有积极手术的必要性,相对于单纯化疗患者生存率有所提高[18]。
La等[19]认为4期NB患者原发肿瘤手术切除程度与预后密切相关。本研究结果也显示两者密切相关,且发现在化疗基础上,原发肿瘤90%以上切除的患者生存率明显高于90%以下切除的患者,两者PFS分别为42.2%和17.8%,OS分别为47.4%和17.9%。
完全切除是否能进一步提高生存率,肉眼完全切除有无镜下残留是否影响生存仍待探讨。Koh等[5]认为手术完全切除无镜下残留者生存率明显高于肉眼残留和镜下残留者。胡月等[20]认为在完整切除原发灶后,有无镜下残留并不影响生存率的提高。本研究同样发现,完全切除(39例)与>90%切除(23例)比较,两者3年PFS和OS差异均无统计学意义。完全切除组5例(5/39)原位局部复发,>90%切除组2例(2/23)原位局部复发。肿瘤完全切除相对>90%肿瘤切除而言,并不能进一步提高生存率,也不能降低局部复发率。因此,本研究认为对于确诊时原发肿瘤负荷较大且与周围组织器官关系密切,或化疗后仍不能完全切除原发肿瘤患者,手术可以考虑行90%以上肿瘤切除,术后继续化疗联合放疗,生存率与完全切除的患者无显著性差异。荟萃分析结果[21]显示,少量残留不会影响生存率,原因可能是手术尽量切除原发肿瘤的情况下后续治疗,包括化疗、局部放疗能有效控制肉眼少量残留病灶。
国外研究[17]报道,原发肿瘤肉眼完全切除联合放疗局部控制率可达84%~90%。本研究结果显示原发肿瘤肉眼完全切除联合放疗24例,2例原位复发,局部控制率达91.6%,与国外报道相似[22]。肉眼完全切除联合与不联合局部放疗无事件生存率和局部控制率差异均无统计学意义。90%以上切除术后联合原发灶局部放疗与手术完全切除患者的生存相似,差异也无统计学意义。肉眼切除术后接受放疗的患者3年无事件生存率、局部控制率、总生存率均明显高于未放疗患者。术后肿瘤少量残留患者给予原发灶局部放疗可有效减灭和控制残留病灶,对于有效降低局部复发和改善生存意义重大。放疗剂量应根据术后肿瘤残留情况决定。对于手术肉眼完全切除者给予18.1 Gy原发灶放疗可有效控制局部复发,而明显肉眼残留者须给予21.6~33.6 Gy。
4期NB治疗需要多学科联合[23],手术切除原发肿瘤作为最主要的治疗措施,切除范围与预后关系密切。切除原发肿瘤>90%或完全切除联合化疗和(或)放疗可提高生存率,切除原发肿瘤>90%与完全切除生存并无明显差异,少量肉眼残留或镜下残留联合化疗和放疗患者的生存率与完全切除患者相似。
本研究属于回顾性研究,各组病例之间难免存在临床特点同治疗方面的差异,因此结论尚需通过多中心大样本回顾性研究和随机临床对照试验进一步证实。
1 Cheung NK,Dyer MA.Neuroblastoma:developmental biology, cancer genomics and immunotherapy[J].Nat Rev Cancer,2013,13(6):397-411.
2 Matthay KK.Neuroblastoma:a clinical challenge and biologic puzzle[J].CA Cancer J Clin,1995,45:179-192.
3 Maris JM,Hogarty MD,Bagatell R,et al.Neuroblastoma[J].Lancet,2007,369(9579):2106-2120.
4 Castel V,Tovar JA,Costa E,et al.The role of surgery in stage IV neuroblastoma[J].J Pediatr Surg,2002,37:1574-1578.
5 Koh CC,Sheu JC,Liang DC,et al.Complete surgical resection plus chemotherapy prolongs survival in children with stage 4 neuroblastoma[J].Pediatr Surg Int,2005,21(2):69-72.
6 Kuroda T,Saeki M,Honna T,et al.Clinical significance of intensive surgery with intraoperative radiation for advanced neuroblastoma:does it really make sense[J]?J Pediatr Surg,2003,38(12):1735-1738.
7 McGregor LM,Rao BN,Davidoff AM,et al.The impact of early resection of primary neuroblastoma on the survival of children older than 1 year of age with stage 4 disease:the St.Jude Children's Research Hospital Experience[J].Cancer,2005,104(12):2837-2846.
8 Bastian PJ,Fleischhack G,Zimmermann M,et al.The role of complete surgical resection in stage IV neuroblastoma[J].World J Urol, 2004,22(4):257-260.
9 Simon T,Haberle B,Hero B,et al.Role of surgery in the treatment of patients with stage 4 neuroblastoma age 18 months or older at diagnosis[J].J Clin Oncol,2013,31(6):752-758.
10 Adkins ES,Sawin R,Gerbing RB,et al.Efficacy of complete resection for high-risk neuroblastoma:a Children's Cancer Group study [J].J Pediatr Surg,2004,39(6):931-936.
11 Brodeur GM,Pritchard J,Berthold F,et al.Revisions of the international criteria for neuroblastoma diagnosis,staging,and response to treatment[J].J Clin Oncol,1993,11(8):1466-1477.
12 Brisse HJ,McCarville MB,Granata C,et al.Guidelines for imaging and staging of neuroblastic tumors:consensus report from the International Neuroblastoma Risk Group Project[J].Radiology,2011, 261(1):243-257.
13 Miller AB,Hoogstraten B,Staquet M,et al.Reporting results of cancer treatment[J].Cancer,1981,47(1):207-214.
14 von Allmen D,Grupp S,Diller L,et al.Aggressive surgical therapy and radiotherapy for patients with high-risk neuroblastoma treated with rapid sequence tandem transplant[J].J Pediatr Surg,2005,40 (6):936-941.
15 Liu ZL,Xiao YH,Chen DX,et al.The impact of gross total resection on survival in children with stage III/IV neuroblastomastudy of clinical efficacy in 21 cases[J].Eur Rev Med Pharmacol Sci, 2014,18(16):2253-2257.
16 Kubota M.The role of surgery in the treatment of neuroblastoma [J].Surg Today,2010,40(6):526-532.
17 Rich BS,McEvoy MP,Kelly NE,et al.Resectability and operative morbidity after chemotherapy in neuroblastoma patients with encasement of major visceral arteries[J].J Pediatr Surg,2011,46(1):103-107.
18 Du L,Liu L,Zhang C,et al.Role of surgery in the treatment of patients with high-risk neuroblastoma who have a poor response to induction chemotherapy[J].J Pediatr Surg,2014,49(4):528-533.
19 La Quaglia MP,Kushner BH,Su W,et al.The impact of gross total resection on local control and survival in high-risk neuroblastoma [J].J Pediatr Surg,2004,39(3):412-417.
20 Hu Y,Zhao Q,Qiao XH,et al.The impact of surgical intervention on survival in stageⅣneuroblastoma[J].Chin J Pediatr Surg,2013, 34(2):81-85.[胡 月,赵 强,乔晓红,等.Ⅳ期神经母细胞瘤手术切除范围对生存率的影响[J].中华小儿外科杂志,2013,34(2):81-85.]
21 Zwaveling S,Tytgat GA,van der Zee DC,et al.Is complete surgical resection of stage 4 neuroblastoma a prerequisite for optimal survival or may>95%tumour resection suffice[J]?Pediatr Surg Int, 2012,28(10):953-959.
22 Robbins JR,Krasin MJ,Pai Panandiker AS,et al.Radiation therapy as part of local control of metastatic neuroblastoma:the St Jude Children's Research Hospital experience[J].J Pediatr Surg,2010,45 (4):678-686.
23 Modak S,Cheung NK.Neuroblastoma:Therapeutic strategies for a clinical enigma[J].Cancer Treat Rev,2010,36(4):307-317.
(2014-08-22收稿)(2014-10-28修回)
(本文编辑:邢颖)
Effect of excision extension of primary tumors on local control and survival of stage IV neuroblastoma
Pengfei LI1,Juncheng LIU2,Zijun ZHEN1,Zhuowei LIU1,Yuanhong GAO1,Jia ZHU1,Juan WANG1,Suying LU1,Feifei SUN1,
Fei ZHANG1,Ruiqing CAI1,Xiaofang GUO1,Xiaofei SUN1
1Depatment of Pediatric Oncology,Sun Yet-Sen University Cancer Center,State Key Laboratory of Oncology in South China, Guangzhou 510060;2Department of Pediatric Surgery,The First Affiliated Hospital of Sun Yat-Sen University,Guangzhou 510080,China
Xiaofei SUN;E-mail:sunxf@sysucc.org.cn
Objective:To investigate the effect of gross total resection on the local control and survival of patients with stage IV neuroblastoma(NB)and analyze the extent of surgical resection of primary tumors that affects patient survival.Methods:A total of 96 patients with stageⅣNB who were admitted to the Sun Yat-Sen University Cancer Center between January 2000 and December 2011 were analyzed.The patients were treated with combined-modality therapy,including chemotherapy,surgery,and/or radiotherapy.The patients were divided according to the extent of surgical resection of primary tumor into the following groups:group A,biopsy or tumor removal of less than 50%of the primary lesion;group B,incomplete resection of more than 50%but less than 90%of the lesion;group C,removal of more than 90%of the lesion;and group D,complete resection with or without macroscopic residual tumors.The survival rates of each group were analyzed.Results:The median age of the 96 patients was 4.4 years,ranging from 1.2-18.8 years.The overall 3-year progression-free survival(PFS)and overall survival(OS)of the total patients were 32.8%and 36.7%,respectively.A total of 24 cases were assigned in group A,10 in group B,23 in group C,and 39 in group D.Subgroup analysis revealed that the 3-year PFS rate was 17.5%for group A,20.0%for group B,45.1%for group C,and 40.5%for group D.The PFS rates were not statistically significantly different between groups A and B(P=0.352)and between groups C and D(P=0.792).However,the OS was higher in groups C and D than that in groups A and B.The 3-year PFS rates were 42.2%and 17.8%for groups C and D(P<0.001),respectively.Conclusion:Resection extension of more than 90%of the primary tumor combined with chemotherapy and(or)radiation therapy can improve the survival of patients with stageⅣNB.However,this treatment modality does not affect the treatment outcomes for minimal gross tumor residuals.
neuroblastoma,stage IV,surgery,survival rate,extent of surgical resection

10.3969/j.issn.1000-8179.20141222
①中山大学肿瘤防治中心儿童肿瘤科,华南肿瘤学重点实验室(广州市510060);②中山大学附属第一医院小儿外科
孙晓非 sunxf@sysucc.org.cn
李鹏飞 专业方向为儿童肿瘤治疗的临床研究。
E-mail:lipf@sysucc.org.cn

