茶多酚和黄芩苷对百草枯中毒大鼠血清及肺组织TGF-β1和HIF-1α表达的影响
徐丽倩李 江李璐璐李剑平刘晓璐何 勇邓丹凤裘云庆
1浙江大学医学院附属第一医院 杭州 310003 2河南省人民医院
3浙江大学医学院附属第一医院传染病诊治国家重点实验室
茶多酚和黄芩苷对百草枯中毒大鼠血清及肺组织TGF-β1和HIF-1α表达的影响
徐丽倩1李 江2李璐璐1李剑平1刘晓璐1何 勇1邓丹凤3裘云庆3
1浙江大学医学院附属第一医院 杭州 310003 2河南省人民医院
3浙江大学医学院附属第一医院传染病诊治国家重点实验室
目的观察茶多酚(TP)、黄芩苷(baicalin)对急性百草枯中毒大鼠血清及肺组织TGF-β1、HIF-1α表达的影响。方法90只健康SD大鼠随机分为空白对照组(N组)、急性百草枯中毒组(P组)、茶多酚干预组(T组)、黄芩苷干预组(S组)及茶多酚加黄芩苷干预组(L组),每组18只,各组再按随机原则分为1、7和14天三个亚组,每个亚组6只。P、T、S、L各组大鼠均予50mg/kg一次性腹腔注射染毒;大鼠染毒6h后T组给予茶多酚250mg/(kg·d)、S组予黄芩苷80mg/(kg·d)L组给予茶多酚加黄芩苷混悬液灌胃干预,N组和P组均给予用等量生理盐水灌胃。在第1、7和14天随机处死大鼠,腹主动脉采血,采用酶联免疫吸附法(ELISA)检测血清TGF-β1、HIF-1α水平,免疫组化染色检测大鼠肺组织TGF-β1、HIF-1α表达量。结果经百草枯染毒后,P组大鼠血清及肺组织各时点TGF-β1、HIF-1α含量均高于N组(P均<0.05)。经药物干预后,T、S、L组大鼠血清TGF-β1、HIF-1α水平在第7天和第14天时较P组显著降低(P均<0.05);S组在第14天时,T组与L组第7天和第14天时大鼠肺组织TGF-β1、HIF-1α表达均较P组显著降低(P<0.05)。各药物干预组各时点TGF-β1、HIF-1α表达量比较,差异无统计学意义(P>0.05)。结论茶多酚、黄芩苷对急性PQ中毒大鼠血清及肺组织TGF-β1、HIF-1α表达有下调作用。
大鼠;百草枯中毒;茶多酚;黄芩苷;TGF-β1;HIF-1α
百草枯﹙paraquat,PQ﹚又名对草快、克芜踪,化学名1-1-二甲基-4-4-联吡啶阳离子盐,是一种非选择性、接触性除草剂,对人体毒性强,病死率高,口服百草枯中毒后除引起消化道糜烂、出血外,可致肺、肾、肝等多脏器功能障碍综合征;其特征性的中毒改变为肺组织,早期肺部表现为肺泡上皮细胞受损,肺泡出血水肿、炎症细胞浸润,晚期则为肺纤维化过程,一旦出现肺纤维化,则预后极差[1-3]。研究表明,细胞因子在肺纤维化的发生发展中起着重要作用[4]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)具有诱导胶原合成和改变细胞外基质成分等广泛生物学作用,在各种肺间质纤维化中都具有重要作用,被认为是纤维化过程中的“开关因子”。目前已证实,在PQ中毒的早期肺组织中即可检测到TGF-β1高表达[5-6]。低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是近年来发现的一种常氧条件下基本不表达,缺氧时高表达,能够介导哺乳动物细胞低氧反应的核转录因子。有研究显示,HIF-1α通过多种途径调节人体许多组织的纤维化过程,如肝脏、肾脏、心脏、肺,甚至脂肪和皮肤组织,抑制HIF-1α表达能在一定程度上减轻组织器官纤维化程度[7-9]。
茶多酚(tea polyphenols,TP)是茶叶中多酚类化合物的总称,黄芩苷(baicalin)是传统中药黄芩(scutellariabai calensisgeorgi,SC)的主要成分,茶多酚及黄芩苷具有抗氧化性损伤的作用。有文献报道,黄芩苷及茶多酚对小鼠、大鼠肺纤维化具有一定的干预作用,能有效减轻博莱霉素所诱导的大鼠肺纤维化[10-11]。本研究通过腹腔注射染毒建立百草枯中毒大鼠模型后给予上述两种药物干预,观察其对PQ中毒大鼠血清及肺组织TGF-β1、HIF-1α表达的影响,报道如下。
1 材料与方法
1.1实验动物 SPF级健康雄性SD大鼠90只,体质量200~250g,浙江大学医学院附属第一医院实验动物中心提供,动物合格证SYXK(浙)2013-0180。
1.2实验材料 茶多酚粉剂及黄芩苷粉剂购自上海士锋生物科技有限公司;20%百草枯水剂购自浙江金华金穗农药有限公司,大鼠TGF-β1及HIF-1α两种ELISA试剂盒均来自美国Cusabio公司,TGF-β1、HIF-1α抗体、免疫组化试剂盒均购于上海士锋生物科技有限公司。
1.3实验方法 90只SD大鼠随机分为空白对照组(N组)、急性PQ中毒组(P组)、茶多酚干预组(T组)、黄芩苷干预组(S组)以及两种药物联合干预组(L组),每组18只。各组再按随机原则分为1、7和14天三个亚组,每个亚组6只。P、T、S、L组大鼠均以PQ(50mg/kg,生理盐水稀释至1mL)一次性腹腔注射染毒。T、S、L组大鼠在百草枯中毒后6h后分别采用药物灌胃干预,T组大鼠给予茶多酚250mg/kg灌胃干预,每天1次,至处死;S组大鼠予黄芩苷80mg/kg灌胃干预,每天1次至处死;L组大鼠给予茶多酚及黄芩苷复合制剂灌胃干预,每天1次至处死;N组和P组均给予用等量生理盐水灌胃。实验第1、7、14天采用腹腔内注射水合氯醛(10%水合氯醛按0.4mL/ 100g腹腔注射)麻醉后仰卧大鼠,腹主动脉采血,静置20min,3000r/min离心5min后取血清,采用酶联免疫吸附法(ELISA)检测血清TGF-βl、HIF-1α水平,按说明书规程操作。开胸,完整取出两侧肺组织,取左肺叶用10%福尔马林液固定,以备免疫组化染色。
1.4大鼠肺组织切片与TGF-β1、HIF-1α免疫组化染色 取大鼠肺组织,10%福尔马林液固定,梯度酒精脱水、二甲苯透明、石蜡包埋。将肺组织石蜡块3um切片依次脱蜡至水,3%H2O2阻断20min,煮沸15min抗原修复,用10%正常羊血清室温孵育切片,封闭。甩掉封闭液,滴加1∶1000稀释的一抗孵育切片,37℃孵育1h。PBS洗涤。滴加生物素化山羊抗兔IgG二抗,37℃孵育20min。PBS洗涤。滴加SABC,37℃孵育20min。PBS洗涤DAB镜下控制染色,苏木精复染2min,乙醇脱水、甲苯透明,中性胶封片,显微镜下观察组织着色情况。免疫组化研究中同时设置阴性和阳性对照。每张切片选择5个不同视野采用image-proplus图像分析系统进行定量分析,结果以光密度值(opticaldensity,OD)表示,取其均值进行统计分析。
1.5统计学方法 应用SPSS20.0软件处理数据。实验数据用均数±标准差() 表示,采用单因素方差分析,组间多重比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠血清TGF-βl、HIF-1α含量比较 血清TGF-β1水平:P组显著高于N组(P<0.05);与P组比较,T、S、L组下降明显(P<0.05)。血清HIF-1α水平:P、T组显著高于N组(P<0.05);与P组比较,T、S、L组下降明显(P<0.05)。见表1。
表1 各组大鼠血清TGF-β1、HIF-1α含量比较() pg/mL
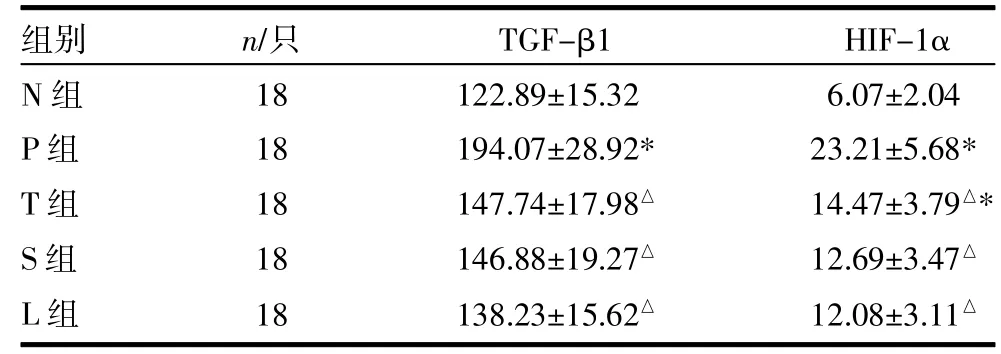
表1 各组大鼠血清TGF-β1、HIF-1α含量比较() pg/mL
注:N组为空白对照组,P组为急性PQ中毒组,T组为茶多酚干预组,S组为黄芩苷干预组,L组为茶多酚合黄芩苷干预组。与N组比较,*P<0.05;与P组比较,△P<0.05
?
2.2各组大鼠不同时点血清TGF-βl含量比较 实验第1天,与N组比较,P、T、S、L组TGF-β1水平显著升高(P<0.05),T、S、L组与P组比较差异无统计学意义(P>0.05)。实验第7天,与N组比较,P、T、S组TGF-β1水平显著升高(P<0.05);T、S、L组较P组明显降低(P<0.05)。实验第14天,与N组比较,P组TGF-β1水平显著升高(P<0.05);T、S、L组较P组明显降低(P<0.05)。见表2。
表2 不同时点各组大鼠血清TGF-β1水平比较() pg/mL

表2 不同时点各组大鼠血清TGF-β1水平比较() pg/mL
注:N组为空白对照组,P组为急性PQ中毒组,T组为茶多酚干预组,S组为黄芩苷干预组,L组为茶多酚合黄芩苷干预组。与N组比较,*P<0.05;与P组比较,△P<0.05
?
2.3各组大鼠不同时点血清HIF-1α含量比较 实验第1天,与N组比较,P组HIF-1α水平显著升高(P<0.05),T、S、L组HIF-1α水平无明显变化(P>0.05);T、S、L组与P组比较差异无统计学意义(P>0.05)。实验第7天,与N组比较,P、T、S、L组HIF-1α水平显著升高(P<0.05);T、S、L组较P组明显降低(P<0.05)。实验第14天,与N组比较,P、T组HIF-1α水平显著升高(P<0.05);T、S、L组较P组明显降低(P<0.05)。见表3。
表3 不同时点各组大鼠血清HIF-1α水平比较() pg/mL

表3 不同时点各组大鼠血清HIF-1α水平比较() pg/mL
注:N组为空白对照组,P组为急性PQ中毒组,T组为茶多酚干预组,S组为黄芩苷干预组,L组为茶多酚合黄芩苷干预组。与N组比较,*P<0.05;与P组比较,△P<0.05
?
2.4大鼠肺组织TGF-β1蛋白表达 免疫组化结果显示,大鼠TGF-β1蛋白表达在胞浆,表达的细胞有肺泡巨噬细胞、支气管上皮细胞、血管内皮细胞(见插页图1)。与N组比较,P、T、S及L组TGF-β1表达在第1、7、14天均升高,差异有统计学意义(P<0.05),其中P组表达量最高。除S组7天时与P组差异无统计学意义(P>0.05)外,其余各组7天和14天时TGF-β1表达均较P组降低(P均<0.05)。各药物干预组各个时间TGF-β1表达差异均无统计学意义(P均>0.05)。见表4。
表4 不同时间点各组大鼠肺组织TGF-β1表达比较()
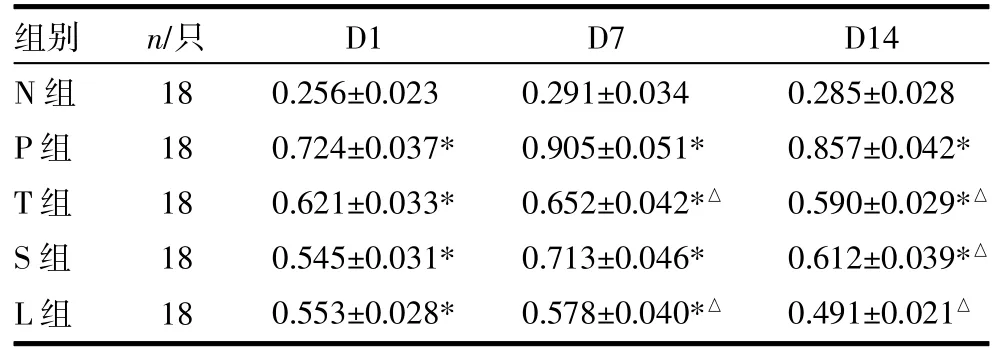
表4 不同时间点各组大鼠肺组织TGF-β1表达比较()
注:N组为空白对照组,P组为急性PQ中毒组,T组为茶多酚干预组,S组为黄芩苷干预组,L组为茶多酚合黄芩苷干预组。与N组比较,*P<0.05;与P组比较,△P<0.05
?
2.5各组大鼠肺组织HIF-1α表达变化 HIF-1α蛋白阳性表达主要位于肺细小动脉平滑肌细胞,肺泡上皮细胞及细支气管上皮细胞,胞浆均呈阳性(见插页图2)。与对照组比较,P、T、S及L组HIF-1α表达在第1、7、14天均升高,差异有统计学意义(P<0.05),其中P组表达量最高。除S组7天时与P组差异无统计学意义(P>0.05)外,其余各组7、14天时HIF-1α表达均较P组降低(P均<0.05)。各药物干预组各个时间点HIF-1α表达差异无统计学意义(P均>0.05)。见表5。
表5 不同时间点各组大鼠肺组织 HIF-1α表达比较()
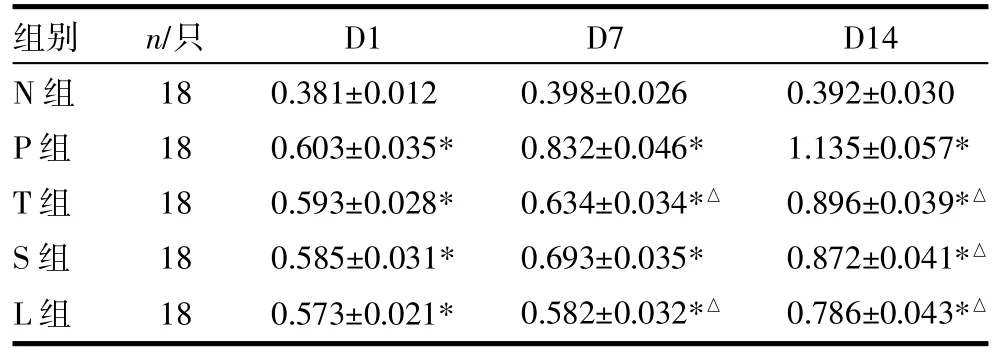
表5 不同时间点各组大鼠肺组织 HIF-1α表达比较()
注:N组为空白对照组,P组为急性PQ中毒组,T组为茶多酚干预组,S组为黄芩苷干预组,L组为茶多酚合黄芩苷干预组。与N组比较,*P<0.05;与P组比较,△P<0.05
组别N组P组T组S组L组n/只18 18 18 18 18 D1 0.381±0.012 0.603±0.035* 0.593±0.028* 0.585±0.031* 0.573±0.021* D7 0.398±0.026 0.832±0.046* 0.634±0.034*△0.693±0.035* 0.582±0.032*△D14 0.392±0.030 1.135±0.057* 0.896±0.039*△0.872±0.041*△0.786±0.043*△
3 讨论
自1966年Bullivant[12]首次报道2例百草枯中毒死亡病例后,世界各地相继报道百草枯中毒病例。百草枯属于联吡啶类除草剂,动物实验属中等毒类,人口服百草枯中毒致死量约为5~10mL的20%原液。PQ中毒后肺组织浓度最高[13],引起肺泡出血、水肿,以及炎细胞浸润,最终导致肺纤维化,严重影响气体交换,致使缺氧而死亡,死亡率高,且存活者中绝大多数存在肺纤维化。因此,如能有效地干预及减轻肺出血、水肿等病理变化,减慢肺纤维化的形成,可以减少百草枯中毒的病死率。
有关肺纤维化发病机制的研究显示,细胞因子可通过自分泌或旁分泌方式发挥其生物学作用,并通过与其靶细胞表面相应受体相互作用,将生物信号转导至细胞内,启动胞内信号转导级联,调控胞内基因表达,从而导致肺纤维化[14]。因此,近年有文献提出肺纤维化细胞因子网络的概念,产生细胞因子的细胞有肺巨噬细胞、肺泡Ⅱ型细胞、中性粒细胞、上皮细胞和毛细血管内皮细胞等。
TGF-β1被认为是肺纤维化病理过程起重要作用的细胞因子之一,在肺纤维化发生的细胞因子网络中占据着重要地位。它作用于多个环节,与多种细胞因子相互作用,刺激各种细胞外基质的合成和沉积以及抑制细胞外基质蛋白的降解两个方面,最终促使肺间质胶原的沉积。动物实验证实,TGF-β1在二氧化硅、博莱霉素诱导的肺纤维化的发生、发展过程中发挥重要的作用。
低氧诱导因子1(HIF-1)被认为是诱导低氧基因和修复细胞内氧环境的一核心调节因子,广泛存在于慢性缺氧细胞中。它是由HIF-1α和HIF-1β2个亚基组成的异二聚体。其中,HIF-1α是HIF-1所特有,是HIF-1的调节亚基,又是HIF-1的活性亚基。已有大量研究证实HIF-1α与缺氧的相关性。组织细胞低氧既是百草枯中毒急性肺损伤的主要表现之一,又是促进肺损伤进一步加重,肺组织纤维化形成的机制之一。有研究表明,HIF-1α通过多种途径调节人体许多组织的纤维化过程,如肝脏、肾脏、心脏、肺,甚至脂肪和皮肤组织。抑制HIF-1α表达能在一定程度上减轻组织器官纤维化程度。
茶多酚又称茶鞣质、茶单宁,是从茶叶中提取的含有多酚类化合物的混合物,主要包括儿茶素类、黄酮及黄酮醇类、花白素及花青素类、酚酸及缩酚酸类。研究[15]表明,茶多酚具有抗菌、防癌抗癌、降血脂、保护心脑血管、护肝和抗氧化等作用。黄芩主要含黄芩苷、黄芩素、汉黄芩素、汉黄芩苷、黄芩新素、β-谷甾醇等成分,临床主要用于消炎和抗感染以及抗脂质过氧化作用[16]。研究发现,茶多酚及黄芩苷能有效减轻博莱霉素所诱导的大鼠肺纤维化,对能否减轻百草枯所致大鼠肺纤维化少有报道。本研究结果显示,空白对照组大鼠无明显TGF-β1、HIF-1α表达,而PQ中毒组大鼠两者表达水平均有显著增高,与文献报道一致[17]。PQ中毒大鼠用茶多酚及黄芩苷干预后,血清TGF-β1、HIF-1α及肺组织TGF-β1、HIF-1α表达水平均有显著下降,并且部分药物干预组在第14天时与空白对照组间差异无统计学意义(P>0.05)。本研究结果显示,茶多酚及黄芩苷可下调百草枯中毒大鼠血清及肺组织TGF-β1和HIF-1α表达水平。
[1]Morán JM,Ortiz-Ortiz MA,Ruiz-Mesa LM,et al.Nitric oxide in paraquat-mediated toxicity:A review[J].J Biochem Mol Toxicol,2010,24(6):402-409.
[2]Yamashita M,Yamashita M,Ando Y.A long-term follow-up of lung function in survivors of paraquat poisoning[J].Hum Exp Toxicol,2000,19(2):99-103.
[3]Suntres ZE.Role of antioxidants in paraquat toxicity[J]. Toxicology,2002,180(1):65-77.
[4]Zhai R,Ge X,Li H,et al.Differences in cellular and inflammatory cytokine profiles in the bmnehoalvedar[avage fluid in bagassosis and silicosis[J].Am J Ind Med,2004,46(4):338.
[5]Mainwaring G,Lim FL,Antrobus K,et al.Identification of early molecular pathways affected by paraquat in the rat lung[J].Toxicology,2006,225(2-3):157-172.
[6]Ishida Y,Takayasu T,Kimura A,etal.Gene expression of cytokines and growth factors in the lungs after paraquat administration in mice[J].Legal Med,2006,8(2):102-109.
[7]Kimura K,Iwano M,Higgins DF,et al.Stable expression of HIF-1 alpha in tubular epithelial cells promotes interstitial fibrosis[J].Am J Physiol Renal Physiol,2008,295(4):F1023-F1029.
[8]Halberg N,Khan T,Trujillo ME,et al.Hypoxia-inducible factor lalpha induces fibrosis and insulin resistance in white adipose tissue[J].Mol Cell Biol,2009,29(16):4467-4483.
[9]Hong KH,Yoo SA,Kang SS,et al.Hypoxia induces expression of connective tissue growth factor in sclerodenna skin fibroblasts[J].Clin Exp Immunol,2006,146(2):362.
[10]Sriram N,Kalayarasan S,Sudhandiran G.Enhancement of antioxidant defense system by epigallocatechin-3-gallate during bleomycin induced experimental pulmonary fibrosis[J].Biol Pharm Bull,2008,31(7):1306-1311.
[11]Jia H,Chen XL,Chen C,et al.Baicalin prevents the upregulation of connective tissue growth factor in fibrotic lungs of rats[J].Sheng Li Xue Bao,2010,62(6):535-540.
[12]Bullivant CM.Accidental poisoning by paraquat:report of two cases in man[J].Br Med J,1966,1(5498):1272-1273.
[13]赵波,菅向东,张忠臣,等.百草枯染毒大鼠组织中毒物含量与脏器损伤的关系[J].中华劳动卫生职业病杂志,2010,28(3):56-58.
[14]Zhai R1,Ge X,Li H,et al.Differences in cellular and inflammatory cytokine profiles in the bronchoalveolar lavage fluid in bagassosis andsilicosis[J].Am J Ind Med,2004,46(4):338-344.
[15]Higdon JV,Frei B.Tea catechins and polyphenols:health effects,metabolism,and antioxidant functions[J].Crit Rev Food Sci Nutr,2003,43(1):89-143.
[16]张建春,张华.黄芩苷的研究近况[J].时珍国医国药,2005,16(3):247-249.
[17]杭瑛,钱洁,朱长清,等.百草枯中毒小鼠肺组织转化生长因子β和缺氧诱导因子1α的表达[J].上海交通大学学报(医学版),2012,32(12):1594-1599.
Effects of Tea Polyphenols and Baicalin on Expression of TGF-βl and HIF-1α in Acute Paraquat Poisoned Rats
XU Liqian1,LI Jiang2,LI Lulu1,LI Jianping1,LIU Xiaolu1,HE Yong1,DENG Danfeng3,QIU Yunqing31.First Af?liated Hospital,Zhejiang University School of Medicine,Hangzhou (310003),China;2.Henan Provincial People's Hospital;3.State Key Laboratory for Infectious Diseases Prevention and Control,First Af?liated Hospital,Zhejiang University School of Medicine.
ObjectiveTo investigate the effect of tea polyphenols(TP)and baicalin on changes of transcription growth factor β1(TGF-β1)and hypoxia inducible factor 1α(HIF-1α)after acute paraquat poison in rats.MethodsNinety healthy Sprague-Drawley rats were randomly divided into control group(n=18),paraquat group(n=18),paraquat+TP group(group TP,n=18),paraquat+baicalin group(group baicalin,n=18)and paraquat+TP+baicalin group(group TP+baicalin,n=18).Except control group,other groups were treated with intraperitoneal injection of 20% paraquat(50mg/kg)at a time,and at 6 h after poisoning,TP group was given TP at 250mg/(kg·d),baicalin group was given baicalin at 80mg/(kg·d),and TP+baicalin group was given TP and baicalin intragastrically,and control and paraquat group were given equivalent volume of saline.Rats were sacrificed on the 1st,7th,and 14th day to obtain blood from abdominal aorta for determination of levels of TGF-βl and HIF-1α by ELISA.The lungs were taken for examination of the expression of TGF-β1 and HIF-1α proteins by immunohistochemistry.ResultsCompared with control group,the levels of TGF-β1 and HIF-1α in paraquat group was increased significantly(P<0.05)both in serum and lung tissue.After drug intervention,the serum levels of TGF-βl and HIF-1α in TP,baicalin,andTP+baicalin groups were lower than that of paraquat group(P<0.05)on the 7th and 14th day.Compared with paraquat group,the expression of TGF-βl and HIF-1α in lung tissues was decreased in TP and TP+baicalin groups on 7th day and 14th day and in baicalin group on 14th day(P<0.05).No statistical difference was found among TP,baicalin,and TP+baicalin groups at each time point(all P>0.05).Conclusion Administration of TP and baicalin can down-regulate the levels of TGF-β1 and HIF-1α both in serum and tissues of rats poisoned by paraquat.
rats;paraquat poisoning;tea polyphenols;baicalin;TGF-β1;HIF-1α
2014-03-12
修回日期:2014-04-28
浙江省中医药重点研究计划资助项目(No.2011ZZ008)
裘云庆,E-mail:qiuyq@zju.edu.cn

