SD大鼠运动前后硫化氢含量的比较分析
金 晨 李 强 张 璐 李 婧 钟无非 周 越
SD大鼠运动前后硫化氢含量的比较分析
金 晨1李 强1张 璐1李 婧1钟无非2周 越3
(1.国家体育总局训练局体能康复中心,北京 100061;2.广西玉林师范学院体育学院,广西 玉林 ;3. 北京体育大学运动人体科学学院,北京 100081 )
目的是检测运动前后大鼠血液及各组织H2S含量以及各个组织生成酶活性,分析运动后各组织H2S含量及其生成酶活性的变化特点。以雄性SD大鼠为实验对象,采用敏感硫电极法检测大鼠心脏,肾脏,肺,肝脏,骨骼肌,脑等组织H2S含量,对结果进行相关性分析。雄性SD大鼠16只,随机分为2组:对照组、运动组。运动组大鼠做连续1小时的一次大强度性负重(10%体重)游泳运动,运动后即刻对大鼠取心脏,肾脏,肺,肝脏,脑组织、腓肠肌、腹主动脉血进行分析,采用敏感硫电极法测定各组织的H2S含量及其生成酶活性;对照组大鼠直接取样测定。经运动后与对照组相比除大鼠脑组织H2S含量明显降低外,运动组大鼠各组织系统H2S含量较对照组有大幅度升高。经运动后与对照组相比除大鼠脑组织H2S生成酶活性略有降低外,运动组大鼠各组织H2S生成酶活性较对照组均有不同程度的升高,尤以心脏、肺脏组织有大幅度升高。敏感硫电极法测量范围广,敏感性强,稳定性和重复性均良好,可应用于大鼠脑、心脏、肾脏、肝脏、肺、骨骼肌H2S测定的研究,但在测试血浆H2S含量时精确度略显不够。经一次性大强度运动后,与对照组相比大鼠心脏,肺脏,肝脏,肾脏,骨骼肌器官的H2S/生成酶体系均有不同程度的提升。运动使内源性一氧化氮升高从而造成H2S/生成酶体系的升高。一次性大强度运动可增加各个组织无氧代谢酶活性,推测一次性大强度运动使机体无氧代谢酶活性的升高与H2S/生成酶系统活性的上升有着必然联系。大鼠运动后脑组织H2S/生成酶系统活性降低的原因还不是十分清楚,推测测定时大鼠脑组织中的硫化氢生成酶胱硫醚—β—合酶(CBS)还未合成。大鼠血浆硫化氢浓度变化趋势同大鼠其它组织,验证了血管平滑肌CSE在大鼠运动后的表达同其它各组织。
运动;硫化氢;敏感硫电极法
据20世纪 90年代以来的研究发现,内源性产生的H2S存在于哺乳动物的多种组织、器官,通过多种调节方式和信号转导形式发挥多种生理、病理作用,可松弛血管及消化道平滑肌,进而影响该组织的生理功能和病理过程;选择性地增强 N-甲基–D-天冬氨酸(NMDA)受体介导的反应,并改变对海马的长时程增强(LTP)作用的诱导(海马的LTP是一个有关学习和记忆的突触模型) ,从而影响大脑的发育;调节下丘脑促肾上腺皮质激素释放激素(CRH)释放抑制由内皮素诱导的血管平滑肌细胞 (VSMC)的增殖效应进而调节血管平滑肌细胞张力,可能起内源性气体信息分子的作用。由对其生理作用的研究,提出了H2S是一种新型的、具有类似氧化亚氮 (NO)和一氧化碳(CO)某些特征的分子,如H2S是一种小分子量的气体分子、不通过受体发挥作用、其生成受内源性关键酶的调节、生理浓度时有很明确的特殊作用等,因此,将其归为第3类内源性气体信息分子,从而开辟了对H2S认识、研究的新领域。
越来越多的资料表明[1-3],H2S广泛参与机体多种生理和病理过程,可对机体心血管、神经、代谢、消化、免疫、血液等系统进行调节。目前检测H2S及其生成酶的方法主要有两种,即亚甲基蓝比色法和敏感硫电极法。亚甲基蓝比色法是检测H2S及其生成酶的经典方法,为多数研究者所采用,但与新兴的敏感硫电极法相比,其检测敏感性较差。有关内源性H2S和运动系统的研究尚未见报道,但有研究显示,人体在运动时吸入一定浓度外源性H2S后,骨骼肌乳酸脱氢酶活性增加、有氧氧化酶活性呈不同浓度降低,猜测H2S作用于人体后通过抑制肌肉运动时有氧代谢,降低人体运动过程中的氧摄取,从而增加人体在运动过程中依赖无氧代谢的能力,提高机体的适应能力。但其目前的研究也仅针对少数几种哺乳动物、有限的几种器官、系统。由于对H2S根深蒂固的毒性认识,限制了对其在生物体内的生理作用、调节机制、病理生理等方面作用机制的进一步研究。虽然目前的研究范围和领域在不断地扩大,仍远未达到对其本质的认识,这就有待我们在今后的工作中不断地进行探索。
本文通过设定运动刺激因素,检测运动后大鼠心脏、肾脏、肺、肝脏各组织H2S含量及其生成酶活性,分析运动后各组织H2S含量及其生成酶活性的变化特点,并对H2S及其生成酶系统影响运动后各组织机能变化的可能机制进行初步探讨,对大鼠运动前后各器官系统的硫化氢与生成酶含量进行比较以研究运动对其机体内源性H2S含量的影响。
1 材料与方法
1.1 研究对象
健康雄性Spraque Dawley(SD)大鼠16只,体重175-208g, 购自北京大学医学部,国家标准啮齿类动物饲料,合笼饲养,自由饮食,室温20-25℃,相对湿度30-50%,保持12小时光照。
1.2 研究方法
1.2.1实验法
1.2.1.1实验原理
实验原理依据耿彬等[10]研究结论:体液内H2S主要以两种形式存在,即物理溶解的H2S气体(约占1/3)及化学形式存在的H2S(约占2/3),其化学特性呈弱酸性,在强酸条件下,HS-与H+结合生成H2S(公式1),从体液中挥发,但物理溶解部分不能析出,在强碱条件下,H2S和HS-与OH-结合形成比较稳定的S2-(公式2,3),采用第三硫电极可以精确测量溶液中S2-的浓度,利用这一原理,我们采用第三硫电极,测定溶液中S2-,间接反映H2S的浓度[2,3]。公式1:HS-+H+→H2S;公式2:2HS-+2OH-→S2-+2H2O;公式3:2H2S+2OH-→S2+2H2O。
1.2.1.2仪器与试剂
仪器:小型三用水浴箱(北京西城区医疗器械厂1505型)。精密酸度计(上海理达仪器厂PHS-2C型),银硫离子选择性电极 (上海雷磁仪表仪器有限公司pAgS-1型),硫酸亚汞参比电极(上海雷磁仪表仪器有限公司C(K2SO4)-1型)。离心机(80-2 离心沉淀器)。
试剂:5’-磷酸吡哆醛为Fluka产品;其余试剂均为国产分析纯试剂。
1.2.1.3指标测试与方法
测试样本的采集与处理:(1)大鼠称重,实验组行游泳力竭运动,力竭判断标准[4,5]:大鼠挣扎动作消失,沉入水下大于10S,捞出后平放无法完成翻正反射。(2)实验组力竭后先行用2%戊巴比妥钠按0.25ml/100g体重腹腔注射麻醉,腹主动脉取血后,速取左侧腓肠肌、心脏(去除结缔组织);肝脏,脑组织,肺脏,肾脏,用锡纸包叠、标记后冻存待测。对照组直接进行步骤(2)处理。
称取各个组织样品,迅速剪碎后放入玻璃匀浆器中,以1:9(W/V)的比例加入匀浆液进行匀浆。匀浆液为50mmol/L磷酸钾缓冲液(K2HPO4·3H2O,KH2PO4,pH6.8)。离心,取上清保存待测。
1.2.1.4组织硫化氢生成酶活性的测定
抗氧化液配制:氢氧化钠(NaOH)8g,乙二胺四乙酸二钠(EDTA)7g,去离子水85ml,抗坏血酸10g。要求现用现配。标准S2-溶液配制:硫化钠(Na2S·9H2O) 0.2402g,去离子水1ml,配制成1mol/L标准溶液,再加入等量抗氧化液。要求现用现配。
离子测定程序:①使用前,先将银硫电极浸入去离子水中活化4h左右,再用抗氧化液活化90min左右;②打开酸度计电源,将测定项调至mV档 ,预热15min以上;③将敏感银硫电极与参比电极一起浸入样品中,待读数稳定后记录;④用去离子水冲洗电极;⑤每测一个样品结束,电极必须浸入去离子水中以保持其活化状态;⑥每次测定前均应使用标准S2-溶液用抗氧化液稀释成所需浓度做标准曲线。
(1)大鼠冻存组织0.2g,以1:9(质量体积比)用预冷的50mmol/l磷酸钾缓冲液(PH=6.8)1.8ml在手动匀浆器制备10%(W/V)组织匀浆。离心机离心,取上清液。(2)取组织匀浆液和反应液加入反应瓶:(总反应体积的终浓度:100mmol/l磷酸钾缓冲液(PH=7.4)、2mmol/l左旋半胱氨酸、2mmol/l磷酸吡哆醛)
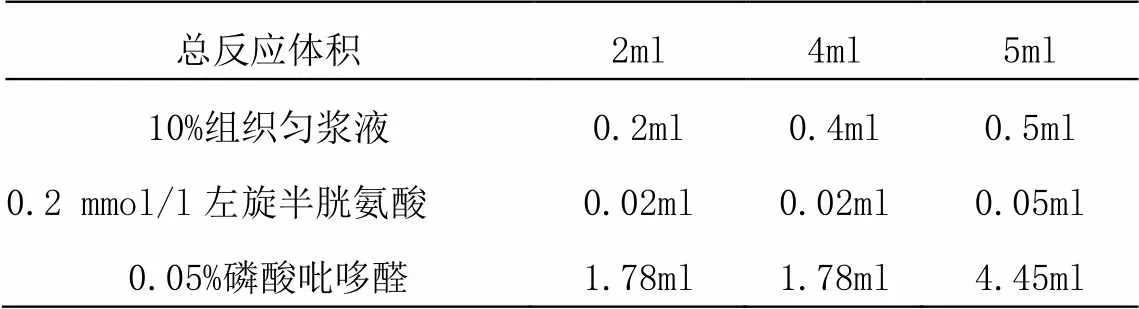
总反应体积2ml4ml5ml 10%组织匀浆液0.2ml0.4ml0.5ml 0.2 mmol/l左旋半胱氨酸0.02ml0.02ml0.05ml 0.05%磷酸吡哆醛1.78ml1.78ml4.45ml
(3)反应瓶中小烧杯内加入0.5ml 1mol/L NaOH,用双层石蜡膜迅速封口;(4)应瓶置于37℃水浴箱孵育90min;(5)揭开石蜡膜,加入0.5ml 20%三氯乙酸,迅速封口,37℃水浴孵育60min终止反应;(6)取出小烧杯内液体用敏感硫电极法测定溶液中的H2S含量;(7)采用酸度计测定溶液中的电压(mV)值;(8)利用标准曲线(使用标准S2-溶液用抗氧化液稀释成40、80、100、1000、10000µmol/L溶液做标准曲线)计算S2-浓度,再计算H2S生成酶,结果以nmol/min·mg(protein)表示。
1.2.1.5组织硫化氢含量的测定
抗氧化液配制、标准S2-溶液配制、离子测定程序如前述。(1)取上述10%组织匀浆液0.5ml加入反应瓶(100ml锥形瓶,其中放置一个5ml小烧杯);(2)加入0.5ml 1mol/L HCl,使组织H2S释放;(3)反应瓶中小烧杯内加入0.5ml 1mol/L NaOH,以吸收H2S,用双层石蜡膜迅速封口;(4)将反应瓶置于37℃水浴箱孵育4h;(5)取出小烧杯内液体,加入0.5ml抗氧化液;(6)采用酸度计测定溶液中的电压(mV)值;(7)利用标准曲线(使用标准S2-溶液用抗氧化液稀释成1、10、20、40、80、100µmol/L溶液做标准曲线)计算S2-浓度。组织H2S含量以nmol/mg(protein)表示。
1.2.1.6血浆硫化氢浓度的测定
(1)取血浆1ml,加入等体积的抗氧化液;(2)采用离子计测定S2-含量;(3)具体操作:将敏感硫电极与参比电极一起浸入样品中,待读数稳定后记录测定值,然后根据S2-溶液标准曲线计算硫化氢含量。H2S含量以nmol/mg(protein)表示。
1.2.2数理统计法:利用SPSS软件对数据进行统计分析。
2 结果与分析
2.1 敏感硫电极法标准曲线
S2-浓度在100-1000nmol/l之间浓度值与硫电极所测电压值呈线形相关性(图1-1),所得方程为
y=-0.034x2+74.663x-42633, R2=0.9619
S2-浓度在1-100µmol/L之间浓度值与硫电极所测电压值呈明显对数相关性(图1-2),所得方程为
y=34.505 Ln(x)+963.63, R2=0.9847.
S2-浓度在40-10000µmol/L之间浓度值与硫电极所测电压值呈明显对数相关性(图1-3), 所得方程为
y=13.861Ln(x)+1048.6, R2=0.9956

图1-1 敏感硫电极所测标准曲线:S2-浓度在100-1000nmol/l之间呈线形相关
图1-2 敏感硫电极所测标准曲线:S2-浓度在1~100µmol/L之间呈明显对数相关
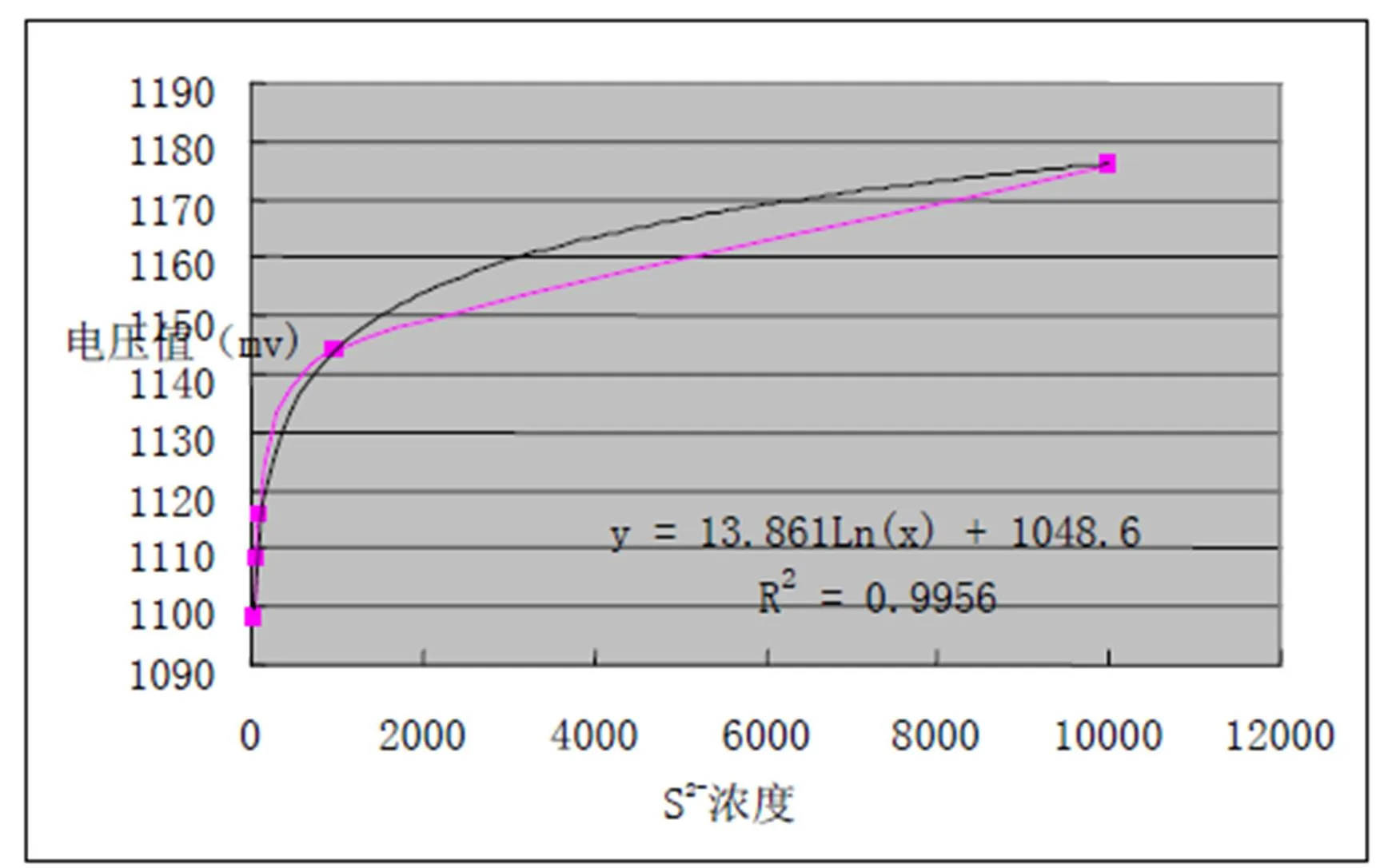
图1-3 敏感硫电极所测标准曲线:S2-浓度在40~10000µmol/L之间呈明显对数相关
2.2 各组大鼠各系统H2S生成酶与含量比较
表1 大鼠运动前后不同组织硫化氢含量与生成酶活性均数
大鼠各硫化氢生成酶活性均数(nmol/min·mg)硫化氢含量(nmol/mg) 系统对照组运动组比值对照组运动组比值 骨骼肌0.0790.14179%↑0.4362.843552.2%↑ 脑组织0.1370.134基本持平0.4480.0371120.9%↓ 肝脏8.61414.27765.7%↑0.0590.580889.9%↑ 肺脏0.0070.1632254.4%↑0.0400.05227.9%↑ 肾脏3.2364.49538.9%↑0.3991.825357.2%↑ 心脏0.0360.277662.7%↑0.6785.422700%↑ 血浆 0.0100.100900%↑
3 分析与讨论
文献报道[6,7],运动改善血管的舒张反应性与硫化氢有密切关系。运动训练可以使硫化氢生酶基因转录活性增强造成硫化氢含量升高;内源性产生的硫化氢可以通过开放平滑肌细胞上KATP通道舒张血管平滑肌,从而抑制血管平滑肌细胞的增殖反应, 抑制血小板粘附聚集等。利用运动训练可以延缓某些心血管疾病的发生和发展,而且对这些疾病也有一定的治疗作用,尤其是在血管的保护和改善方面具有重要意义[8]。本实验结果显示, 运动可以刺激硫化氢生成酶活性上调,并相应增加硫化氢的生成量。已知NO可增加H2S的舒张血管效应和产量[9],大鼠内源性H2S在运动后的升高可能与NO有关。而一次性大强度运动可使内源性NO生成量升高[10],从而使H2S生成酶活性升高进而使H2S含量升高。运动引起H2S/生成酶系统活性上升的机制可能与运动提高了血流对血管壁产生的剪切应力有关,它增加了一氧化氮合酶的活性。有报道称运动使血流对血管壁产生的剪切应力增大同时也使硫化氢生成酶活性提高[11],但究竟是剪切应力通过增加一氧化氮合酶的活性而使一氧化氮含量升高进而造成硫化氢生成酶活性升高,还是剪切应力的增大直接使硫化氢生成酶活性升高?文献中并没有注明,我们不得而知。一次性大强度运动可明显影响各组织代谢酶活性,目前公认的结论是:一次性大强度运动可增加各个组织无氧代谢酶活性,如乳酸脱氢酶(LDH)活性,从而提高组织无氧代谢能力。对H2S调节机体代谢的研究结果显示,机体吸入生理剂量H2S后,骨骼肌LDH活性增加,由此提出:硫化氢增加人体在运动过程中无氧代谢的能力,提高机体的适应能力。本研究发现,一次性大强度运动后各组织H2S/生成酶系统活性上升,这一变化特点正好与大强度运动使机体无氧代谢酶活性增高相同。推测一次性大强度运动使机体无氧代谢酶活性的升高与H2S/生成酶系统活性的上升有着必然联系,或者说:H2S/生成酶系统活性上调从而使组织无氧代谢酶活性升高进而提高组织无氧代谢能力。
Martin[12]等对18名受试者,其中健康组6人(未从事任何锻炼),一般运动组6人,运动组6人(加拿大奥运划船选手)进行两种形式的运动:递增力竭运动,保持不同功率值的运动,检测运动前后NO呼出量变化,结果表明,运动时运动员组内源性NO呼出量明显高于其他两组,且这种NO量增加与VO2及心率密切相关。因为内源性硫化氢和内源性一氧化氮性质相似且NO与H2S的生成关系密切,可以推测内源性H2S量的增加与VO2及心率有着必然联系。虽然此推测无法从根本解释运动前后大鼠各个器官系统硫化氢含量变化的原因,但通过绘制硫化氢含量与这些指标的关系曲线,找出两者之间的相关性。此可作为以后检测内源性H2S含量的简易方法。
NO是一种内源性血管舒张因子,可以调节内皮细胞、平滑肌细胞和神经细胞的功能,同时参与低氧时细胞内某些低氧敏感基因表达的调节。H2S与NO具有相似的生物学特性,两者既相互独立又相互影响,在机体内形成一个复杂的调控网络。Patil[13]等研究表明,急性运动可引起机体分泌NO增多,并引起冠状动脉及其它血管的舒张,增加心肌、骨骼肌的血流量。本实验结果发现,一次性大强运动使各个系统(脑组织除外)硫化氢含量有明显的升高。
NO和H2S之间的作用是协同还是拮抗?我们现在能肯定的是不同的运动方式这两种气体信号分子之间的相互作用不尽相同[11]。一次性大强度运动NO和H2S之间表现为协同作用。Zhao[7]通过实验证实,NO可以与H2S协同发挥舒血管效应。研究表明[14],NO 的供体硝普钠可以剂量依赖性地上调内源性H2S的生成,应用鸟苷酸环化酶的抑制剂ODQ 后,再应用硝普钠,内源性H2S的生成量明显降低,因而推测这种上调效应可能是通过 cGMP(cyclic guanosine monophosphate, 环鸟苷酸)途径实现的。
运动后大鼠脑组织硫化氢含量为什么不升反降?对于此现象的解释也与NO有紧密联系:脑组织中的NO合酶为诱导型(inducibleNOS,iNOS)iNOS诱导合成需4-8小时[15],如果时间达不到,iNOS还未合成NO不可能增多。而大鼠脑组织中的硫化氢生成酶胱硫醚-β-合酶(CBS)也有类似于iNOS性质—合成需要一定时间。此实验是运动后即刻取样测定,从前表即可看出硫化氢酶的含量基本没有变化,所以硫化氢的含量不可能升高。它为何大幅度降低的原因可能是运动后循环加快将原有的硫化氢通过血液循环代谢并清除。
本次研究发现,运动组大鼠各组织H2S含量H2S含量及其生成酶活性变化一致。提示本实验运动模式是通过改变H2S生成酶活性来提高或降低H2S的产生和释放。一次性大强度运动使大鼠脑组织硫化氢含量有大幅度降低,而使其他各组织硫化氢含量有不同程度的提高。(详见图2-1,2-2)。

图2-1
图2-2
一次性大强度运动除使大鼠脑组织硫化氢生成酶活性略有降低外,其余各组织均有不同程度的升高(图2-3,2-4)。
4 小结
敏感硫电极法测量范围广,敏感性强,稳定性和重复性均良好,可应用于大鼠脑,心脏,肾脏,肝脏,肺,骨骼肌H2S测定的研究。但在测试血浆H2S含量时精确度略显不够。经一次性大强度运动后,与对照组相比大鼠心脏,肺脏,肝脏,肾脏,骨骼肌器官的H2S/生成酶体系均有不同程度的提升。推测由于运动使内源性一氧化氮升高从而造成H2S/生成酶体系的升高。由于一次性大强度运动可增加各个组织无氧代谢酶活性,推测一次性大强度运动使机体无氧代谢酶活性的升高与H2S/生成酶系统活性的上升有着必然联系。大鼠运动后脑组织H2S/生成酶系统活性降低的原因还不是十分清楚,推测测定时大鼠脑组织中的硫化氢生成酶CBS还未合成。大鼠血浆硫化氢浓度变化趋势同大鼠其它组织,验证了血管平滑肌CSE在大鼠运动后的表达同其它各组织。

图2-3
图2-4
[1] 耿彬,杜军保,唐朝枢.敏感硫电极法在测定心血管组织细胞及血浆胱硫醚一γ一裂解酶/硫化氢的应用[J]. 北京大学学报( 医学版 ),2005,37(5):545-548.
[2] 杨昕,黄秀榕,祁明信.内源性硫化氢:一种新型气体信息分子[J].广州医学院学报,2005,33(2):65-68
[3] 耿彬,唐朝枢.内源性硫化氢-心血管功能调节的新型气体信号分子. [J]. 北京大学学报( 医学版 ),2002,33(3):255-259.
[4]Thomas DP,Marshall KI.Effects of repeated exhaustive exercise on myocardial subcellular membrance structures[J].Int J sports Med,1988,9(4):257-260.
[5]Ahmet Yildiz,Ercan Ozdemir.The effects of creatine long-term supplementation on muscle morphology and swimming performance in rats[J].J Sports Sci&Med,2009,8(4):516-522.
[6]Bhambhani Y, Singh M. Physiological effects of hydrogen sulfide inhalation during exercise in healthy men[J].Journal of Applied Physiology,1991, 71(5):1872-1877.
[7] Zhao W, Zhang J, Lu Y, et al. The vasorelaxanteffect of H2S as a novel endogenous gaseous KATP channelopener[J]. EMBO J, 2001,20(21):6008-6016.
[8]卢开信,黄叔怀.不同运动负荷对大鼠主动脉平滑肌HO -CO 系统的影响[J].中国运动医学杂志,2002,21(6):570-573.
[9] Hosoki R, Matsuki N, Kimura H. The possiblerole of hydrogen sulfide as an endogenous smooth musclerelaxant in synergy with nitric oxide. Biochem BiophysRes Commun, 1997, 23(7):527-531.
[10]任文君,张斌南,宇文展,等.不同运动方式对大鼠骨骼肌NO含量及NOS活性的影响[J].中国体育科技,2009,29(1):66-71.
[11] Wagner CT, Durante W, Christodoulides N , et al.Hemodynamic forces induce the expression of hemeoxygenase in cultured vascular smooth muscle cells[J].Clin Invest , 1997 , 100(3) :589 - 596.
[12]Martin J. Physical Conditioning and Nitric OxideProduction During Exercise[D]. Montreal:Department ofPhysical Education of McGill University(MD),1995:1-46.
[13] Patil RD, Dicarlo SE, Collins HL. Acute exerciseenhances nitric oxide modulation of vascular responseto phenylephrine[J]. Am J Physiol, 1993,(265):1184-1188.
[14] 姚素芬,高军, 宋广斗,王长轩,刘薇,冯霞,陆景丽.运动训练对高血压患者血压、内源性一氧化氮及内皮素的影响[J]. 中国康复医学杂志,2004,19(4):258-259.
[15]张爱芳等.实用运动生物化学[M].北京:北京体育大学出版社,2005,343-345.
Comparative Analysis of Hydrogen Sulfide Content in Rats before and after Exercise
JIN Chen, etal.
(Training Authority of General Administration of Sport of China, Beijing 100061, China)
[Purpose]:This study aims to rats before and after the determination of hydrogen sulfide found in various tissues and organs in vivo determination of sulfide The hydrogen content appropriate; After training in detection of hydrogen sulfide content in the blood and various organizations and various organizations generating activity. H2S content of the training, organization and analysis of activity generated the change. [Methods] :Male Sprague-Dawley rats for experiments by using sulfur electrode sensitive detection rat heart, kidney, lung, H2S content of the liver and other organizations, the results are analyzed and compared. Sixteen male Sprague-Dawley rats were randomly divided into two groups : control group , campaign group . Rats to do for a one-hour high-intensity load (10% weight) swimming. The heart was all the rats immediately after sports, kidney, lung, liver, brain, muscle, abdominal aortic blood analysis using sensitive electrodes measured the sulfur and hydrogen sulfide content generating activity. [Results] :Compared with the control group campaigned rat brain tissue in addition to hydrogen sulfide levels decreased significantly, H2S content of the campaign group of the organizations are significantly higher than the control group. Compared with the control group except campaigned rat brain activity generated H2S slightly lower, campaigning group generated H2S activity of the organizations have varying degrees of increase compared with the control group. especially in the heart and lungs are significantly increased. [Conclusions] :Sensitive to sulfur electrode wide measurement range, sensitivity, stability and reproducibility are good and can be used in rat brain, heart, kidney, liver, lung, muscle Determination of hydrogen sulfide. However, in testing at the plasma of hydrogen sulfide content is slightly insufficient precision. After one-time high-intensity exercise, compared with the control group of rat heart, lung, liver, kidney, H2S skeletal organ / enzyme systems have different levels of upgrading. Speculate as to enable movement of endogenous nitric oxide results in increased hydrogen sulfide / enzyme system increased. As a one-time high-intensity exercise can increase various organizations anaerobic metabolism activity, speculate one-time high-intensity anaerobic exercise so that the body's metabolic activity increased with the hydrogen sulfide / enzyme system activity is the rise necessarily related. Rat brain tissue H2S / weather enzyme system activity is the reason or not is not very clear, it is speculated in rat brain tissue formation of hydrogen sulfide CBS enzyme synthesis yet. Change in plasma of hydrogen sulfide rats is similar with the trend of other organizations, certificating that the expression of vascular smooth muscle CSE movement in rats is similar to that of other organizations.
campaign; hydrogen sulfide;sensitive to sulfur electrode
金晨(1984—),湖北大悟县人,在职研究生,康复师,研究方向:运动人体科学。

