Hes1对急性髓系白血病患者骨髓CD34+CD38-细胞的作用及其机制研究*
田 晨 贾勇圣 胡冬至 张翼鷟
Hes1对急性髓系白血病患者骨髓CD34+CD38-细胞的作用及其机制研究*
田 晨①贾勇圣②胡冬至③张翼鷟①
目的:研究Hes1对急性髓系白血病(AML)患者骨髓CD34+CD38-细胞的作用及其机制。方法:收集初治AML患者及正常供者骨髓样本后,通过密度梯度离心法获取单个核细胞,流式细胞术检测CD34+CD38-细胞比例及其细胞周期。通过免疫磁珠法分选CD34+CD38-细胞后,体外集落形成实验(CFC)检测其增殖能力,并通过Realtime PCR检测其Hes1的表达量。构建Hes1过表达逆转录病毒载体,感染正常供者骨髓CD34+细胞后,流式细胞术分析其细胞周期的改变,CFC检测其增殖的改变。结果:AML患者骨髓CD34+CD38-细胞比例明显低于正常对照,流式细胞术结果显示患者来源CD34+CD38-细胞大多数进入静止期,CFC结果显示患者CD34+CD38-细胞体外扩增能力下降。Realtime PCR结果发现患者CD34+CD38-细胞中Hes1表达上调。提高正常供者CD34+细胞中Hes1的表达后,细胞增殖减少,进入静止期。结论:在AML中CD34+CD38-细胞比例下降,进入静止期,与Hes1的表达上调有关。
AML白血病 CD34+CD38-细胞 Hes1 细胞周期 增殖
人急性髓系白血病(acute myeloid leukemia,AML)是一种白血病细胞恶性克隆增生性疾病[1-4]。其病因复杂,病毒因素、化学因素、放射因素、遗传因素均在白血病的发生发展中起重要作用。目前对于白血病的研究主要集中在白血病细胞,但是对于白血病环境下残余的正常造血干细胞(HSC)的功能变化及其机制未深入研究。
本课题组前期工作发现在过表达Notch1胞内段(intracellular domain of Notch1,ICN1)诱导的T-ALL白血病小鼠中,HSC进入静止期,体外扩增能力下降,而基因芯片筛选出一系列与细胞周期、增殖、粘附、归巢相关的基因并通过Realtime PCR验证。在功能实验中我们发现Hes1过表达可促进HSC进入静止期,从而阐明T-ALL小鼠HSPC功能改变的相关机制。鉴于前期动物实验结果,本文旨在研究Hes1在急性髓系白血病患者骨髓残余正常HSC中的作用及其机制。
1 材料与方法
1.1 材料
1.1.1 临床样本 收集2014年2月至2014年6月于天津医科大学肿瘤医院初治AML患者骨髓样本12例,正常供者骨髓样本4例。本研究均获得患者和健康者知情同意。
1.1.2 试剂与抗体 Trizol购于Invitrogen公司。小量细胞RNA提取试剂盒购于Qiagen公司。引物由华大基因有限公司合成。SYBR Green试剂盒购于ABI公司。逆转录病毒载体MSCV-Hes1-IRES-GFP及对照载体MSCV-IRES-GFP由中国医学科学院血液病研究所程涛教授赠送。PE-CD34 FITC-CD38抗体购于BD公司。Hoechst,PY(#P9172),7AAD(#A9400),维拉帕米购于Sigma公司。DAPI(#D1326),PI购于Invitrogen公司。BrdU试剂盒(APC荧光,Cat#552598)购于 BD Pharmingen。造血祖细胞体外克隆形成培养基(#M3434)购于Stemcell Technologies公司。
1.2 方法
1.2.1 流式细胞术分析 收集患者骨髓样本后,Ficoll密度梯度离心法获取单个核细胞,加入PE-CD34 FITC-CD38抗体各1 μL,室温孵育20 min,然后将细胞分为3份,其中一份用于流式细胞仪检测CD34+CD38-细胞比例。另一部分细胞加入BrdU染色,检测细胞增殖。第3份细胞加入Hoechst和PY,上流式细胞仪检测细胞周期。
1.2.2 体外CFC试验 混匀M3434培养基,按1 mL/孔加入24孔板。通过免疫磁珠法分选骨髓CD34+CD38-细胞后,重悬于DMED+10%FBS培养基,按9× 104个/孔接种于24孔板,100 μL/孔。于37℃,5%CO2饱和湿条件下培养10 d后,倒置显微镜下计数克隆数。
1.2.3 Realtime RT-PCR 收集患者骨髓样本后,Ficoll密度梯度离心法获取单个核细胞,经免疫磁珠法分选CD34+CD38-细胞后,提取RNA,逆转录成cDNA,检测Realtime PCR。循环参数如下:95℃,15s;60℃,60s,45个循环。引物序列为:上游5'-CTCCCGGCA TTCCAAGCTAG-3',下游5'-AGCGGGTCACCTCGTT CATG-3'。
1.2.4 Hes1过表达载体感染正常供者CD34+细胞 1)接种293T细胞于10 cm培养皿,在融合度达到90%左右时,更换4 mL新鲜培养基DEME/10%FBS。2)配质粒与lipo2000混合液。①30 μL lipo2000与500 μL OPTI-MEM培养基混合,室温静置5 min。②Hes1载体或空载体与VSVG、pKAT以2:1:1的量混合,加入500 μL OPTI-MEM培养基。③将①与②混合,室温静置20 min后按1 mL/皿加入,37℃,5%CO2培养6 h后换新鲜培养基。48 h后,收集病毒上清,感染免疫磁珠分选后的骨髓CD34+细胞。
1.3 统计学分析
2 结果
2.1 AML患者骨髓CD34+CD38-细胞比例明显下降
流式检测AML患者与健康供者骨髓单个核细胞中CD34+CD38-细胞比例,发现AML组(0.035%± 0.001%,n=12)明显低于对照组(0.06%±0.002%,n=4,P<0.05)。
2.2 AML患者骨髓CD34+CD38-细胞体外增殖能力下降
体外集落形成实验(CFC)可以检测造血干祖细胞向各造血细胞分化形成集落的增殖能力(图1)。免疫磁珠法分选患者及对照的骨髓CD34+CD38-细胞做CFC结果发现,患者来源CD34+CD38-细胞的体外集落形成低于对照来源,说明患者来源CD34+CD38-细胞的增殖能力下降(n=3,P<0.05)。

图1 患者来源CD34+CD38-细胞向各系分化形成的集落数少于对照Figure 1 CFC test results showed that the clone numbers of CD34+cells were lower in the AML group than in the control group
2.3 AML患者骨髓CD34+CD38-细胞状态
结果发现AML来源的CD34+CD38-细胞处于S期的细胞比例(14.5±0.6)%明显低于对照(26±0.92)%(n=3,P<0.05),而Hoechst/PY结果显示患者来源细胞处于G0期比例明显高于对照,说明患者来源CD34+CD38-细胞大多进入静止期(n=3,P<0.05,图2)。
2.4 AML患者骨髓CD34+CD38-细胞Hes1表达升高
因前期动物实验中发现T-ALL小鼠骨髓HSC中Hes1的表达升高,此与HSC进入静止期密切相关,而在AML患者中本研究也发现CD34+CD38-细胞大多进入静止期,因此接下来检测CD34+CD38-细胞中Hes1的表达量。Realtime PCR和Western结果均发现AML患者CD34+CD38-细胞Hes1表达高于对照(n=4,P<0.05,图3A,3B)。Hes1逆转录病毒载体与VSVG、pKAT共同包装293T细胞后,收集病毒上清,感染正常供者骨髓免疫磁珠分选后的CD34+细胞。通过Realtime PCR和western检测感染后Hes1的表达量(n= 3,P<0.05,图3C,3D)。
2.5 Hes1高表达抑制CD34+细胞集落形成
将感染后的Hes1-GFP+或blank-GFP+细胞分选出来,接种到M3434培养基做集落培养。于培养后第10天于显微镜下观察。结果发现,Hes1组的集落总数为(8±0.2)个,与对照组(50±2.3)个相比有明显差别(n=3,P<0.05)。
2.6 Hes1过表达促进CD34+细胞进入静止期
正常供者CD34+细胞感染Hes1后,Hoechst/PY法流式细胞术检测细胞周期,发现Hes1+CD34+细胞G0期比例增高,为(16±1.1)%,对照组为(8±0.9)%(n=3,P<0.05)。
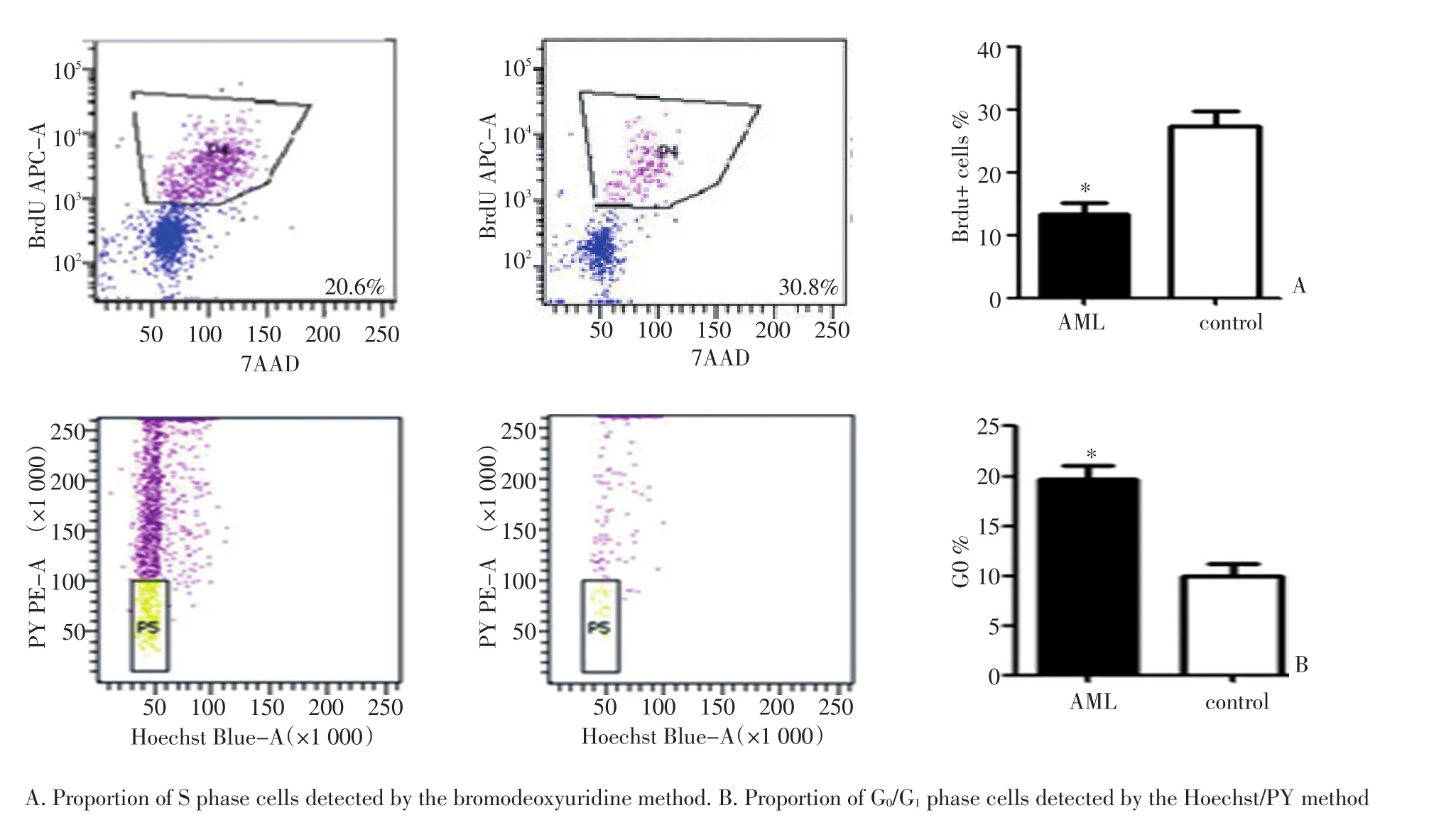
图2 骨髓CD34+CD38-细胞周期分析Figure 2 Cell cycle analysis of bone marrow CD34+CD38-cells

图3 Realtime PCR和Western检测Hes1的表达量Figure 3 Expression of Hes1 was tested through real-time polymerase chain reaction and Western blot
3 讨论
白血病是造血系统的恶性肿瘤[5],白血病细胞在骨髓和其他造血组织如脾中大量恶性增生,并浸润其他器官和组织,使正常造血遭到破坏,正常血细胞生成减少,患者出现贫血、血小板减少等症状,外周血白细胞发生质和量的异常[6]。因此研究白血病环境下正常造血干祖细胞(hematopoietic stem and progenitor cells,HSPCs)的数量及功能变化对白血病的发病及治疗都有极大意义。但是目前对白血病环境下正常造血干细胞的功能改变及相关机制尚无系统研究。Colmone等[11]发现在Nalm-6过表达引起的小鼠B-ALL白血病中,白血病细胞破坏了骨髓中的干细胞龛,并形成了异常的微环境,这种异常微环境能吸引正常HSC,从而影响HSC归巢。中和白血病细胞分泌的干细胞因子(stem cell factor,SCF)后,能阻止正常HSC迁移到白血病细胞形成的异常微环境,从而维持HSC的数量。这说明肿瘤微环境能破坏正常干细胞龛从而破坏HSPC的功能,阻止HSPC与肿瘤微环境发生关联的治疗能维持HSPC的数量。Yuan等[12]在P18-/-小鼠连续移植模型自发性T-ALL中,发现系列标记阴性(Lin-)c-Kit阳性(Lin-c-Kit+)细胞群,频率降低,几乎不能检测到LT-HSC。
Hes1是bHLH-HES分子家族的一员,是Notch通路下游的效应子。有报道[13]Hes1对淋系和髓系的发育有影响,其在造血细胞发育及某些恶性血液病发生中起重要作用[14]。据报道,Hes1基因参与细胞周期,能维持某些成体干细胞处于未分化的静止状态[7-10]。
免疫磁珠分选(MACS)系统可在临床上用于从外周血、骨髓或脐带血中分选人类干/祖细胞。MAC分选技术在富集CD34+细胞中显示出优越的性能,不仅能够高度纯化干祖细胞(平均纯度高达95%),还可以去除3~4个对数级的T、B细胞,以及在体外高效去除3~4个对数级的肿瘤细胞。因此本研究使用CD34+细胞作为人骨髓HSC的标记。
BrdU为胸腺嘧啶的衍生物,可代替胸腺嘧啶插入在DNA合成期(S期),而后利用抗BrdU单克隆抗体染色,可显示处于增殖期的细胞。Hoechst可直接结合细胞的DNA,经过紫外光激发后发出蓝色荧光。派洛宁(Pyronine,PY)为碱性染料,能与细胞内的DNA、RNA分别结合并呈现不同颜色。Hoechst/PY联合应用,可以检测处于G0期的细胞。造血干细胞分化形成各系造血祖细胞,这些祖细胞增殖分化形成各种成熟血细胞。体外集落形成实验(CFC)可以检测多能祖细胞和定向祖细胞包括红系、单核巨噬系、巨核系的增殖能力。因此CFC实验主要是获得产生集落细胞的发育阶段和分化潜能的信息。
本研究发现在AML患者中,CD34+CD38-细胞比例明显下降,体外集落形成能力也下降,细胞周期分析发现更多的CD34+CD38-细胞进入静止期,增殖受到抑制。Realtime PCR和Western结果发现CD34+CD38-细胞Hes1的表达升高,提示Hes1可能在CD34+CD38-细胞的细胞周期中起作用。因此将过表达Hes1的逆转录病毒载体感染CD34+细胞进行功能验证,结果发现Hes1过表达可促进CD34+细胞进入静止期,从而验证在AML患者CD34+CD38-细胞进入静止期与Hes1有关的假说。
1 Notta F,Mullighan CG,Wang JC,et al.Evolution of human BCR-ABL1 lymphoblastic leukaemia-initiating cells[J].Nature, 2011,469(7330):362-367.
2 Coskun S,Hirschi KK.Establishment and regulation of the HSC niche:Roles of osteoblastic and vascular compartments[J].Birth Defects Res C Embryo Today,2010,90(4):229-242.
3 Warr MR,Pietras EM,Passegué E.Mechanisms controlling hematopoietic stem cell functions during normal hematopoiesis and hematological malignancies[J].Wiley Interdiscip Rev Syst Biol Med, 2011,3(6):681-701.
4 Chatterjee S,Dutta RK,Basak P,et al.Alteration in marrow stromal microenvironment and apoptosis mechanisms involved in aplastic anemia:an animal model to study the possible disease pathology [J].Stem Cells Int,2010,2010:932354.
5 Notta F,Mullighan CG,Wang JC,et al.Evolution of human BCR-ABL1 lymphoblastic leukaemia-initiating cells[J].Nature, 2011,469(7330):362-367.
6 Ladipot T,Sirard C,Vormoor J,et al.A cell initiating human acute myeloid leukemia after transplantation in SCID mice[J].Nature, 1994,367(6464):645-648.
7 de Jonge HJ,Valk PJ,Veeger NJ,et al.High VEGFC expression is associated with unique gene expression profiles and predicts adverse prognosis in pediatric and adult acute myeloid leukemia[J]. Blood,2010,116(10):1747-1754.
8 Vandercappellen J,Van Damme J,Struyf S.The role of CXC chemokines and their receptors in cancer[J].Cancer Letters,2008,267(2):226-244.
9 Kaklamani VG,Sadim M,Hsi A,et al.Variants of the adiponectin and adiponectin receptor 1 genes and breast cancer risk[J].Cancer Res,2008,68(9):3178-3184.
10 Nakayama J,Yamamoto M,Hayashi K,et al.BLNK suppresses pre-B-cell leukemogenesis through inhibition of JAK3[J].Blood, 2009,113(7):1483-1492.
11 Colmone A,Amorim M,Pontier AL,et al.Leukemic Cells Create Bone Marrow Niches That Disrupt the Behavior of Normal Hematopoietic Progenitor Cells[J].Science,2008,322(5909):1861-1865.
12 Yuan Y,Yu H,Boyer JM,et al.Hematopoietic stem cells are not the direct target of spontaneous leukemic transformation in p18INK4c-nu ll reconstituted mice[J].Cancer Res,2006,66(1):343-351.
13 Hu X,Shen H,Tian C,et al.Kinetics of normal hematopoietic stem and progenitor cells in a Notch1-induced leukemia model[J]. Blood,2009,114(18):3783-3792.
14 Tian C,Zheng G,Cao Z,et al.Hes1 mediates the different responses of hematopoietic stem and progenitor cells to T cell leukemic environment[J].Cell Cycle,2013,12(2):322-331.
(2014-10-06收稿)
(2014-10-24修回)
(本文编辑:郑莉)
Effect of Hes1 on bone marrow CD34+cells in acute myeloid leukemia
Chen TIAN,Yongsheng JIA,Dongzhi HU,Yizhuo ZHANG
Yizhuo ZHANG;E-mail:yizhuozhang111@163.com
1Department of Hematologic Oncology,2Department of Breast Cancer,and3Department of Colorectal Neoplasm,Tianjin Medical University Cancer Institute and Hospital,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China
This work was supported by the National Natural Science Foundation of China(No.31301161)and the Tianjin Application Basis and Technology Research Program(No.13JCYBJC22800)
Objective:To determine the effect of Hes1 on bone marrow CD34+cells in acute myeloid leukemia(AML).Methods:Bone marrow mononuclear cells were isolated by using Ficoll.Then,the proportion and cell cycle of CD34+cells were analyzed by using fluorescence-activated cell sorting(FACS).CD34+cells were cultured in vitro for colony-forming cells(CFC).The expression of Hes1 in CD34+cells was evaluated by using real-time polymerase chain reaction.After upregulating the expression of Hes1 in CD34+cells,the cell cycle was analyzed through FACS,and the colony formation of CD34+Hes1+cells was analyzed by CFC.Results:The ratio of CD34+cells in the bone marrow was lower in the AML group than in the control group.In addition,more CD34+cells underwent quiescence in the AML group than in the control group.In vitro assay showed that the colony formation of CD34+cells was lower in the AML group than in the control group.The expression of Hes1 was higher in the CD34+cells from the AML patients than that in the CD34+cells from normal donors.After Hes1 transduction,more CD34+cells underwent quiescence and showed weak proliferation.Conclusion:The proportion of CD34+cells in the bone marrow was lower in AML patients than in normal donors.A large proportion of CD34+cells underwent quiescence,which was related to Hes1,inAML patients.
T-ALL,CD34+CD38-cell,Hes1,cell cycle,proliferation

10.3969/j.issn.1000-8179.20141339
①天津医科大学肿瘤医院血液科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津市300060);②乳腺内科;③结直肠肿瘤科
*本文课题受国家自然科学基金(编号:31301161)和天津市应用基础与前沿技术研究计划(编号:13JCYBJC22800)资助
张翼鷟 yizhuozhang111@163.com
田晨 专业方向为血液肿瘤基础与临床。
E-mail:tcgirl2001@sina.com

