转录因子Sp1表达与肝癌临床病理特征及预后的关系*
潘 奇 朱 凯 陈万勇 张巨波 孙惠川 王 鲁 任 宁
·临床研究与应用·
转录因子Sp1表达与肝癌临床病理特征及预后的关系*
潘 奇 朱 凯 陈万勇 张巨波 孙惠川 王 鲁 任 宁
目的:通过研究肝癌组织内转录因子Sp1的表达及其与肝癌患者临床病理特征及预后的关系,探讨转录因子Sp1作为肝癌预后预测指标的可行性。方法:对98例根治性切除术的肝细胞肝癌肿瘤组织芯片进行免疫组化检测Sp1的表达情况,分析其与肝癌患者临床病理特征及预后之间的关系。结果:免疫组化结果显示Sp1在肝癌组织中表达明显高于对应正常肝脏组织,在有微血管侵犯的患者中升高尤其明显。进一步分析显示Sp1表达与肝癌患者术后总体生存率呈负相关,而与肝癌患者术后复发率呈正相关。结论:转录因子Sp1在肝癌中明显高表达,可作为肝癌患者预后的独立预测指标。
肝细胞肝癌 转录因子Sp1 预后指标 组织芯片
肝细胞肝癌(hepatocellular carcinoma,HCC)是最常见的肝脏恶性肿瘤,是世界范围内主要的健康问题之一[1-2]。尽管外科切除和肝移植为治愈肝癌提供了一定的机会,但由于复发和转移率较高,肝癌的预后仍不理想[2]。因此,寻找能指导预后和作为治疗靶点的分子标记对肝癌的治疗非常重要。转录因子Sp1是序列特异性的DNA结合蛋白[3],在多种肿瘤中表现为异常表达和活化,并参与调控肿瘤细胞增殖、侵袭、血管生成等多种生物学功能[4]。本研究通过对含98例根治性切除术后肝细胞肝癌患者肿瘤组织芯片进行免疫组化分析Sp1的表达情况及其与肝癌患者临床特征之间的关系,探讨Sp1在肝癌中的表达差异及作为肝癌术后预后预测指标的可行性。
1 材料与方法
1.1 病例资料
本实验使用了含98例肝细胞肝癌患者肿瘤及正常肝脏组织的组织芯片。患者为1999年5月到2002年12月间复旦大学附属中山医院肝外科收治的98例原发性肝细胞肝癌患者,均接受了同一治疗组肝脏肿瘤根治性切除手术。患者术前均无远处转移,肝功能均为Child-Pugh A,诊断均经过病理证实。具体的临床病理特征见表1。肿瘤分期按照2010年国际抗癌联盟TNM分期标准。本研究由复旦大学附属中山医院研究伦理委员会审核批准,并经过研究对象或其家属知情同意。最近随访时间为2013年6月15日,中位随访时间为44(2.0~144.0)个月。
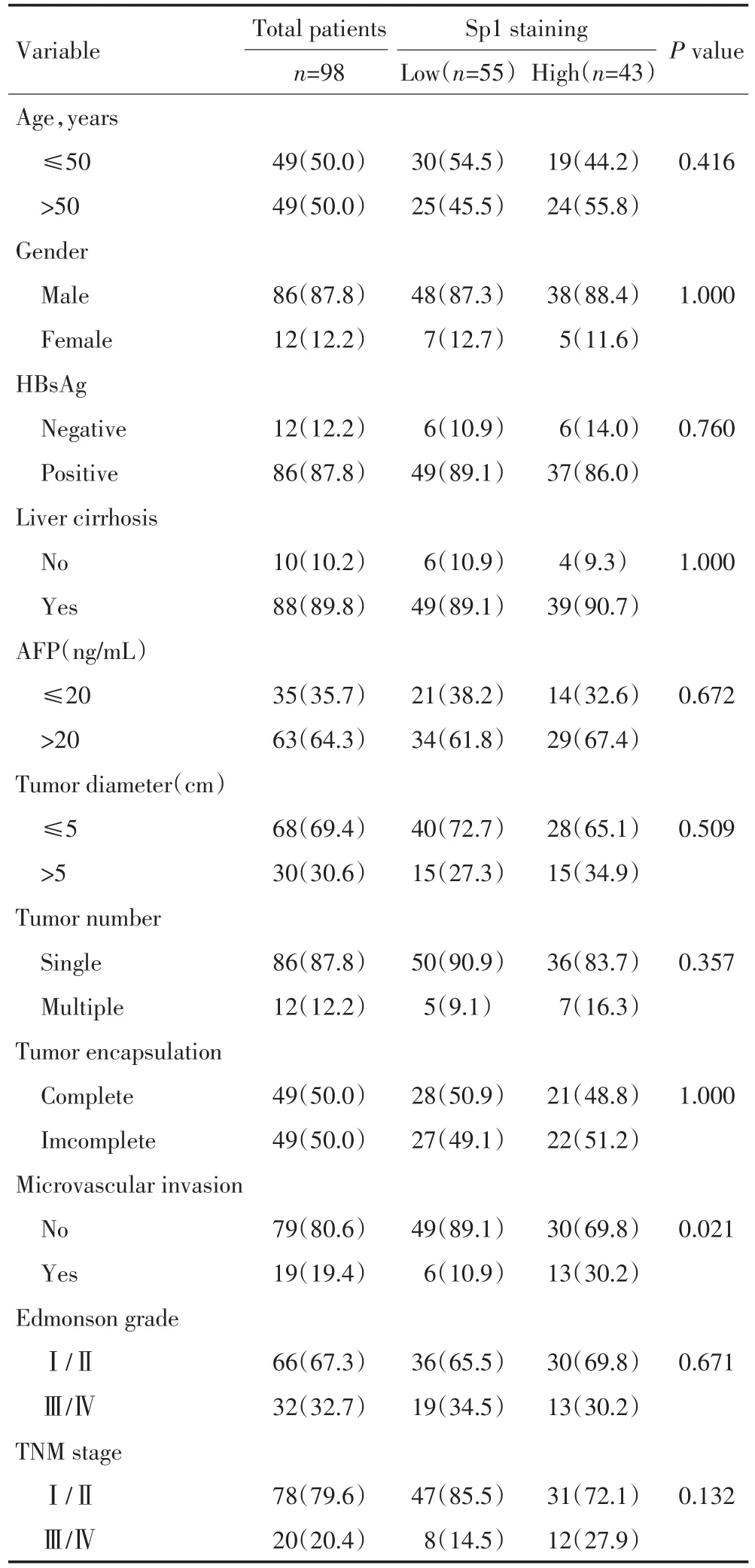
表1 Sp1表达与肝癌肝癌患者临床病理特征的关系 n(%)Table 1 Relationship between Sp1 expression and clinicopathologic features of HCC in patients with HCC
1.2 主要的试剂和设备
抗体:大鼠抗人Sp1(PEP2,sc59)多克隆抗体,为美国Santa Cruz公司产品;HRP标记的羊抗大鼠IgG,为上海康成生物公司产品。
1.3 实验方法
1.3.1 免疫组织化学染色 将上述含98例肝细胞肝癌患者肿瘤及正常肝脏组织的组织芯片行免疫组织化学染色,组织切片二甲苯脱蜡,梯度酒精水化,置入3%过氧化氢溶液中,室温孵育10 min,消除内源性过氧化物酶活性,置入pH=6.0的柠檬酸溶液中,放入高压锅中煮沸,冷却至室温,取出切片,用PBS溶液浸洗3 min×3次。将切片用5%胎牛血清封闭,室温15 min。甩去血清,向切片滴加一抗,4℃冰箱孵育过夜。PBS浸洗5 min×3次,向切片滴加二抗,室温孵育15 min,PBS浸洗3 min×3次。向切片滴加链霉素抗生物素-过氧化物溶液(D剂),室温下孵育10 min,PBS浸洗3 min×3次。滴加新鲜配制的DAB显色液,显微镜下控制显色时间,自来水浸洗中止显色,苏木素复染2 min,自来水浸洗,盐酸酒精分化5 s,自来水水洗返蓝20 min。梯度酒精脱水,二甲苯透明。中性树胶封片,拍照观察。
1.3.2 结果判定 Sp1阳性染色定位于细胞核内,采用集成光学密度测定阳性染色强度。染色强度分为高低两组(以平均吸光度[median integrated optical density,mIOD]为分界点,Sp1High为IOD>mIOD,Sp1Low为IOD≤mIOD)。
1.4 统计学处理
利用SPSS 17.0(SPSS,Chicago,IL)进行统计分析。Sp1表达情况与其他临床病理特征之间关系用Pearson卡方检验验证。总生存期(overall survival,OS)定义为肝癌切除与死亡之间间隔时间,至复发时间定义为肝癌切除与影像学证实的复发/转移之间间隔时间。绘制总生存和复发的Kaplan-Meier生存曲线,并对其进行Log-rank检验。用单因素和多因素分析研究各因素对预后的影响。P<0.05为有统计学意义。
2 结果
2.1 转录因子Sp1在肝癌组织中表达明显高于对应正常肝脏组织
为了分析转录因子Sp1在肝癌组织的表达情况,选取98例根治性切除术后肝细胞肝癌患者肿瘤及正常肝脏组织,制成组织芯片,行免疫组织化学染色,免疫组织化学染色结果显示Sp1蛋白定位于肿瘤及正常肝组织的细胞核内,按Sp1蛋白染色强度分为高表达组(Sp1 high)43例和低表达组(Sp1 low)55例,分别占43.9%(43/98)和56.1%(55/98)。Sp1在肝癌组织中的表达明显高于对应癌旁正常肝脏组织,两者具有明显的统计学差异(P<0.01)。
2.2 Sp1在肝细胞癌组织中阳性表达与肝癌临床病理特征的关系对98例根治性切除术后肝细胞肝癌患者肿瘤及正常肝脏组织进行多因素分析发现,影响总生存率的因素包括:有无肝硬化、肿瘤大小、有无微血管侵犯、TNM分期以及Sp1表达情况;影响肿瘤复发率的因素包括:是否感染乙肝以及Sp1表达情况。采用
Pearson卡方检验进一步分析Sp1过表达与肝癌临床病理特征的关系,结果显示Sp1表达与其他因素如年龄、性别、肝硬化、血清AFP、肿瘤大小或有无包膜之间无显著性关系,仅与微血管侵犯密切相关(P= 0.021,表1)。这些结果提示在有微血管侵犯的患者中,肿瘤组织更容易高表达Sp1。
2.3 Sp1过度表达与肝癌术后预后的关系
应用Kaplan-Meier生存曲线研究Sp1表达与肝癌术后患者预后的相关性,采用复诊登记和电话咨询等获取随访信息,以手术日期为随访开始时间,最后随访时间为2013年6月15日,中位随访时间为44(2.0~144.0)个月。因肝癌复发或转移导致死亡为终点时间,持续生存或因其他原因死亡视为截尾事件。98例患者均获得随访资料,Kaplan-Meier生存曲线分析显示Sp1 high组的总生存率明显低于Sp1 low组(P<0.05),而肝癌肿瘤复发率Sp1 high组则明显高于Sp1 low组(P<0.01,图1)。多因素分析显示对于总生存和复发,Sp1表达是肝癌预后的重要影响因素(表2)。
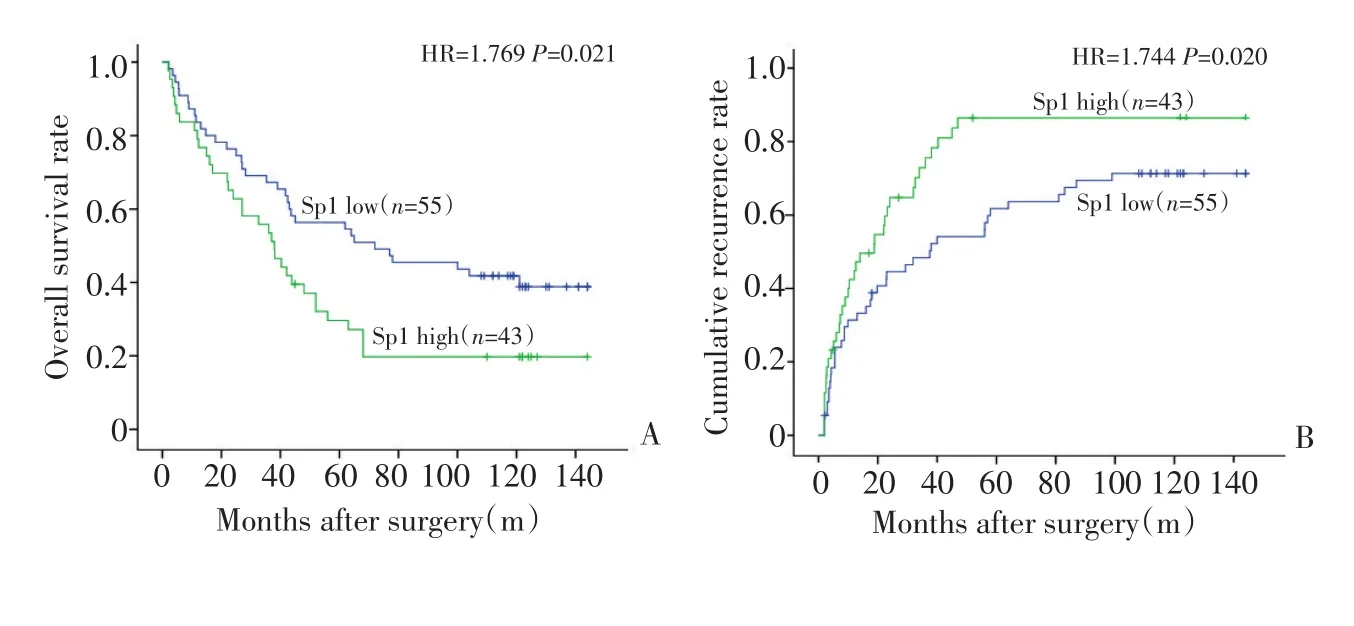
图1 Kaplan-Meier生存曲线显示,Sp1表达升高的患者,OS(A)更短,复发率(B)更高Figure 1 Kaplan-Meier survival curves showing patients with increased expression of Sp1 had shorter OS(A)and higher recurrence rate(B)
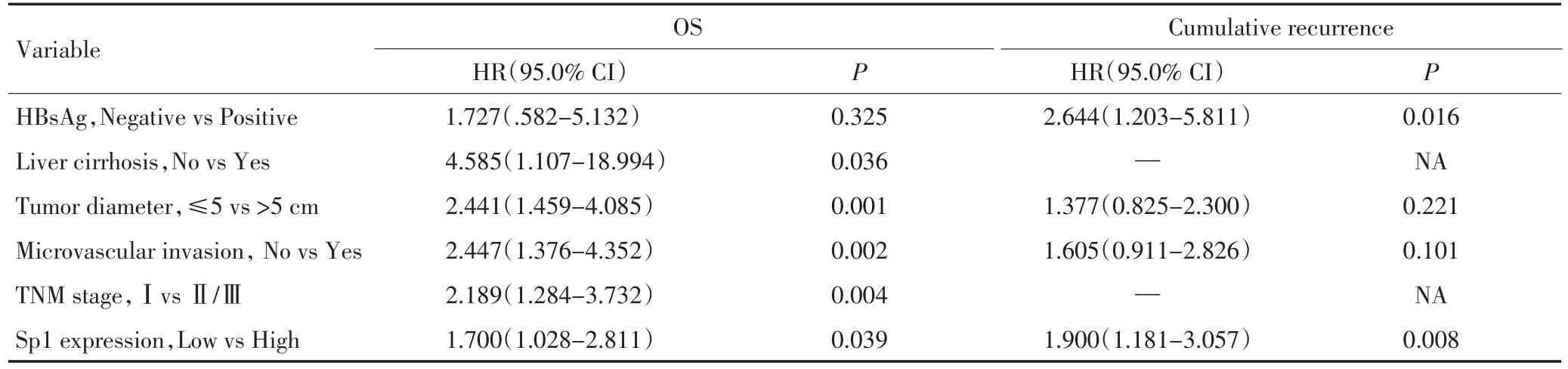
表2 患者总生存期和肿瘤复发的多因素回归分析Table 2 Multiple regression analysis of factors of patients with overall survival and tumor recurrence
3 讨论
原发性肝癌是一种病死率很高的恶性肿瘤,是世界第三位、中国第二位的肿瘤死亡原因[1]。手术治疗仍是目前肝癌最有效的治疗方法,但由于术后复发和转移率较高,肝癌的预后仍不理想[2]。因此,寻找能指导预后的分子标记对肝癌的治疗非常重要。转录因子Sp1是一种序列特异性的DNA结合蛋白[3]。Sp1可能是肿瘤发展、增殖和转移的主要调控因子。一些研究表明转录因子Sp1在肿瘤组织中表现为异常表达和活化,并且参与调控肿瘤细胞增殖、侵袭、血管生成等多种生物学功能[4]。近来研究已尝试用Sp1作为肿瘤患者预后的独立指标,如Wang等[5]发现Sp1可作为胃癌患者长期生存率的指标,Fuchs等[6]也发现Sp1与EWS-ETS癌相关蛋白密切相关,是尤文氏肉瘤的独立预后因素。国内有些研究也发现Sp1与胃癌[7-8]、乳腺癌[9]、胰腺癌[10]、大肠癌[11]、恶性胸膜瘤[12]等预后密切相关。但Sp1在肝癌中的表达及其与肝癌预后的关系目前鲜见文献报道。Sp1的转录调控活性受到各种水平的调控,不仅受Sp1蛋白细胞核内含量的影响,还受蛋白翻译后修饰(如磷酸化、糖基化)等的调控[13-16]。
本文应用免疫组织化学染色法分析了转录因子Sp1在肝癌组织和正常肝组织中表达,结果说明Sp1在肝癌中高表达,在对应正常肝脏组织中低表达,两者具有明显的统计学差异,提示Sp1在肝癌的发生、发展及转移复发中起到一定的调控作用。对98例根治性切除术后肝细胞肝癌患者肿瘤及正常肝脏组织进行多因素分析发现,患者预后与有无肝硬化、肿瘤大小、有无微血管侵犯、TNM分期、是否感染乙肝以及Sp1表达情况均有一定的关系,然而进一步分析Sp1与肝癌临床病理特征的关系,仅观察到Sp1过表达与微血管侵犯之间密切相关,与其他因素如年龄、性别、肝硬化、血清AFP、肿瘤大小或有无包膜之间无显著性关系。这些结果表明在有微血管侵犯的患者中,肿瘤组织更容易高表达Sp1,进而提示Sp1可能与肝癌的血管生成密切相关,这与本文前期工作中证实转录因子Sp1与血管生成因子VEGF启动子特异性结合是VEGF转录调控最重要的机制,可能进一步调控肝癌血管生成及转移复发的结论相吻合[17],说明Sp1在肝癌中高表达,并调控VEGF高表达,进而促进肝癌血管生成,可能是肝癌血管生成调控中重要机制,Sp1是其中重要的调控因子。肝癌血管生成是肝癌转移复发的重要因素,与肝癌患者术后预后密切相关,作为血管生成重要调控因子的Sp1也与肝癌术后预后有一定相关性,应用Kaplan-Meier生存曲线研究Sp1表达与肝癌术后患者预后的相关性,结果显示Sp1表达与肝癌患者术后总体生存率呈负相关,而与肝癌患者术后复发率呈正相关,具有统计学意义。多因素分析显示对于总生存和复发,Sp1表达是肝癌预后的重要影响因素。转录因子Sp1的表达与肝癌术后预后和复发密切相关,可作为肝癌术后预后的独立预测指标。
1 Siegel R,Desantis C,Jemal A.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
2 Tang ZY,Ye SL,Liu YK,et al.A decade's studies on metastasis of hepatocellular carcinoma[J].J Cancer Res Clin Oncol,2004,130(4):187-196.
3 Briggs MR,Kadonaga JT,Bell SP,et al.Purification and biochemical haracterization of the promoter-specific transcription factor, Sp1[J].Science,1986,234(1):47-52.
4 Ishibashi H,Nakagawa K,Onimaru M,et al.Sp1 decoy transfected to carcinoma cells suppresses the expression of vascular endothelial growth factor,transforming growth factor beta1,and tissue factor and also cell growth and invasion activities[J].Cancer Res,2000,60 (11):6531-6536.
5 Wang L,Wei D,Huang S,et al.Transcription factor Sp1 expression is a significant predictor of survival in human gastric cancer[J]. Clin Cancer Res,2003,9(10):6371-6380.
6 Fuchs B,Inwards CY,Janknecht R.Vascular endothelial growth factor expression is up-regulated by EWS-ETS oncoproteins and Sp1 and may represent an independent predictor of survival in Ewing's sarcoma[J].Clin Cancer Res,2004,10(4):1344-1353.
7 Zhou CF,Ji J,Yuan F,et al.Expression of metastasis associated 1 family member 2(MTA2)in gastric cancer and its relationship with transcription factor Sp1[J].Zhonghua Zhong Liu Za Zhi,2012,34 (8):592-595.[周尘飞,计 骏,袁 菲,等.转移相关基因2在胃癌中的表达及其与核转录因子Sp1的相关性[J].中华肿瘤杂志,2012,34 (8):592-595.]
8 Wang F,Ma YL,Zhang P,et al.SP1 mediates the link between methylation of the tumour suppressor miR-149 and outcome in colorectal cancer[J].J Pathol,2013,229(1):12-24.
9 Sankpal UT,Maliakal P,Bose D,et al.Expression of specificity protein transcription factors in pancreatic cancer and their association in prognosis and therapy[J].Curr Med Chem,2012,19(22):3779-3786.
10 Bedolla RG,Gong J,Prihoda TJ,et al.Predictive value of Sp1/Sp3/ FLIP signature for prostate cancer recurrence[J].PLoS One,2012,7 (9):e44917.
11 Grande L,Bretones G,Rosa-Garrido M,et al.Transcription factors Sp1 and p73 control the expression of the proapoptotic protein NOXA in the response of testicular embryonal carcinoma cells to cisplatin[J].J Biol Chem,2012,287(32):26495-26505.
12 Chae JI,Jeon YJ,Shim JH.Downregulation of Sp1 is involved in honokiol-induced cell cycle arrest and apoptosis in human malignant pleural mesothelioma cells[J].Oncol Rep,2013,29(6):2318-2324.
13 Barrasa JI,Olmo N,Santiago-Gómez A,et al.Histone deacetylase inhibitors upregulate MMP11 gene expression through Sp1/Smad complexes in human colon adenocarcinoma cells[J].Biochim Biophys Acta,2012,1823(2):570-581.
14 Sankpal UT,Goodison S,Abdelrahim M,et al.Targeting Sp1 transcription factors in prostate cancer therapy[J].Med Chem,2011,7 (5):518-525.
15 Wang F,Li Y,Zhou J,et al.miR-375 is down-regulated in squamous cervical cancer and inhibits cell migration and invasion via targeting transcription factor SP1[J].Am J Pathol,2011,179(5):2580-2588.
16 Xu Y,Zhao F,Wang Z,et al.MicroRNA-335 acts as a metastasis suppressor in gastric cancer by targeting Bcl-w and specificity protein 1[J].Oncogene,2012,31(11):1398-1407.
17 Pan Q,Wang L,Sun HC,et al.transcription factor Sp1 is essential for expression of VEGF in hepatocellular carcinoma[J].Chin Med J Chin,2007,14(4):487-490.[潘 奇,王 鲁,孙惠川,等.转录因子Sp1在肝癌细胞VEGF表达调控中的作用[J].中国临床医学,2007, 14(4):487-490.]
(2014-04-25收稿)
(2014-06-23修回)
(本文编辑:周晓颖)
Correlation of transcription factor Sp1 expression with clinical and pathological characteristics and prognosis of hepatocellular carcinoma
Qi PAN,Kai ZHU,Wanyong CHEN,Jubo ZHANG,Huichuan SUN,Lu WANG,Ning REN
Ning REN;E-mail:ren.ning@zs-hospital.sh.cn
Department of Liver Surgery,Zhongshan Hospital,Fudan University,Shanghai 200032,China
This work was supported by the National Natural Science Foundation of China(No.30600589;30801102)and Shanghai City Science and Technology Star Tracking Program(No.13QH1401000)
Objective:To explore the clinical significance of transcription factor Sp1 expression in hepatocellular carcinoma (HCC)and association between Sp1 expression and survival in HCC patients.Methods:With the use of immunoreactivity,Sp1 expression and its correlation with other clinicopathological characteristics were examined in a tissue microarray that contains samples from 98 HCC patients.Results:HCC tissues expressed markedly higher levels of Sp1 than did adjacent normal liver tissues.Sp1 expression was closely associated with microvascular invasion,which suggests that HCC with more microvascular invasion is prone to have increased Sp1 expression.Overexpression of Sp1 correlates with significantly shorter overall survival and higher recurrence rates in HCC patients after curative resection.Conclusion:Transcription factor Sp1 may be an independent prognostic factor for both overall survival and cumulative recurrence rate.
hepatocellular carcinoma,transcription factor Sp1,prognostic factor,tissue chip

10.3969/j.issn.1000-8179.20140694
复旦大学附属中山医院肝外科(上海市200032)
*本文课题受国家自然科学基金(编号:30600589、30801102)和上海市科技启明星跟踪计划(编号:13QH1401000)资助
任宁 ren.ning@zs-hospital.sh.cn
潘奇 专业方向为肝癌的复发与转移研究。
E-mail:pan.qi@zs-hospital.sh.cn

