sirtinol对前列腺癌DU145细胞周期的影响及其机制
张大田,石建国,张 强,刘 岩
(辽宁医学院附属第一医院泌尿外科,辽宁锦州 121001)
sirtinol对前列腺癌DU145细胞周期的影响及其机制
张大田,石建国,张 强,刘 岩
(辽宁医学院附属第一医院泌尿外科,辽宁锦州 121001)
目的:观察沉默信息调节因子1(SIRT1)抑制剂sirtinol对前列腺癌DU145细胞生长增殖、细胞周期进程和细胞周期正性调节蛋白Cyclin D1、CDK4及p Rb表达的影响,探讨SIRT1在前列腺癌发生中的可能作用机制。方法:取处于对数生长期DU145细胞随机分为对照组(DMSO组)和sirtinol组(终浓度分别为10、25和50μmol·L-1),MTT法测定各组DU145细胞生长抑制率,RT-PCR和Western blotting法检测DU145细胞中SIRT1 m RNA和蛋白表达水平,流式细胞术检测细胞周期进程,Western blotting法检测DU145细胞中细胞周期蛋白Cyclin D1、CDK4和p Rb的表达水平。结果:与对照组比较,各浓度sirtinol组DU145细胞生长抑制率明显升高(P<0.01),G1期细胞明显增多(P<0.01),且呈浓度依赖性。与对照组比较,各浓度sirtinol组DU145细胞中SIRT1 m RNA和蛋白表达水平明显降低(P<0.01),Cyclin D1和p Rb蛋白表达水平降低(P<0.01),CDK4蛋白表达无明显变化(P>0.05)。结论:下调SIRT1表达可以抑制前列腺癌DU145细胞的增殖和阻滞细胞周期进程,其机制可能与改变细胞周期蛋白CyclinD1和p Rb的表达有关。
sirtinol;沉默信息调节因子1;前列腺肿瘤;DU145细胞
随着人口老龄化进程加快,我国前列腺癌发病率逐年增加,但前列腺癌发生和发展的分子机制尚不清楚,年龄、种族、饮食和雄激素的分泌及代谢异常等均是肿瘤发生的危险因素。前列腺癌的发病与年龄有密切关联,随着人类预期生存年龄的增加,前列腺癌的发病率明显增加[1-2],因此寻找新的分子生物学标记物和信号通路,明确前列腺癌的发生与年龄的关系,可为前列腺癌的诊断和治疗提供新的理论基础和实验依据。沉默信息调节因子1 (silent information regulator 1,SIRT1)属于sirtuin家族,与酵母SIR2高度同源,为烟酰胺腺嘌呤二核苷酸(NAD+)依赖性的组蛋白去乙酰化酶。SIRT1在DNA修复、细胞分化、炎症和细胞凋亡等方面发挥重要作用[3-5]。有研究[6-8]显示:肿瘤细胞中内源性SIRT1的表达高于正常细胞,推测SIRT1作为癌基因参与肿瘤的发生和发展。而另一方面,最近有研究[9]报道:SIRT1在胃癌细胞中表达下调,并通过NF-κB/Cyclin D1信号通路导致细胞G1期阻滞,从而提示SIRT1在胃癌的发生发展中可能发挥抑癌作用。国内外对SIRT1在前列腺癌中的具体作用报道[10-11]也不一致。本研究选用不同浓度SIRT1抑制剂sirtinol作用于前列腺癌DU145细胞株,旨在探讨下调SIRT1表达对人前列腺癌细胞株细胞周期阻滞和细胞周期蛋白表达的影响,初步阐明前列腺癌发生发展的可能机制, 为SIRT1作为前列腺癌的治疗靶点提供实验依据。
1 材料与方法
1.1 主要试剂与仪器sirtinol(S8825,HPLC≥98%,美国Sigma公司),DMEM培养液(美国Corning公司),SIRT1(鼠单克隆抗体,美国Merck Millipore公司),Cyclin D1(兔单克隆抗体,美国CST公司),CDK4(兔多克隆抗体,美国Abcam公司),p Rb抗体(山羊多克隆抗体)和β-actin抗体(兔多克隆抗体)(美国Santacruz公司),HRP标记的山羊抗兔、抗鼠IgG(北京中杉金桥生物技术有限公司),ECL化学发光试剂盒(美国Piece Biotechnology公司),MTT、Western blotting细胞裂解液和BCA蛋白浓度测定试剂盒(北京碧云天生物技术公司),RNA PCR Kit (AMV)Ver 3.0试剂盒(日本Takara公司)。BB16UV CO2培养箱(德国Heraeus公司),PCR扩增仪(美国Eppendorf公司),水浴式电转印槽DYY-Ⅲ40B型(北京六一仪器厂),凝胶自动成像仪GDS8000和电泳仪(美国Bio-Rad公司), Sunrise自动酶标检测仪(美国Tecan公司),流式细胞仪(美国贝克曼库尔特有限公司)。
1.2 细胞培养及实验分组人前列腺癌DU145细胞购自上海生命科学院细胞和生物化学研究所,培养于含10%胎牛血清、100 U·m L-1青霉素和100 mg·L-1链霉素的DMEM培养基中,在饱和湿度、37℃、5%CO2孵箱中培养,当细胞汇合至培养瓶底面积约80%时以0.25%胰蛋白酶消化传代。当细胞处于对数生长期时,以1×105m L-1浓度接种于25 cm2的培养瓶或96孔培养板中。24或48 h待细胞贴壁后给药,sirtinol组终浓度分别为10、25和50μmol·L-1,对照组加入5μL DMSO(DMSO体积分数小于0.1%,该浓度对细胞生长无影响)。
1.3 MTT法检测细胞生长抑制率取对数生长期DU145细胞,以1×105m L-1接种于96孔板上,37℃培养箱中培养24 h后,弃上清液,分别加入不同浓度的sirtinol,各浓度组6个复孔。继续培养24或48 h,加入20μL MTT(5 g·L-1)孵育4 h。弃去培养液,加入150μL二甲基亚砜,振荡15 min,使沉淀物充分溶解。于酶标仪490 nm处测吸光度(A)值,计算细胞生长抑制率。细胞生长抑制率=(1-加药组A值/对照组A值)× 100%。
1.4 流式细胞术检测细胞周期进程将DU145细胞株接种于25 cm2培养瓶中,待细胞贴壁后加入不同浓度的sirtinol分别作用48 h,以胰酶-EDTA消化,采用5 m L培养液重悬细胞至单细胞悬液, 1 000 r·min-1离心5 min,用4℃预冷的PBS吹打成单细胞悬液,离心弃上清。加入5 m L冷PBS再离心1次,弃去上清。在避光条件下加入1 m L PI染液重悬细胞至单细胞悬液,室温孵育30 min,采用流式细胞仪检测,利用CellQuest分析软件分析各组G1和S期DU145细胞所占百分率。
1.5 RT-PCR方法检测SIRT1 m RNA表达水平采用Trizol一步法提取经不同浓度sirtinol处理48 h的DU145细胞总RNA,1%琼脂糖凝胶电泳检测RNA的完整性,采用核酸蛋白测定仪测定RNA浓度,当A260/A280比值达1.9~2.0时可用于逆转录反应。用RNA PCR(AMV)Ver 3.0试剂盒,按说明书操作。反转录条件:42℃、30 min, 99℃、5 min,5℃、5 min。PCR引物序列: SIRT1,5′-TCAGTGTCATGGTTCCTTTGC-3′, 5′-AATCTGCTCCTTTGCCACTCT-3′,820 bp; GAPDH,5′-CGGAGTCAACGGATTTGGTCGTAT-3′,5′-CGGAGTCAACGGATTTGGTCGTAT-3′,306 bp;PCR反应条件:94℃预变性3 min;94℃、30 s,57℃、30 s,72℃、1 min, 30个循环;72℃终延伸5 min。取PCR产物10μL进行琼脂糖凝胶电泳并拍照,测量A值,m RNA表达水平以每一样品A值与GAPDH A值比值表示。
1.6 Western blotting法检测SIRT1、Cyclin D1、CDK4和p Rb的蛋白表达蛋白裂解液提取加药处理48 h后的各组细胞总蛋白,采用BCA法测定蛋白浓度,-20℃或-80℃保存备用。电泳前,加入5×SDS样品缓冲液,100℃煮沸5 min,离心后上样,10%SDS-PAGE电泳分离,然后将蛋白转至硝酸纤维素膜上,之后用含5%BSA的TBS (p H 7.4)将滤膜于室温摇动温育2 h进行封闭,封闭后的滤膜再分别与SIRT1(稀释比1∶1 000), Cyclin D1、CDK4、p Rb抗体(稀释比1∶200)及β-actin(稀释比1∶1 000),4℃温育过夜。经TTBS洗涤后,HRP偶联的IgG作为二抗(稀释比1∶5 000)室温温育2 h,洗膜后,采用ECL发光法显色。采用Image J软件分析密度,计算A值。蛋白表达水平以蛋白A值与β-actin A值比值表示。
1.7 统计学分析应用GraphPad Prism 5软件进行统计学分析。各组细胞生长抑制率、G1和S期细胞百分率及m RNA和蛋白表达水平均以±s表示,两两比较采用t检验。
2 结果
2.1 各组DU145细胞生长抑制率与对照组比较,各浓度(10、25和50μmol·L-1)sirtinol组DU145细胞生长抑制率明显升高(P<0.01),且随sirtinol浓度的增加而升高,呈明显的浓度-效应关系。见表1。
2.2 各组DU145细胞的细胞周期与对照组比较,不同浓度sirtinol组S期DU145细胞百分率降低(P<0.01),随着药物浓度的增加,G1期细胞百分率升高(P<0.01),且呈浓度效应关系。见表2。
表1 各组DU145细胞生长抑制率Tab.1 Inhibitory rates of growth of DU145 cells in various groups(n=6,±s,η/%)
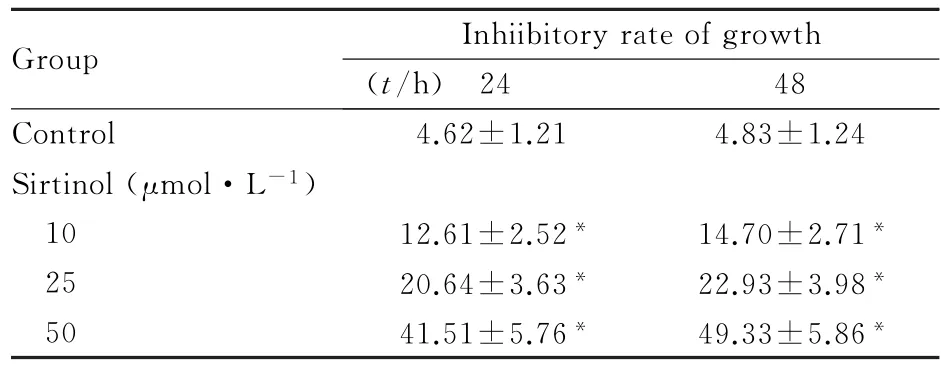
表1 各组DU145细胞生长抑制率Tab.1 Inhibitory rates of growth of DU145 cells in various groups(n=6,±s,η/%)
∗P<0.01 compared with control group.
Group Inhiibitory rate of growth (t/h) 24 48 Control 4.62±1.21 4.83±1.24 Sirtinol(μmol·L-1) 10 12.61±2.52∗14.70±2.71∗25 20.64±3.63∗22.93±3.98∗50 41.51±5.76∗49.33±5.86∗
表2 各组DU145细胞各周期细胞百分率Tab.2 Percentages of DU145 cells at each cell cycle in various groups(n=6,±s,η/%)

表2 各组DU145细胞各周期细胞百分率Tab.2 Percentages of DU145 cells at each cell cycle in various groups(n=6,±s,η/%)
∗P<0.01 compared with control group.
Group Percentage of DU145 cells G1S Control 35.59±1.83 43.10±1.42 Sirtinol(μmol·L-1) 10 40.30±1.96∗38.31±2.17∗25 53.42±3.78∗33.78±2.91∗50 65.38±3.78∗22.23±2.52∗
2.3 各组DU145细胞中SIRT1 mRNA和蛋白表达水平与对照组比较,不同浓度sirtinol组DU145细胞SIRT1 m RNA和蛋白表达水平明显降低(P<0.01),且随sirtinol浓度增加其表达水平逐渐降低。见表3。各组细胞中SIRT1 m RNA和蛋白表达电泳图见图1。
表3 各组DU145细胞中SIRT1 m RNA和蛋白表达水平Tab.3 Expression levels of SIRT1 mRNA and protein in DU145 cells in various groups(n=6,±s)

表3 各组DU145细胞中SIRT1 m RNA和蛋白表达水平Tab.3 Expression levels of SIRT1 mRNA and protein in DU145 cells in various groups(n=6,±s)
∗P<0.01 compared with control group.
Group SIRT1/GAPDH SIRT1/β-actin Control 0.028±0.006 0.085±0.009 Sirtinol(μmol·L-1) 10 0.019±0.005∗0.073±0.007∗25 0.017±0.006∗0.038±0.005∗50 0.008±0.003∗0.012±0.005∗
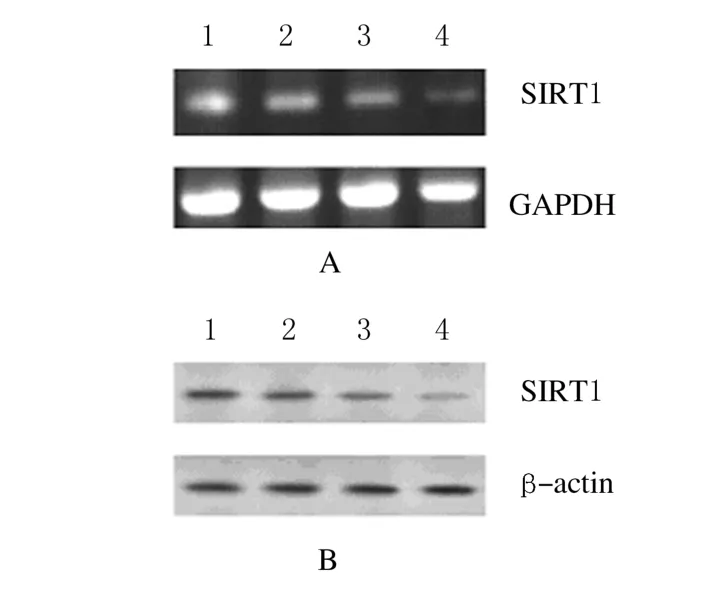
图1 各组DU145细胞中SIRT1 m RNA(A)和蛋白(B)表达电泳图Fig.1 Electrophoregram of expressions of SIRT1 mRNA (A)and protein(B)in DU145 cells in various groupsLane 1:Control group;Lane 2-4:10,25,and 50μmol·L-1sirtinol groups.
2.4 各组DU145细胞中Cyclin D1、CDK4和p Rb蛋白表达水平与对照组比较,不同浓度sirtinol组DU145细胞中Cyclin D1和p Rb蛋白表达水平明显降低(P<0.01),且随sirtinol浓度增加其表达水平逐渐降低(P<0.01),但CDK4蛋白表达水平无明显变化(P>0.05)。见图2和表4。
表4 各组DU145细胞中Cyclin D1、CDK4和pRb蛋白表达水平Tab.4 Expression levels of Cyclin D1,CDK4,and pRb proteins in DU145 cells in various groups(±s)

表4 各组DU145细胞中Cyclin D1、CDK4和pRb蛋白表达水平Tab.4 Expression levels of Cyclin D1,CDK4,and pRb proteins in DU145 cells in various groups(±s)
∗P<0.01 compared with control group.
Group Cyclin D1/β-actin CDK4/β-actin p Rb/β-actin Control 1.191±0.023 0.371±0.021 1.082±0.072 Sirtinol(μmol·L-1) 10 0.053±0.011∗0.375±0.033 0.022±0.008∗25 0.040±0.009∗0.367±0.018 0.018±0.006∗50 0.023±0.007∗0.379±0.041 0.013±0.005∗
3 讨论
肿瘤的发生发展是多因素、多阶段、多步骤和逐渐演变的过程,许多因素调控众多的分子表达变化,形成了一个复杂的信号通路。有研究[5]表明: SIRT1在这一进程中扮演了重要角色。为了研究SIRT1在前列腺癌发生发展中的作用,本文作者首先使用不同浓度的SIRT1抑制剂sirtinol分别作用于前列腺癌DU145细胞24和48 h,MTT测定结果表明:sirtinol(10~50μmol·L-1)能抑制DU145细胞的增生,并且具有浓度和时间依赖性,说明sirtinol具有抑制细胞增殖作用,与Lee等[12]的报道结果一致。同时本研究结果显示:不同浓度sirtinol处理DU145细胞后,随着sirtinol浓度的增加,SIRT1 m RNA和蛋白表达水平逐渐降低,说明sirtinol可以改变内源性SIRT1的表达和活性。细胞周期进展是反映细胞增殖速度的一个重要指标。为了研究内源性SIRT1对细胞周期的影响,本文作者利用不同浓度sirtinol处理DU145细胞48 h后改变细胞内源性SIRT1的活性,并利用流式细胞术分析细胞周期,结果表明:与对照组比较,sirtinol处理后G1期细胞百分率增加,细胞周期阻滞在G1期。为了探讨SIRT1影响细胞周期进展可能的分子机制,本文作者检测了细胞周期正性关键调控分子Cyclin D1、CDK4和p Rb的表达变化。细胞周期蛋白和细胞周期蛋白依赖性激酶(CDK)是调控细胞进展的2类关键分子[13], Cyclin D1是第一个被发现的细胞周期调控分子,在外界信号刺激下,Cyclin D1与CDK4结合形成具有活性的异源二聚体,使视网膜母细胞瘤蛋白(retinoblastoma,Rb)磷酸化而失活,推动细胞周期由G1期向S期进展[14-15]。Western blotting法检测结果提示:下调SIRT1表达可以抑制Cyclin D1和p Rb表达,但不引起CDK4的表达变化。
综上所述,本研究证实下调SIRT1表达和活性可以抑制前列腺癌细胞的体外增殖和阻滞细胞周期进程,其机制可能与改变细胞周期蛋白Cyclin D1和p Rb的表达有关。本研究结果提示SIRT1在前列腺癌的发生发展中可能扮演癌基因的角色。有关SIRT1在前列腺癌发生发展中的分子途径及信号通路尚需深入研究。
[1]Jung-Hynes B,Nihal M,Zhong W,et al.Role of sirtuin histone deacetylase SIRT1 in prostate cancer.A target for prostate cancer management via its inhibition[J].J Biol Chem,2009,284(6):3823-3832.
[2]Goyal J,Antonarakis ES.Clinical evaluation of abiraterone in the treatment of metastatic prostate cancer[J].Clin Med Insights Urol,2013,2013(7):1-14.
[3]Byles V,Zhu L,Lovaas JD,et al.SIRT1 induces EMT by cooperating with EMT transcription factors and enhances prostate cancer cell migration and metastasis[J].Oncogene, 2012,31(43):4619-4629.
[4]Li Y,Wong K,Giles A,et al.Hepatic SIRT1 attenuates hepatic steatosis and controls energy balance in mice by inducing fibroblast growth factor 21[J].Gastroenterology, 2014,146(2):539-549.
[5]Yuan HF,Su L,Chen WY.The emerging and diverse roles of sirtuins in cancer:a clinical perspective[J].Oncol Targets Ther,2013,6:1399-1416.
[6]Lee SI,Park KH,Kim SJ,et al.Mechanical stressactivated immune response genes via Sirtuin 1 expression in human periodontal ligament cells[J].Clin Exp Immunol, 2012,168(1):113-124.
[7]Wang T,Cui H,Ma N,et al.Nicotinamide-mediated inhibition of SIRT1 deacetylase is associated with the viability of cancer cells exposed to antitumor agents and apoptosis[J].Oncol Lett,2013,6(2):600-604.
[8]Jung W,Hong KD,Jung WY,et al.SIRT1 expression is associated with good prognosis in colorectal cancer[J].Korean J Pathol,2013,47(4):332-339.
[9]Yang Q,Wang B,Gao W,et al.SIRT1 is downregulated in gastric cancer and leads to G1-phase arrest via NF-κB/Cyclin D1 signaling[J].Mol Cancer Res,2013,11(12):1497-1507.
[10]Kojima K,Ohhashi R,Fujita Y,et al.A role for SIRT1 in cell growth and chemoresistance in prostate cancer PC3 and DU145 cells[J].Biochem Biophys Res Commun,2008, 373(3):423-428.
[11]Baptista T,Graça I,Sousa EJ,et al.Regulation of histone H2A.Z expression is mediated by sirtuin 1 in prostate cancer[J].Oncotarget,2013,4(10):1673-1685.
[12]Lee HJ,Auh QS,Lee YM,et al.Growth inhibition and apoptosis-inducing effects of cudraflavone B in human oral cancer cells via MAPK,NF-κB,and SIRT1 signaling pathway[J].Planta Med,2013,79(14):1298-1306.
[13]Ishidate T,Elewa A,Kim S,et al.Divide and differentiate: CDK/Cyclins and the art of development[J].Cell Cycle, 2014,13(9):1384-1391.
[14]Xu C,Wu C,Xia Y,et al.WT1 promotes cell proliferation in non-small cell lung cancer cell lines through up-regulating cyclin D1and p-p Rb in vitro and in vivo[J].PLoS One, 2013,8(8):e68837.
[15]Nakajima K,Crisma AR,Silva GB,et al.Malnutrition suppresses cell cycle progression of hematopoietic progenitor cells in mice via cyclin D1 down-regulation[J].Nutrition, 2014,30(1):82-89.
Influence of sirtinol in cell cycle of prostate cancer DU145 cells and its mechanism
ZHANG Da-tian,SHI Jian-guo,ZHANG Qiang,LIU Yan
(Department of Urinary Surgery,First Affiliated Hospital,Liaoning Medical University,Jinzhou 121001,China)
ObjectiveTo observe the influence of sirtinol,a silent information regulator 1(SIRT1)inhibitor,in the cell proliferation,cell cycle progression and the expression levels of positive regulator proteins of the cell cycle including Cyclin D1,CDK4 and pRb in prostate cancer DU145 cells,and to explore the possible mechanism of SIRT1 in occurrence of prostagte cancer.MethodsThe DU145 cells at logarithmic growth phase were cultured in vitro and divided into control group(DMSO)and different doses(10,25,50μmol·L-1)of sirtinol groups.The inhibitory rate of growth of DU145 cells was detected with MTT method,the SIRT1 m RNA and protein expression levels were determined by RT-PCR and Western blotting method,and the cell cycle was measured by flow cytometry.The Cyclin D1,CDK4 and p Rb protein expression levels were examined by Western blotting method.ResultsCompared with control group,the inhibitory rates of growth of the DU145 cells in different doses of sirtinol groups were increased markedly in a dose-dependent manner(P<0.01),and the flow cytometry analysis result showed the DU145 cells at G1phase were increased(P<0.01).Compared with control group,the expression levels of SIRT1 mRNA and protein in DU145 cells in different doses of sirtinol groups were decreased significantly (P<0.01);the expression levels of Cyclin D1 and p Rb proteins were decreased(P<0.01),whereas the expression levels of CDK4 had no change(P>0.05).ConclusionSIRT1 inhibition by sirtinol can inhibit the cellgrowth of prostate cancer DU145 cells in a dose-dependent manner and arrest the cell cycle progression,and its mechanism may be related to decreasing the CyclinD1 and p Rb protein expressions.
sirtinol;silent information regulator 1;prostate neoplasms;DU145 cells
R737.25
A
2014-02-14
辽宁省科技厅科学计划项目资助课题(2011225015)
张大田(1969-),男,吉林省通化市人,副主任医师,医学硕士,主要从事泌尿系统肿瘤的生物学研究。
刘 岩(Tel:0416-419763,E-mail:liuyanforest@163.com)
1671-587Ⅹ(2014)05-0967-05
10.13481/j.1671-587x.20140512

