超声提取贯叶连翘中总黄酮和金丝桃素的工艺研究
宋宏新, 邢红香, 李 楠
(陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
0 引言
贯叶连翘(Hypericum perforatum L.)又称贯叶金丝桃,是藤黄科金丝桃属多年生草本植物[1].现代药理研究表明:贯叶连翘具有抗抑郁[2,3]、抗病毒、抗菌、镇痛[4]等作用.其提取物及其制剂是欧美最畅销的抗抑郁植物药之一.
贯叶连翘中含有多种活性成分,主要有萘骈二蒽酮类、间苯三酚类、黄酮类化合物等,从贯叶连翘中提取分离的金丝桃素(hypericin)为萘骈二蒽酮类化合物,被认为是贯叶连翘提取物中最具生物活性的物质,具有抗病毒、抗抑郁等作用[5],还是一种有效的光敏剂,在光动力学治疗中表现出强的诱导肿瘤细胞凋亡的活性[6,7].在德国,将金丝桃素与蛋白结合,用于治疗艾滋病及甲、乙型肝炎[8].市场上要求贯叶连翘提取物中金丝桃素的含量≥0.3%[9].近来的研究表明黄酮类成分是贯叶连翘中具有抗抑郁作用的成分之一[10],为了更好地利用我国丰富的贯叶连翘资源,本研究试图建立一种简单有效的方法,以总黄酮和金丝桃素得率为共同指标,确定最佳提取工艺条件,为贯叶连翘的开发利用奠定理论基础.
1 材料与仪器
1.1 材料
贯叶连翘药材,陕西省西安市市售.
1.2 仪器与试剂
752型紫外可见分光光度计(上海光谱仪器有限公司);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司);T-1000型电子天平(江苏常熟双节测试仪器厂);万分之一级电子天平(北京赛多利斯仪器系统有限公司);高速万能粉碎机(天津市泰斯特仪器有限公司).
芦丁标准品(购自中国药品生物制品药检所);甲醇、乙醇、NaNO2、Al(NO3)3、NaOH均为分析纯,水为蒸馏水.金丝桃素标准品(纯度98%,天津西玛科技有限公司,批号:053012).
2 方法
2.1 金丝桃素和总黄酮的提取
精密称取粉碎至80目的药材粉末5.0 g,加一定浓度的乙醇溶液,在一定温度下超声提取一定时间,抽滤定容.
2.2 金丝桃素含量的测定
2.2.1 对照品溶液的制备
精密称取金丝桃素标准品2.0 mg置25 mL容量瓶中,加入甲醇超声溶解定容至刻度,4 ℃避光保存,备用.
2.2.2 标准曲线的制备
分别精密量取金丝桃素标准液0.5 mL、1 mL、1.5 mL、2 mL、2.5 mL置10 mL容量瓶中,用甲醇定容,以甲醇溶液作空白对照,于588 nm测定吸光度.以浓度为横坐标,吸光度为纵坐标绘制标准曲线.以吸光度A对浓度C进行回归,得回归方程:A=80.343C-0.010 4,R2=0.999 1,金丝桃素在4~20μg/mL线性范围内线性关系良好.
2.2.3 提取液中金丝桃素的含量测定
按1.2.1实验方法对贯叶连翘样品进行提取,所得提取液分别以各自相应的提取溶剂为空白,在588 nm下测定吸光度值,计算金丝桃素的得率.计算公式为:
注:W:金丝桃素的得率,%;C:被测溶液的浓度,mg/mL;V:定容后的体积,mL;f:稀释倍数;m:贯叶连翘干燥药材的质量,g.
2.3 总黄酮含量测定
2.3.1 对照品溶液的制备
精密称取芦丁标准品18.4 mg置于50 mL的容量瓶中,加入60%的乙醇超声溶解,定容至刻度.
2.3.2 标准曲线的制备
分别精密量取芦丁对照品溶液0 mL、l mL、2 mL、3 mL、4 mL、5 mL于25 mL容量瓶中,加水5 mL,加5%NaNO3溶液1.0 mL,摇匀,放置6 min,加入10%Al(NO3)3溶液1.0 mL,摇匀,放置6 min;加入4%NaOH10 mL,摇匀,放置15 min,然后以水定容至刻度,以芦丁浓度为0的相应溶液为空白对照,在510 nm[11]处测各自的吸光度值.以浓度为横坐标,吸光度为纵坐标绘制标准曲线.以芦丁溶液浓度C与吸光值A进行线性回归,得回归方程:A=11.194C-0.003 8,R2=0.999 9,芦丁在14.72~73.6μg/mL浓度范围内线性关系良好.
2.3.3 提取液中总黄酮含量的测定
按2.1实验方法对贯叶连翘进行提取,将提取液按照2.3.2项下加入显色剂后,在510 nm下测定吸光度,计算总黄酮得率.计算公式为:
注:W:黄酮的得率,%;C:被测溶液的浓度,mg/mL;V:定容后的体积,mL;f是稀释倍数;m:贯叶连翘干燥药材的质量,g.
3 结果与讨论
3.1 提取单因素实验结果
3.1.1 乙醇浓度的影响
精密称取5.0 g的药材粉末5份,料液比为1∶10,分别加入50%、60%、70%、80%、90%的乙醇溶液,在45 ℃超声时间1 h,抽滤,测定滤液中金丝桃素和总黄酮吸光度,计算各自得率.结果如图1所示.
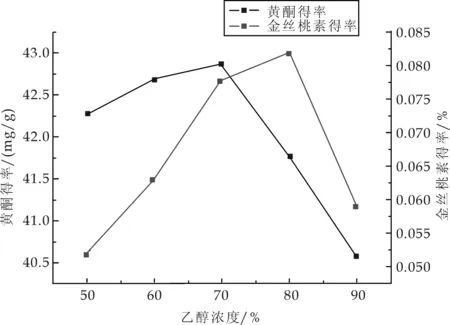
图1 乙醇浓度对黄酮和金丝桃素得率的影响
由图1可知,随着乙醇浓度的增加,黄酮和金丝桃素的得率均呈先增大后减小的趋势.由于不同浓度的乙醇其极性不同,对贯叶连翘中金丝桃素、总黄酮以及其它的化学成分选择性不同.高浓度乙醇和低浓度乙醇对金丝桃素和黄酮的选择性较差,对于其它成分溶解更多;而中等浓度的乙醇对两者的选择性较好,且溶解其他成分少,说明中等浓度的乙醇的极性与黄酮和金丝桃素极性相近.70%的乙醇提取黄酮最佳,80%的乙醇提取金丝桃素最佳.
3.1.2 料液比的影响
精密称取5.0 g的药材粉末5份,分别以料液比1∶10、1∶15、1∶20、1∶25、1∶30加入80%的乙醇,在45 ℃超声时间1 h,抽滤,测定,计算各自得率.结果如图2所示.
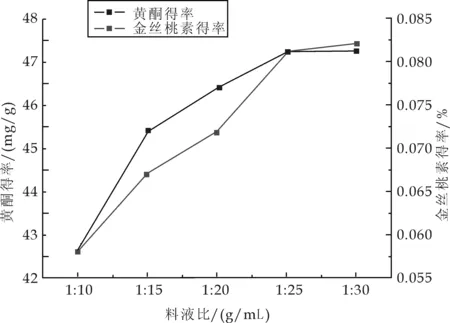
图2 料液比对黄酮和金丝桃素得率的影响
由图2可知,随着料液比的减小,金丝桃素和黄酮的得率随着增大,当料液比达到1:25时,再增加溶剂的用量,两者得率的增加并不明显.这可能是溶剂体积的增多使其他杂质成分溶出,从而抑制了有效成分的溶出,且过多的乙醇会给后工序的乙醇回收造成负担.从经济、节能角度考虑,提取的最佳料液比为1∶25.
3.1.3 提取温度的影响
精密称取5.0 g的药材粉末5份,以料液比1∶25加入80%乙醇,温度分别设为40 ℃、45 ℃、50 ℃、55 ℃、60 ℃,超声提取1 h,抽滤,测定,计算得率.结果如图3所示.
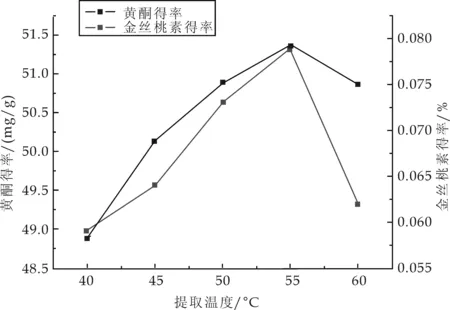
图3 提取温度对黄酮和金丝桃素得率的影响
由图3可知,随着温度的升高,金丝桃素和黄酮的得率随之增大,当温度超过55 ℃时,两者的得率均有下降的趋势,且金丝桃素下降的趋势较明显.可能温度过高,贯叶连翘中有效成分受热易分解.因此选择55 ℃为最佳的提取温度.
3.1.4 提取时间的影响
精密称取5.0 g的药材粉末5份,以料液比1∶25加入80%的乙醇,45 ℃超声提取,时间分别是30 min、45 min、60 min、75 min,90 min,抽滤,测定,计算各自得率.结果如图4所示.
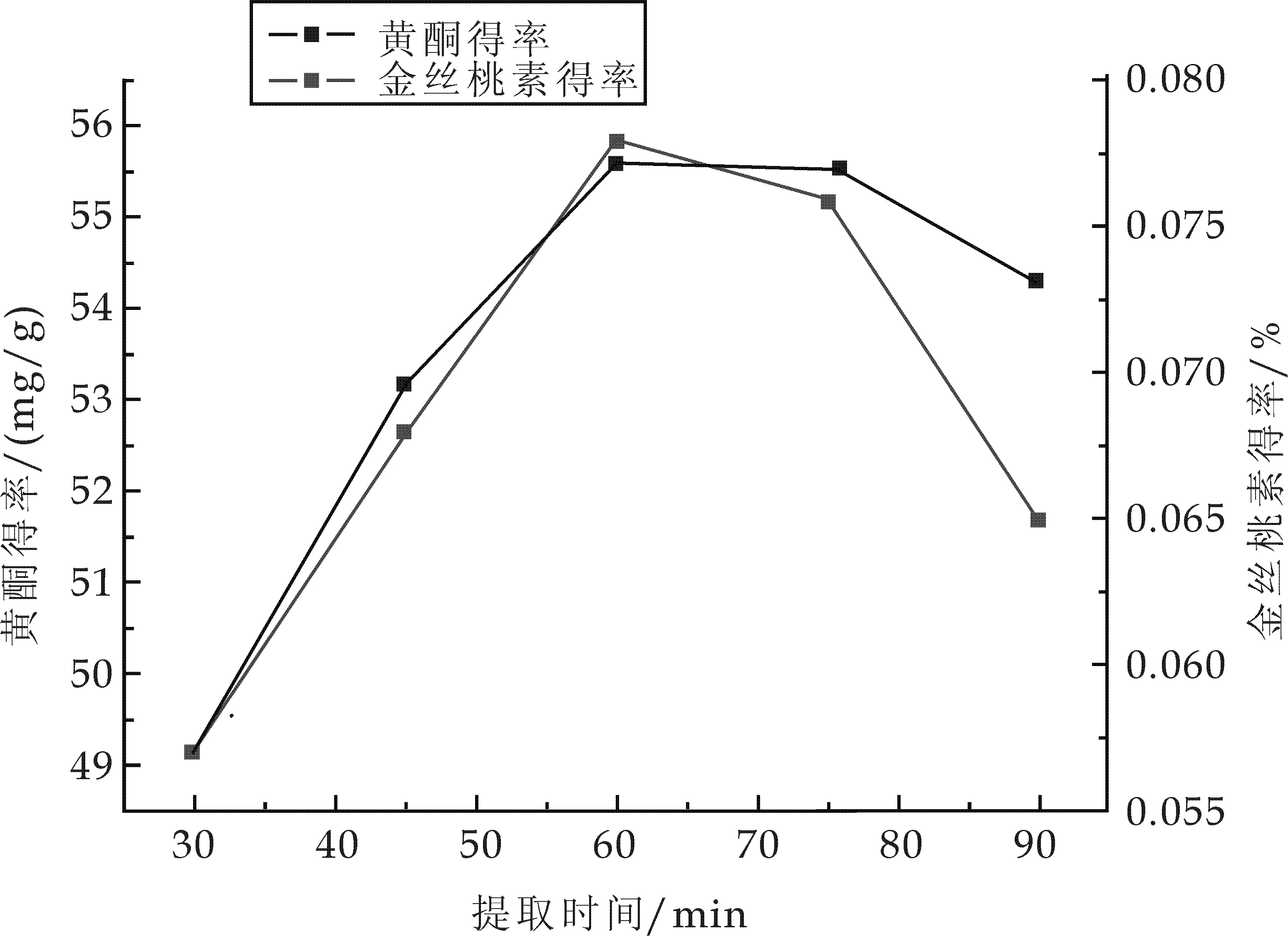
图4 提取时间对黄酮和金丝桃素得率的影响
由图4可知,随着提取时间的增加,黄酮和金丝桃素的得率逐渐增加,当60 min以后,随着时间增加金丝桃素的得率开始降低,而黄酮的得率也逐渐呈下降趋势.这可能是由于超声波较强的机械效应和热效应,长时间作用会破坏金丝桃素和黄酮,因此超声时间选择60 min最佳.
3.1.5 提取次数的影响
精密称取5.0 g的药材粉末3份,以料液比1∶25加入80%乙醇,45 ℃分别超声提取1次、2次、3次,每次60 min,抽滤,测定,计算得率.结果如表1所示.

表1 提取次数对黄酮和金丝桃素得率的影响
由表1可知,提取次数为2次的时候,金丝桃素和黄酮基本提取完全,从经济、节能角度考虑,最佳提取次数为2次.
3.2 提取正交试验结果
在单因素实验的基础上,将提取次数定为2次,选择乙醇浓度、料液比、超声温度、超声时间4个因素,以黄酮和金丝桃素得率为指标,采用L9(34)正交试验设计对提取工艺进行优化,确定最佳工艺条件.因素水平如表2所示,正交试验结果与极差分析如表3所示.
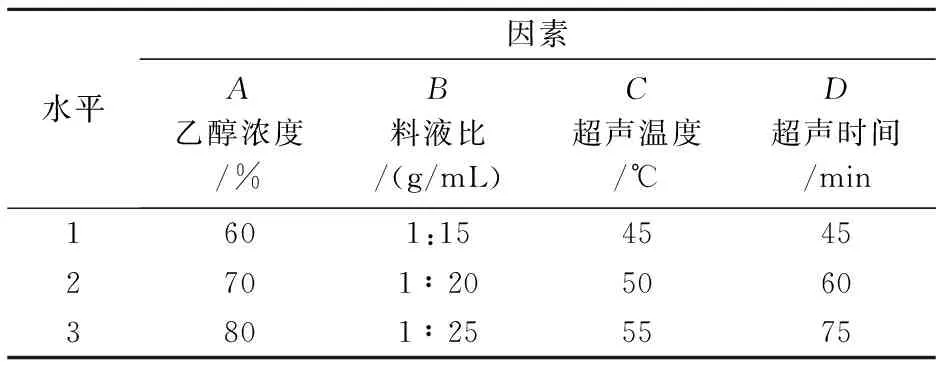
表2 因素水平

表3 正交试验结果
由表3可以看出,影响黄酮类化合物得率的各因素依次是:B>A>D>C,通过比较各水平的K值,得出最佳因素水平组合为B3A2D2C3,即:料液比为1∶25,乙醇体积分数70%,超声时间60 min,超声温度为55 ℃.影响金丝桃素的得率的个影响因素为:A>B>D>C通过比较各水平的K值,得出最佳因素水平组合为A2B3D1C2、A2B3D2C2,通过对比分析,考虑到温度对金丝桃素影响更大,确定最佳提取组合为:A2B3D2C2,即70%乙醇,料液比为1∶25,超声时间60 min,超声温度为50 ℃,提取2次.
3.3 验证实验
采用70%乙醇,料液比为1∶25,超声时间60 min,超声温度50 ℃,提取2次的条件下进行验证实验,结果如表4所示.
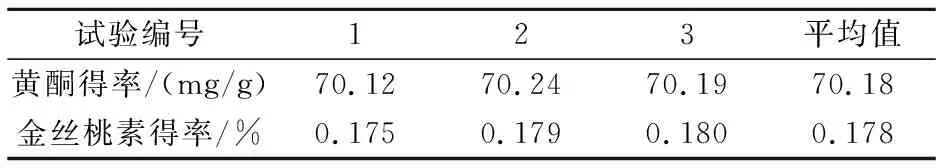
表4 验证实验结果
由表4可以看出,超声波辅助提取黄酮和金丝桃素在最佳工艺条件下总黄酮得率为70.18 mg/g,金丝桃素得率为0.178%,重复性较好,说明该提取工艺基本稳定,结果可靠.
4 结束语
本实验在单因素实验和正交试验基础上,同时对贯叶连翘中金丝桃素和黄酮类化合物进行了提取,两者都有较高得率.采用超声波辅助乙醇提取
的方法,得到最佳提取工艺条件为:料液比1∶25,乙醇浓度70%,超声时间60 min,超声温度为50 ℃,提取2次.该方法操作简单,消耗低,稳定可行,具有一定的推广应用价值.本研究为充分利用我国丰富的贯叶连翘资源,制备高质量的贯叶连翘提取物及其制剂奠定了实验基础,提供了科学依据.
[1] 吴晶晶,何宇新,李 玲.贯叶连翘的研究进展[J].时珍国医国药,2009,20(2):404-405.
[2] Linda K,Ramirez G,Mulrow C D,et al.St.John′s wort for depression-an overview and metal-analysis of randomized clinical trials[J].British Medical Journal,1996,313(7 052):253-258.
[3] Harrer G,Schulz V.Clinical investigation of antidepressant of Hypericum[J].Geriatr Psychiatry Neurol,1994,7(Supple 1):s6.
[4] Barnes J,Anderson L A,Phillipson J D.St John′s wort (Hypericum perforatum L.):a review of its chemistry,pharmacology and clinical properties[J].J Pharm Pharmacol,2001,53(5):583.
[5] 张 筱,卢定强,权 静,等.贯叶连翘抗抑郁研究新进展[J].生物加工过程,2004,2(1):11-15.
[6] Miskovsky P.Hypericin-a new antiviral and antitumor photosensitizer mechanism of action and interaction with biological macromolecules[J].Carr Drug targets,2002,3(1):55-58.
[7] Prince A M,Pascual D,Merudo D.Strategies for evaluation of enveloped virus inactivation in red cell concentrates using hypericin[J].Photochem Photobiol,2000,71(2):188-195.
[8] 潘映红.国产金丝桃属植物有效成分研究概况[J].中药材,1993,16(8):40-42.
[9] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010.
[10] 常德友,杨 靖,董福慧.阿胶对体外培养大鼠成骨细胞增殖、分化功能的影响[J].中国老年学志,2009,29(24):3 230-3 232.
[11] 丁明玉,赵纪萍,李擎阳.贯叶金丝桃提取物中总黄酮的测定方法[J].分析实验室,2001,20(6):45-47.

