创伤后应激障碍大鼠海马、杏仁核神经元自噬和凋亡改变
隋竹欣,刘 昊,王海涛,李 慧,杨占岭,徐爱军,吕翠平,李月春
(河北联合大学:1. 基础医学院组织胚胎学系;2. 附属医院神经内科,河北唐山 063000)
创伤后应激障碍(posttraumatic stress disorder, PTSD)是由异常威胁性或灾难性心理创伤而导致的延迟出现持续的精神障碍,是应激疾病中最为典型的一种。随着战争、社会暴力事件、重大交通事故和自然灾害等创伤意外不断增多,PTSD发生逐年增高[1-2]。PTSD详细的发病机制仍未被阐明。有研究表明,PTSD患者海马、杏仁核等部位出现明显的萎缩、体积缩小现象[3-6],提示在PTSD发病过程中,海马和杏仁核部位神经细胞存在丢失或死亡等病理改变。有学者利用单一连续应激(single-prolonged stress, SPS)复制PTSD大鼠模型,并在海马和杏仁核部位观察到明显的凋亡现象[7-9]。这可能和PTSD海马与杏仁核体积异常有关。自噬(autophagy)和凋亡都属于细胞的程序性死亡方式。PTSD发病中海马、杏仁核部位是否存在异常的自噬现象,尚待进一步研究。本研究利用PTSD模型,探讨海马、杏仁核神经元的自噬和凋亡现象,为海马、杏仁核体积异常提供实验依据。
1 材料与方法
1.1实验动物及试剂健康成年雄性SD大鼠40只,体质量180~210 g(河北联合大学实验动物中心提供,动物合格证编号:SCXK京2009-0004),适应性饲养7 d后用于实验。原位细胞凋亡检测试剂盒(Roch公司),LC-3兔多克隆抗体、Beclin-1羊多克隆抗体和β-actin鼠单克隆抗体(Santz Cruz公司),辣根过氧化物酶标记羊抗兔IgG和免疫印迹相关试剂(武汉博士德生物工程有限公司)。
1.2方法
1.2.1动物分组及PTSD模型的建立 将大鼠随机分为对照组和模型组,每组20只。模型组采用改良的单一连续应激(SPS & S)制备PTSD大鼠模型,即先给予单一连续应激(single-prolonged stress,SPS),包括禁锢2 h、强迫游泳15 min、乙醚麻醉至昏迷,然后给予足底电击(a single inescapable electric foot shock, 10 mA、5 s)。电击后静养7 d,饲养条件:22~25 ℃、昼夜节律、自由饮水摄食。模型组大鼠于静养结束后处死。对照组不做处理。
1.2.2Western blotting检测海马、杏仁核LC-3和Beclin-1的表达 将两组大鼠麻醉后断头取脑,根据图谱在体视显微镜下快速分离海马和杏仁核,提取组织总蛋白。定量后按照30 μg蛋白量上样,进行120 g/L SDS-PAGE电泳,PVDF膜电转印,脱脂奶粉封闭,一抗(LC-3,1∶400;Beclin-1,1∶400,Santz Cruz)4℃孵育过夜,二抗IgG(1∶5 000,Santz Cruz)室温孵育1 h,ECL显色。同样方法进行内参照β-actin的Western blotting分析。以目的条带与内参照的吸光度比值表示目的蛋白的相对表达。
1.2.3TUNEL检测海马、杏仁核神经元的凋亡情况 两组大鼠用40 mL/L水合氯醛溶液(1 mL/100g)腹腔注射麻醉后处死,快速取出脑组织,常规石蜡包埋,5 μm切片。采用TUNEL法原位末端标记DNA片段检测杏仁核神经元凋亡,操作按照检测试剂盒说明书进行。计算TUNEL阳性细胞百分率:阳性细胞百分率=阳性细胞数/细胞总数×100%。
1.2.4流式细胞术检测海马、杏仁核神经元的凋亡率 两组大鼠麻醉后断头取脑组织,分离海马和杏仁核,制成细胞悬液,密度为5×105~1×106/mL。取1 mL细胞,4 ℃离心后弃上清,加入1 mL预冷PBS,悬浮细胞。重复操作3次,弃上清。将细胞重悬于200 μL Binding Buffer液中,加入10 μL Annexin V-FITC和5 μL Propidium Iodide,混匀,避光室温反应15 min。加入300 μL Binding Buffer液,上机检测。

2 结 果
2.1LC-3和Beclin-1的表达水平对照组LC-3有少量的基础表达。定量分析结果显示,对照组、模型组大鼠海马组织LC-3Ⅱ/LC-3Ⅰ表达比值分别为1.07±0.12、2.84±0.19,Beclin-1相对表达分别为0.67±0.10、1.75±0.21。两组大鼠杏仁核组织LC-3Ⅱ/LC-3Ⅰ表达比值分别为0.91±0.10、2.53±0.27,Beclin-1相对表达分别为0.88±0.02、2.35±0.27。模型组高于对照组,差异具有统计学意义(P<0.05)。
2.2两组大鼠海马和杏仁核TUNEL染色结果光镜下对照组可见少量TUNEL阳性细胞,模型组可见较多的TUNEL阳性细胞。分析结果表明,模型组海马、杏仁核TUNEL阳性细胞百分率明显高于对照组,差异有统计学意义(P<0.01,图1)。

图1两组大鼠海马和杏仁核TUNEL阳性细胞百分率的比较
Fig.1 Comparison of TUNEL positive cell percentage of hippocampus and amygdala in rats of the two groups
与对照组比较,**P<0.01。
2.3两组大鼠海马和杏仁核流式细胞术检测结果模型组海马、杏仁核组织凋亡率明显高于对照组,差异具有统计学意义(P<0.01,图2)。
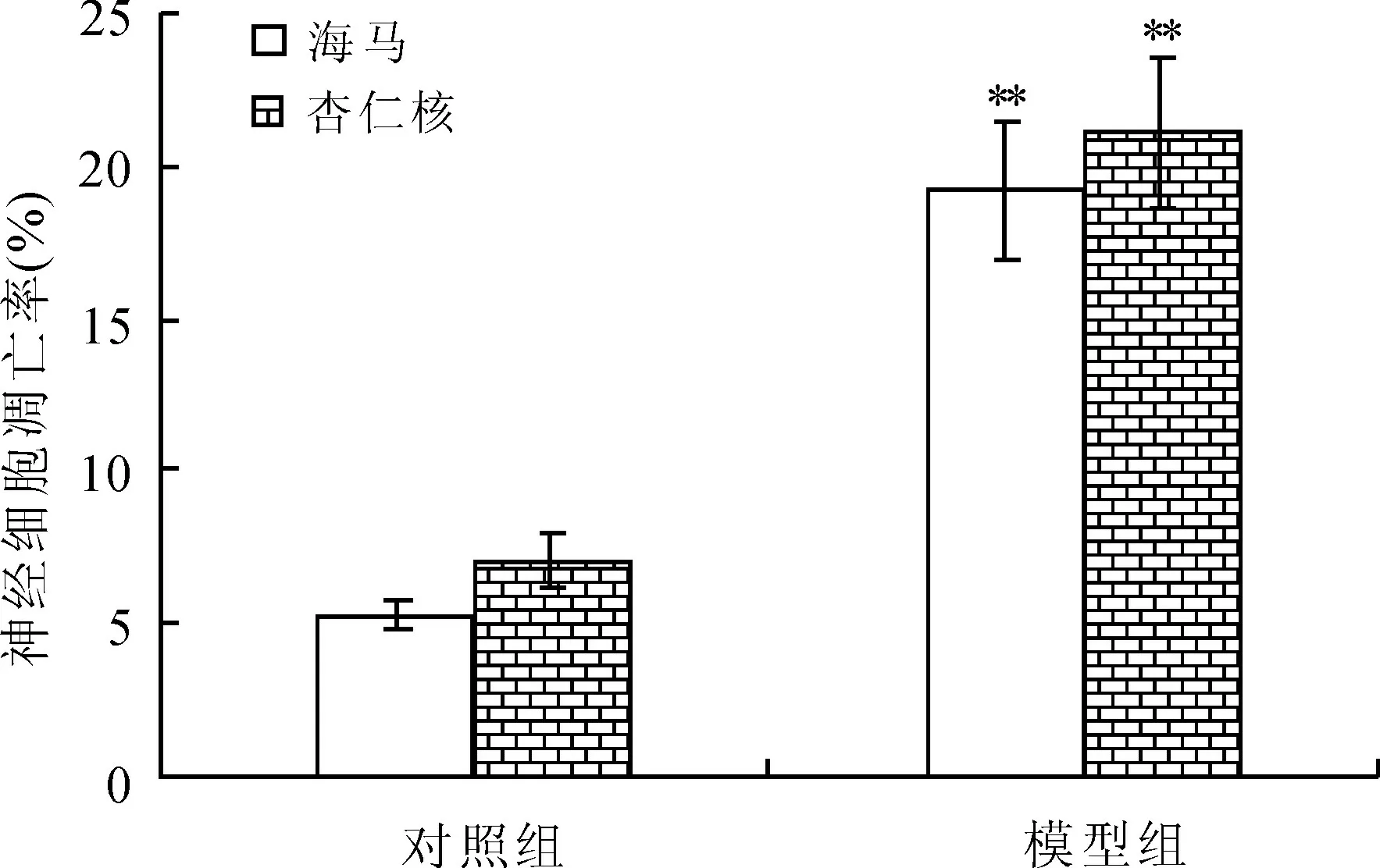
图2两组大鼠海马和杏仁核细胞凋亡率的比较
Fig.2 Comparison of cell apoptosis rate of hippocampus and amygdala in rats of the two groups
与对照组比较,**P<0.01。
3 讨 论
对PTSD的基础研究得益于动物模型的建立。SPS后立即给予不可逃避的足底电击,能使大鼠表现出PTSD临床症状,是研究PTSD较好的动物模型[10]。因此,本研究中采用SPS&S应激建立PTSD模型。海马、杏仁核等结构体积异常是PTSD的病理特征之一[3-6],其原因可能与PTSD大鼠海马、杏仁核部位存在明显的神经细胞凋亡现象有关[7-9]。本实验结果表明,PTSD大鼠海马和杏仁核神经元存在明显的凋亡,这与国内学者的研究结果一致[7-9]。本实验结果还表明,SPS&S应激后大鼠海马、杏仁核自噬相关蛋白LC3-Ⅱ比例增高,Beclin-1明显上调,提示应激后海马、杏仁核神经元存在明显的细胞自噬。
细胞自噬是有别于凋亡的另外一种程序性死亡方式,也称为Ⅱ型程序性死亡。基本过程是细胞通过单层或双层膜包裹待降解物形成自噬体,然后运送到溶酶体形成自噬溶酶体并进行多种酶的消化和降解,以实现细胞本身的代谢需要和细胞器的更新。哺乳动物自噬相关基因产物LC3-Ⅱ是自噬体的标志分子,LC3-Ⅱ/LC3-Ⅰ的比例增大与自噬泡的形成数量相关,是检测自噬的分子指标[11]。自噬另一种相关基因beclin-1的编码产物Beclin-1参与自噬体的早期形成过程,是自噬重要的正调节因子[12]。研究表明,在成年大鼠大脑海马等部位存在Beclin-1的表达[13],提示大鼠海马等部位存在明显的细胞自噬现象。自噬过程在维持中枢神经系统正常功能方面具有重要作用[14]。自噬在掌控细胞命运中起着双重作用,与凋亡关系复杂[15]。正常情况下,自噬处在比较低的基础水平。在轻度应激时,自噬作为促生存机制,被适度激活以保护细胞免于凋亡和坏死;在严重刺激时,自噬被过度激活引起细胞发生程序性死亡,参与多种疾病的发生与发展。在PTSD发病过程中,海马、杏仁核神经细胞存在明显的细胞凋亡和自噬,两者在PTSD发病中的关系有待进一步研究。
参考文献:
[1] NORTH CS, PFEFFERBAUM B, KAWASAKI A, et al. Psychosocial adjustment of directly exposed survivors 7 years after the Oklahoma City bombing[J]. Compr Psychiatry, 2011, 52(1):1-8.
[2] PETERSEN T, ELKLIT A, OLESEN JG. Victimization and PTSD in a Faroese youth total-population sample[J]. Scand J Psychol, 2010, 51(1):56-62.
[3] GOLUB Y, KALTWASSER SF, MAUCH CP, et al. Reduced hippocampus volume in the mouse model of posttraumatic stress disorder[J]. J Psychiatr Res, 2011, 45:650-659.
[4] SCHMAHL C, BERNE K, KRAUSE A, et al. Hippocampus and amygdala volumes in patients with borderline personality disorder with or without posttraumatic stress disorder[J]. J Psychiatry Neurosci, 2009, 34(4):289-295.
[5] BONNE O, VYTHILINGAM M, INAGAKI M, et al. Reduced posterior hippocampal volume in posttraumatic stress disorder[J]. J Clin Psychiatry, 2008, 69(7):1087-1091.
[6] PAVIC L, GREQUREK R, RADOS M, et al. Smaller right hippocampus in war veterans with posttraumatic stress disorder[J]. Psychiatry Res, 2007, 154(2):191-198.
[7] DING JL, HAN F, SHI YX. Single-prolonged stress induces apoptosis in the amygdale in a rat model of posttraumatic stress disorder[J]. J Psychiatr Res, 2010, 44(1):48-55.
[8] LI XM, HAN F, LIU DJ, et al. Single-prolonged stress induced mitochondrial-dependent apoptosis in hippocampus in the rat model of post-traumatic stress disorder[J]. J Chem Neuroanat, 2010, 40(3):248-255.
[9] LI X, HAN F, LIU D, et al. Changes of Bax, Bcl-2 and apoptosis in hippocampus in the rat model of post-traumatic stress disorder[J]. Neurol Res, 2010, 32(6):579-586.
[10] WANG W, LIU Y, ZHENG H, et al. A modified single-prolonged stress disorder model for post-traumatic stress disorder[J]. Neurosci Lett, 2008, 441(2):237-241.
[11] WU JX, DANG YJ, SU W, et al. Molecular cloning and characterization of rat LC3A and LC3B-Two novel markers of autophagosome[J]. Biochem Bio Res Co, 2006, 339:437-442.
[12] PATTINGRE S, LEVINE B. Bcl-2 inhibition of autophagy: A new route to cancer?[J]. Cancer Res, 2006, 66(6):2885-2888.
[13] YU WH, KUMAR A, PETERHOFF C, et al. Autophagic vacuoles are enriched in amyloid precursor protein-secretase activities: implications for beta-amyloid peptide over-production and localization in Alzheimer’s disease[J]. Int J Biochem Cell Biol, 2004, 36(12):2531-2540.
[14] FELBOR U, KESSLER B, MOTHES W, et al. Neuronal loss and brain atrophy in mice lacking cathepsins B and L[J]. Proc Natl Acad Sci USA, 2002, 99(12):7883-7888.
[15] YORIMITSU T, NAIR U, YANG Z, et al. Endoplasmic reticulum stress triggers autophagy[J]. J Biol Chem, 2006, 281(40):30299-30304.

