胰腺癌神经浸润相关分子表达及作用的研究进展
党诚学,刁冬梅
(西安交通大学医学院第一附属医院肿瘤外科,陕西西安 710061)
众所周知,进展期胰腺癌不仅能侵袭周边组织、血管和淋巴管系统,还易侵犯周围神经,造成机体的疼痛和促进肿瘤的转移[1-3]。神经周浸润(perineural invasion, PNI)在胰腺癌中极为常见,并和疼痛密切相关[4]。目前,众多学者用神经浸润(neural invasion, NI)替代PNI,LEIBIG等[4]对PNI的定义为,肿瘤细胞沿神经生长或在神经鞘的内膜、神经束膜和外膜上任一层发现肿瘤细胞,也包括肿瘤环绕神经所覆盖的区域超过了1/3以上的神经纤维本体。关于PNI的发生机制还不甚清楚[5]。有观点认为,PNI的发生是因胰腺与神经间存在低阻力裂隙,当肿瘤细胞通过裂隙浸润了外层的神经鞘后,侵入的肿瘤细胞受到的免疫损伤将明显减少,肿瘤微环境将利于肿瘤进一步沿神经元浸润和转移,并引起疼痛[5]。也有研究认为,PNI可能因肿瘤细胞和神经之间相互分泌神经递质,进而相互吸引所致[4,6]。许多信号分子包括神经营养因子、细胞因子以及细胞表面配体及受体参与肿瘤细胞PNI的过程,如图1所示。以下就目前国内外对胰腺癌PNI较为深入的细胞分子机制研究结果做简要综述。
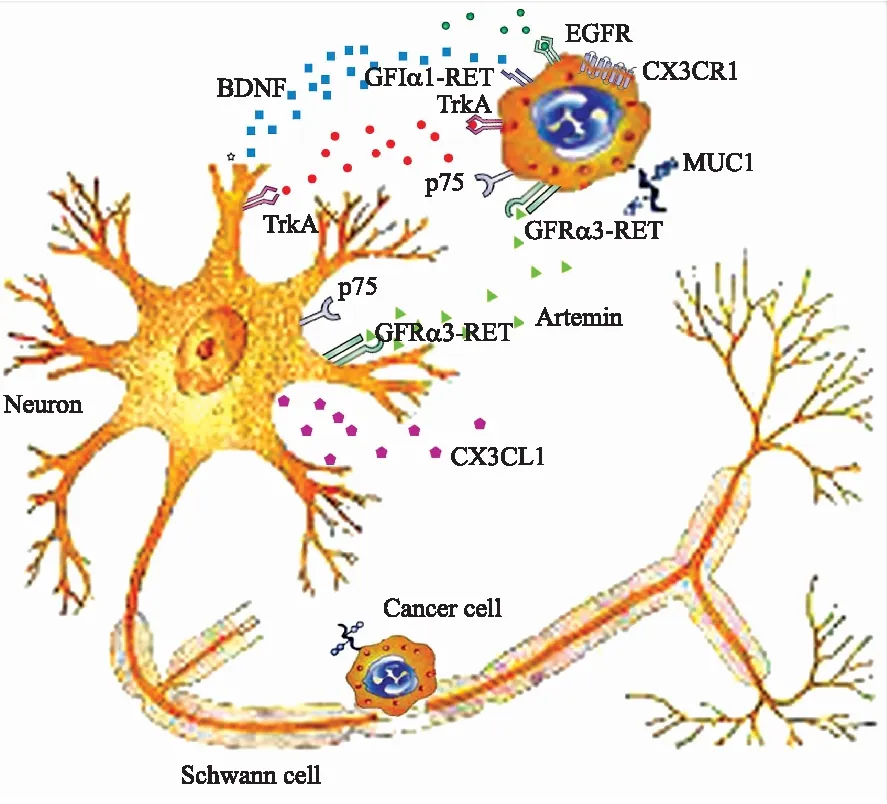
图1胰腺癌PNI相关的分子及作用靶点
Fig.1 Molecules and their receptors involved in PNI in pancreatic cancer
1 神经生长因子及其受体
神经营养因子是神经元以及胰腺癌细胞分泌的信号分子,对细胞的生命活动有一定的作用。神经元以及癌细胞一些重要信号通路的激活与神经营养因子及其受体的结合密切相关。不同的受体可以活化不同的信号通路,其中包括与生长、神经因子相关基因的活化、生存以及分化等。
神经生长因子家族是神经营养因子中研究较为深入的家族之一,包括4种重要的成员:神经生长因子(nerve growth factor, NGF)、脑源性神经营养因子(brain derived neurophic factor, BDNF)、神经营养因子3(neurotrophin 3, NTF3)、神经营养因子4(neurotrophin 4, NTF4)。不同神经生长因子的受体不尽相同,但在胰腺癌中都能够促进肿瘤细胞的生存和增殖。NGF受体主要有高亲和性的酪氨酸激酶受体Trk家族和低亲和性的肿瘤坏死因子受体p75。胰腺癌细胞及周围神经细胞中NGF、TrkA、p75受体的增加在多个研究中都有报道,并且胰腺癌组织中NGF及TrkA的表达与PNI的发生密切相关[3,7]。我们以往的研究发现,在胰腺癌组织中,TrkA和p75的表达水平均与疼痛及神经浸润有关,TrkA与p75表达水平负相关且与患者的总体预后相关[8],后续的细胞实验也发现TrkA高表达的胰腺癌细胞株具有较强的增殖及侵袭能力[9]。在共培养的模型中发现,胰腺癌细胞会向背根神经节的突触生长,而神经突触向癌细胞方向的密度和长度也增加[10]。可能的机制是癌细胞能够分泌NGF,并与神经细胞表达的TrkA相互作用,导致癌细胞以及神经元相互吸引。关于p75对于PNI及预后的研究目前尚存争议。我们既往的研究发现p75的表达与PNI的存在及疼痛负相关,也有研究认为取决于TrkA与p75的表达比率[4]。
对于其他神经生长因子,有相关研究认为高水平BDNF与癌细胞的增殖及侵袭有关,并促进PNI的发生,其受体TrkB在转移性胰腺导管癌中的的表达增加且与PNI相关[4]。另外,胶质细胞源性营养因子(glialcellline derived neurotrophic factor, GDNF)也可以促进细胞生长、分化、神经突的分叉及生长以及细胞存活的信号通路。已有研究证实,在胰腺癌细胞中GDNF、GFRa1-RET的表达增加以及神经元细胞释放GDNF增加导致癌细胞的侵袭能力增强[11]。
2 细胞因子及受体
众多实验表明,在不同胰腺癌细胞株中均存在多种细胞因子和趋化因子的异常表达,提示趋化因子及其受体的结合可能对促进细胞之间的粘附,并影响胰腺癌细胞的神经浸润和向周边组织的侵袭方面起到一定的作用[12]。MARCHESI[12]指出,趋化因子CXCR1及其配体CX3CL1的结合在体外可促进胰腺癌细胞对神经元的侵袭;免疫组化的结果提示,高表达的CX3CR1与PNI的发生有相关性;进一步的细胞转染和小鼠动物实验中也证实了高表达的CX3CR1可促进肿瘤对神经的侵袭。神经中表达CX3CL1也证实了胰腺癌PNI是一种多方面多分子共同作用的结果,其中CXCL1-CX3CR1信号通路可能通过影响细胞的黏附参与PNI。以上的证据同时也表明CX3CL1-CX3CR1是治疗PNI的潜在靶点。除此之外,轴突导向分子脑信号蛋白(axonal-guidance molecule semaphorin 3A, SEMA3A)及其受体丛状蛋白(plexin A1, PLXA1)和神经纤毛蛋白(neuropilin 1, NRP1)在胰腺癌组织中表达升高且与患者不断降低的生存期和增强的肿瘤侵袭、转移潜能相关[13]。
3 基质金属蛋白酶
基质金属蛋白酶(matrix metalloproteinases, MMP)在降解细胞外基质,促进肿瘤细胞浸润和迁移的过程中起着重要作用。在多种肿瘤中都发现了MMP的过高表达,而高表达的MMP同时也预示着不良的预后。在胰腺癌的发生和发展中,多种MMP家族成员随着肿瘤的进展过程表达异常增高[14-15]。胰腺癌MMP异常增高的机制尚未明确。但是,有研究发现,在GDNF的刺激下MMP9将出现大量的活化并显著增强细胞的侵袭转移,在NGF与TrkA相互作用后,也能激活肿瘤细胞MMP2,增加细胞的侵袭和转移能力[15]。
4 细胞表面分子
具有神经侵袭性的胰腺癌细胞可以通过分泌细胞表面蛋白(例如,mucin1、MUC1、Ⅰ型穿膜蛋白)作用于Schwann细胞[4]。MUC1在胰腺癌细胞中高表达,它具有一不规则糖基化细胞外端点,这种细胞外端点是髓鞘相关糖蛋白(myelin associated glycoprotein, MAG)的特异性受体,MAG是一种Schwann细胞中高表达的糖蛋白。SWANSON等[16]最近研究发现MUC1及MAG相互作用的增加与PNI相关。除了作为MAG的配基,MUC1在细胞内的磷酸化也参与胰腺癌细胞增殖转移的相关信号通路活化,故MUC1-MAG信号通路不仅能够促进胰腺癌细胞的增殖和侵袭,并且可协助癌细胞与Swchwann细胞的接触导致PNI[17]。另外,据报道,有两种细胞跨膜糖蛋白,即神经细胞黏附分子(neural cell adhesion molecule, NCAM)和L1细胞黏附分子(L1 cell adhesion molecule, L1CAM)也参与PNI的过程。其中NCAM在多聚唾液酸(polysialylation, PSA)作用下会发生穿膜改变,进而影响钙黏蛋白的粘附能力,降低细胞的浸润和转移[18]。而BEN等[19]研究发现,L1CAM在胰腺导管腺癌中表达升高,且与不良预后及PNI有关。但是,目前尚缺乏机制性的实验研究对此加以证明。
5 其他相关因素
一些糖蛋白等分子也参与胰腺癌的PNI,其中包括CD74、Ⅱ型穿膜糖蛋白、具有γ-链的人白细胞抗原DR (human leukocyte antigen DR, HLA-DR),后者也是主要组织兼容性系统Ⅱ(major histocompatibility complex class Ⅱ, MHCⅡ)受体。CD74在胰腺导管腺癌中的表达升高并且与HLA-DR的α-及β-链相关,它们的相互作用能够降低宿主对癌细胞的免疫作用。此外,也有报道认为CD74具有调节生存信号和促进侵袭等功能[20],提示CD74不仅可以增加癌细胞的侵袭和PNI,也可以保护癌细胞逃避免疫杀伤。另外,TGD-β1、PCNA 、增殖抗原ki-67、生存相关基因MALT1、TRAF2等基因的改变,在影响胰腺癌细胞生存/凋亡比例、细胞周期、侵袭性和嗜神经性等方面都起到了一定的作用[11]。
6 神经浸润和疼痛的产生
疼痛是PNI最常见和最直接的后果,PNI造成的疼痛用常规的止痛药物,如阿片类、非甾体抗炎药等治疗均效果不佳。而肿瘤细胞对神经鞘的损伤,使得神经元容易受到细胞微环境中各种物质的刺激引起频繁的神经冲动,导致难以缓解的疼痛[21]。并且,胰腺癌细胞与神经细胞之间的空隙可以促进肿瘤的生长和转移,进而导致神经元的异常肥大,增加了对环境刺激的敏感性[21-22]。肿瘤的血管形成和新生的异常神经纤维都会对神经元造成持续的刺激和疼痛。影响疼痛的重要分子有VEGF、ARTN、白细胞介素、前列腺素等,其也可以影响肿瘤新生血管和神经的重构[17]。一些信号通路,比如NGF-TrkA和NGF-p75信号通路可以形成神经源性过敏反应造成疼痛。并且,NGF可以介导TRPV1的高表达,TRPV1功能类似于钠钾离子通道,可以促进神经元的去极化以及释放疼痛相关的神经递质,如降钙素基因相关肽(calcitonin gene-related peptide, CGRP)、P物质,进而产生中枢疼痛信号,造成疼痛[23-24]。胰腺癌中TRPV1的过表达,尤其在与TrkA共表达时,造成的疼痛较为明显。
7 对PNI以及疼痛的治疗策略
由于胰腺癌患者PNI产生的疼痛剧烈,且由常规止痛药物难以控制。抑制PNI及其产生的疼痛,对延缓肿瘤的进展和改善患者的生存质量,都是至关重要的。高特异性的靶向治疗是最先被考虑的,其中阻断NGF-TrkA信号通路的研究最深入并最受关注[7],它可能在胰腺癌的治疗新策略如糖酵解抑制剂的治疗中发挥一定的作用[25-26]。目前,人源性单克隆抗体Tanezumab也正用于二期临床试验,用于缓解前列腺癌、乳腺癌以及其他肿瘤的转移性疼痛[7]。MNAC13也是高亲和性抗体,与阿片类药物的协同作用可以缓解神经性疼痛和炎症反应造成的疼痛[27]。同时,抑制Trks酪氨酸激酶家族的药物也已作为可能的抗肿瘤药物并应用于临床试验[28]。目前,一、二期临床试验结果表明,NGF-TrkA靶向抑制剂不但可以抑制肿瘤的生长,在缓解PNI以及相关疼痛上也可以起到一定作用[29]。另外,TRPV1拮抗剂[30]、CX3CR1拮抗剂[31]等,都在初步试验中被证明可以抑制胰腺癌造成的PNI和疼痛,具有一定的临床研究前景。
8 总结与展望
尽管治疗手段日臻完善,胰腺癌依然是死亡率高、预后不佳的疾病。进展期胰腺癌的PNI与肿瘤的疼痛、复发和转移密切相关。目前,已有大量对胰腺癌PNI和疼痛的机制如各类信号通路、酶、细胞和组织因子等进行更加深入的研究[1]。同时,对肿瘤间质组织的研究也已经有所起步。针对引起胰腺癌PNI的可能途径,如通过阻断NGF信号通路等治疗手段,可以适当缓解肿瘤疼痛,并在一定程度上抑制肿瘤的进展。目前的研究还处于一二期临床试验,临床上尚无有效抑制中晚期胰腺癌疼痛,改善生存质量的治疗方法。通过进一步完善动物模型和各类药物的不断尝试和发展,对PNI的生物学意义和机制将会不断有更深入的研究和了解,为治疗胰腺癌和控制进展期胰腺癌引起的PNI和疼痛,提高患者生存质量提供理论指导和科学依据。
参考文献:
[1] BAPAT AA, HOSTETTER G, VON HOFF DD, et al. Perineural invasion and associated pain in pancreatic cancer[J]. Nat Rev Cancer, 2011, 11(10):695-707.
[2] 张勇,闫宇,党诚学. 胰腺癌细胞的嗜神经性与PNI机理的研究进展[J]. 中国普外基础与临床杂志,2011,18(1):21-25.
[3] ZHANG Y, DANG C, MA Q, et al. Predictors of systemic chemotherapy contraindication in pancreatic cancer patients with distant metastasis[J]. Hepatogastroenterology, 2007, 54(73):254-259.
[4] LIEBIG C, AYALA G, WILKS JA, et al. Perineural invasion in cancer:a review of the literature[J]. Cancer, 2009, 115(15):3379-3391.
[5] ZHOU Y, ZHOU Q, CHEN R. Pancreatic stellate cells promotes the perineural invasion in pancreatic cancer[J]. Med Hypotheses, 2012, 78(6):811-813.
[6] CHEN W, DONG S, ZHOU J, et al. Investigation of myoepithelial cell differentiation into Schwann-like cells in salivary adenoid cystic carcinoma associated with perineural invasion[J]. Mol Med Report, 2012, 6(4):755-759.
[7] WOOD JN. Nerve growth factor and pain[J]. N Engl J Med, 2010, 363(16):1572-1573.
[8] DANG C, ZHANG Y, MA Q, et al. Expression of nerve growth factor receptors is correlated with progression and prognosis of human pancreatic cancer[J]. J Gastroenterol Hepatol, 2006, 21(5):850-858.
[9] 刁冬梅,宋永春,侯妮,等. 神经生长因子对不同胰腺癌细胞的刺激作用及其与细胞Trk-A表达的关系[J]. 南方医科大学学报,2012,32(3):296-300.
[10] DAI H, LI R, WHEELER T, et al. Enhanced survival in perineural invasion of pancreatic cancer: aninvitroapproach[J]. Hum Pathol, 2007, 38(2):299-307.
[11] GIL Z, CAVEL O, KELLY K, et al. Paracrine regulation of pancreatic cancer cell invasion by peripheral nerves[J]. J Natl Cancer Inst, 2010, 102(2):107-118.
[12] MARCHESI F, LOCATELLI M, SOLINAS G, et al. Role of CX3CR1/CX3CL1 axis in primary and secondary involvement of the nervous system by cancer[J]. J Neuroimmunol, 2010, 224(1-2):39-44.
[13] MÜLLER MW, GIESE NA, SWIERCZ JM, et al. Association of axon guidance factor semaphorin 3A with poor outcome in pancreatic cancer[J]. Int J Cancer, 2007, 121(11):2421-2433.
[14] ZHI YH, SONG MM, WANG PL, et al. Suppression of matrix metalloproteinase-2 via RNA interference inhibits pancreatic carcinoma cell invasiveness and adhesion[J]. World J Gastroenterol, 2009, 15(9):1072-1078.
[15] PRYCZYNICZ A, GUZISKA-USTYMOWICZ K, DYMICKA-PIEKARSKA V, et al. Expression of matrix metalloproteinase 9 in pancreatic ductal carcinoma is associated with tumor metastasis formation[J]. Folia Histochem Cytobiol, 2007, 45(1):37-40.
[16] SWANSON BJ, MCDERMOTT KM, SINGH PK, et al. MUC1 is a counter-receptor for myelin-associated glycoprotein (Siglec-4a) and their interaction contributes to adhesion in pancreatic cancer perineural invasion[J]. Cancer Res, 2007, 67(21):10222-10229.
[17] SINGH PK, WEN Y, SWANSON BJ, et al. Platelet-derived growth factor receptor beta-mediated phosphorylation of MUC1 enhances invasiveness in pancreatic adenocarcinoma cells[J]. Cancer Res, 2007, 67(11):5201-5210.
[18] SCHREIBER SC, GIEHL K, KASTILAN C, et al. Polysialylated NCAM represses E-cadherin-mediated cell-cell adhesion in pancreatic tumor cells[J]. Gastroenterology, 2008, 134(5):1555-1566.
[19] BEN QW, WANG JC, LIU J, et al. Positive expression of L1-CAM is associated with perineural invasion and poor outcome in pancreatic ductal adenocarcinoma[J]. Ann Surg Oncol, 2010, 17(8):2213-2221.
[20] NAGATA S, JIN YF, YOSHIZATO K, et al. CD74 is a novel prognostic factor for patients with pancreatic cancer receiving multimodal therapy[J]. Ann Surg Oncol, 2009, 16(9):2531-2538.
[21] CEYHAN GO, MICHALSKI CW, DEMIR IE, et al. Pancreatic pain[J]. Best Pract Res Clin Gastroenterol, 2008, 22(1):31-44.
[22] DI MOLA FF, DI SEBASTIANO P. Pain and pain generation in pancreatic cancer[J]. Langenbecks Arch Surg, 2008, 393(6):919-922.
[23] JARA-OSEGUERA A, SIMON SA, ROSENBAUM T. TRPV1:on the road to pain relief[J]. Curr Mol Pharmacol, 2008, 1(3):255-269.
[24] NILIUS B, OWSIANIK G, VOETS T, et al. Transient receptor potential cation channels in disease[J]. Physiol Rev, 2007, 87(1):165-217.
[25] CHENG Y, DIAO DM, ZHANG H, et al. Proliferation enhanced by NGF-NTRK1 signaling makes pancreatic cancer cells more sensitive to 2DG-Induced apoptosis[J]. Int J Med Sci, 2013, 10(5):634-640.
[26] 程遥,刁冬梅,宋永春,等. 2-脱氧葡萄糖在抗肿瘤领域的研究进展[J]. 中国肿瘤临床,2012(17):1325-1328.
[27] UGOLINI G, MARINELLI S, COVACEUSZACH S, et al. The function neutralizing anti-TrkA antibody MNAC13 reduces inflammatory and neuropathic pain[J]. Proc Natl Acad Sci U S A, 2007, 104(8):2985-2990.
[28] WANG T, YU D, LAMB ML. Trk kinase inhibitors as new treatments for cancer and pain[J]. Expert Opin Ther Pat, 2009, 19(3):305-319.
[29] ALBANESE C, ALZANI R, AMBOLDI N, et al. Dual targeting of CDK and tropomyosin receptor kinase families by the oral inhibitor PHA-848125, an agent with broad-spectrum antitumor efficacy[J]. Mol Cancer Ther, 2010, 9(8):2243-2254.
[30] WONG GY, GAVVA NR. Therapeutic potential of vanilloid receptor TRPV1 agonists and antagonists as analgesics:Recent advances and setbacks[J]. Brain Res Rev, 2009, 60(1):267-277.
[31] DORGHAM K, GHADIRI A, HERMAND P, et al. An engineered CX3CR1 antagonist endowed with anti-inflammatory activity[J]. J Leukoc Biol, 2009, 86(4):903-911.

