GSTM1基因多态性及启动子甲基化在 结肠癌细胞系中的研究
田筱青,孙丹凤,房静远
(上海交通大学医学院附属仁济医院消化科,上海市消化疾病研究所,上海 200001)
谷胱甘肽-S-转移酶M1(glutathione-s-transferase, GSTM1)是Ⅱ相代谢酶GST家族重要成员,催化其活性基团谷胱甘肽与前致癌物结合,增加后者水溶性,促进其排出体外。GSTM1具有(+/+)、(+/-)、(-/-)3种基因型,前两种基因型为非空白基因型,而(-/-)基因型又称为空白基因型。空白基因型因为基因纯合缺失,故无相应的蛋白酶活性,不能对致癌物质进行有效代谢清除,导致有害物质体内蓄积,损伤细胞和遗传物质,从而增加肿瘤发生的危险性。GSTM1基因启动子甲基化是调控该基因表达的表观遗传方式。本研究检测6种结肠癌细胞系中GSTM1基因型、甲基化状态、转录水平及去甲基化药物对GSTM1基因转录的影响,探讨GSTM1基因在结肠癌细胞中的遗传和表观遗传状况及对基因表达的调控作用。
1 材料与方法
1.1细胞培养HT29、HCT116、SW480、SW1116、Lovo、colo结肠癌细胞系为上海市消化疾病研究所保存。在37 ℃、50 mL/L CO2的条件下,HT29和HCT116培养于MaCOY’s 5A中,SW480、SW1116、Lovo、colo培养于RPMI 1640中。去甲基化药物5-aza-dC(Sigma公司)终浓度5 μmol/L处理结肠癌细胞系72 h,等体积的DMSO处理细胞作为溶剂对照。
1.2DNA提取及多重PCR检测提取结肠癌细胞系基因组DNA,紫外分光度计检测DNA含量和纯度(A260/A280>1.8)。以结肠癌细胞系DNA为模板,行多重PCR检测,GSTM1扩增产物273 bp,引物序列为5′-CTGCCCTACTTGATTGATGGG-3′,5′-CTGGATTGTAGCAGATCATGC-3′,同时扩增interferonb为内参照,扩增产物170 bp,引物为5′-GGCACAACAGGTAGTAGGCG-3′,5′-GCCACA-
GGAGCTTCTGACAC-3′。PCR反应总体积20 μL,模板DNA 2 μL,10 μmol/L上下游引物各1 μL,10 mmol/L dNTP混合物1 μL,Taq酶1 U。94 ℃变性45 s,56 ℃退火30 s,72 ℃延伸45 s,72 ℃延伸10 min。双蒸水代替DNA进行PCR作阴性对照。20 g/L琼脂糖凝胶中电泳。
1.3甲基化特异PCR(MSP)检测重硫酸氢盐修饰:取DNA约1 μg,加入终浓度0.3 mol/L的NaOH中,37 ℃水浴30 min;3.9 mol/L亚硫酸氢钠 (pH 5.0)520 μL与10 mmol/L对苯二酚30 μL混合,加入碱变性后的DNA 50 μL,覆盖矿物油,55 ℃水浴18 h。
模板DNA纯化:经过碱基修饰的DNA用Wizard DNA纯化试剂盒纯化。0.3 mol/L NaOH与纯化DNA反应去除硫化基团,乙酸钠、乙醇沉淀DNA,去离子水重悬,-20 ℃保存。
PCR扩增:采用GSTM1基因特异的甲基化引物(5′- GAAGTTGGCGAGGTCGAGTTTC-3′,5′-ACCCGCCACAACCCGAAAAACG-3′)和非甲基化引物(5′-GGGAAGTTGGTGAGGTTGAGTTTT-3′,5′-CAACCCACCACAACCCAAAAAACA-3′)对修饰后的DNA进行扩增。PCR反应总体积20 μL,模板DNA 2 μL,10 μmol/L上下游引物各1 μL,10 mmol/L dNTP混合物1 μL,热启动Taq酶1 U。94 ℃变性45 s,59 ℃退火30 s,72 ℃延伸45 s,72 ℃延伸10 min。双蒸水代替DNA进行PCR作阴性对照。20 g/L琼脂糖凝胶中电泳。扩增产物送上海生工生物工程公司测序。
1.4细胞总RNA提取及RT-PCR检测Trizol法提取经5-aza-dC和DMSO处理后的细胞总RNA,甲醛电泳检测RNA完整性,-20 ℃保存。
取结肠癌细胞系RNA 5 μL,70 ℃变性5 min后依次加入5×反转录缓冲液、dNTPs、随机引物0.5 μg、MLV反转录酶(美国Promega公司)300 U,总反应体积20 μL。42 ℃反应60 min,70 ℃加热10 min终止反应。然后用反转录液进行PCR反应,反应引物序列为5′-ACTTTCCCAATCTGCCCTAC-3′,5′-TTCTGGATTGTAGCAGATCA-3′,β-actin作内对照,电泳分析。
2 结 果
2.1多重PCR结果GSTM1非空白基因型的DNA样品,经PCR扩增后为273 bp、170 bp两条带,而空白基因型只有170 bp一条带(图1)。模板中即使只有1个基因拷贝,经PCR扩增后也有产物产生。因此,非空白基因型包括有两个基因拷贝的纯合子和只有一个基因拷贝的杂合子,而空白基因型则为纯合子基因缺失。结肠癌细胞系HT29、SW480、SW1116为GSTM1非空白基因型,而HCT116、Lovo、Colo结肠癌细胞系为GSTM1空白基因型。

图1结肠癌细胞系中GSTM1基因型检测结果
Fig.1 Genotypes of GSTM1 in colon cancer cell lines
2.2MSP结果GSTM1基因在5个结肠癌细胞系HT29、HCT116、SW480、Lovo、Colo中呈启动子甲基化状态,而在SW1116细胞中主要为非甲基化状态,甲基化条带也有扩增(图2)。
2.3RT-PCR结果在5个结肠癌细胞系HT29、HCT116、SW480、Lovo、Colo中RT-PCR方法检测无GSTM1基因扩增,仅SW1116细胞中有GSTM1基因扩增。细胞经过5-aza-dC去甲基化处理后,发现在HT29和SW480细胞中GSTM1基因表达复活,而HCT116、Lovo、Colo细胞中GSTM1仍无扩增(图3)。

图2结肠癌细胞系中GSTM1基因启动子甲基化结果及测序图
Fig.2 MSP and sequencing results of GSTM1 promoter in colon cancer cell lines
m:甲基化扩增产物;u:非甲基化扩增产物。
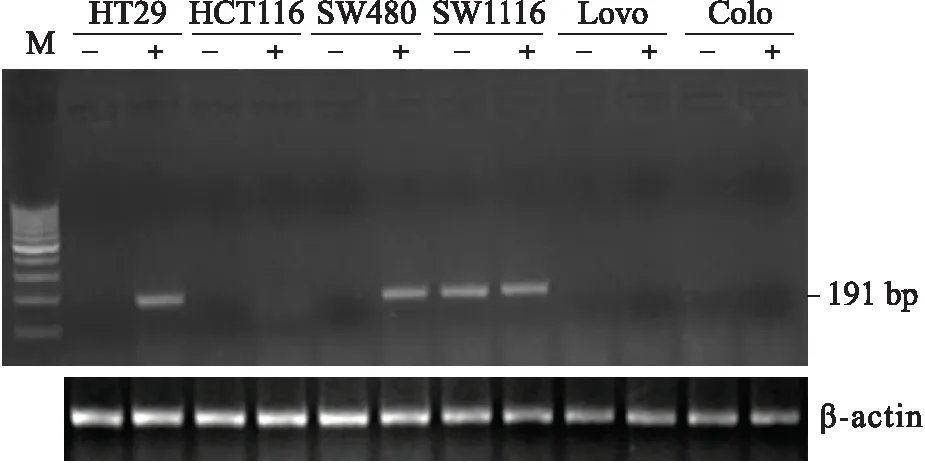
图35-aza-dC处理结肠癌细胞系后GSTM1基因表达变化
Fig.3 RT-PCR result of GSTM1 gene expression in colon cancer cell lines treatedwith 5-aza-dC
3 讨 论
目前多认为肿瘤的发生受到遗传和环境因素的共同影响。致癌物质代谢过程中个体基因型的不同可参与决定个体发生肿瘤的易患性。环境与基因共同作用与肿瘤发生的关系越来越受到研究者的注意。GSTM1是Ⅱ相代谢酶GSTs家族的成员,参与外源化合物的代谢解毒过程[1]。即GSTM1基因表达水平低,则GSTM1酶活性降低,对外界致癌物、致突变物的代谢能力下降,肿瘤易患性增加。
国内外多项研究报道GSTM1表达水平与结肠癌发生密切相关。其中从遗传角度分析GSTM1基因型与结肠癌易患性的研究结论不一,存在争议。GSTM1(-/-)称为GSTM1空白基因型,该基因型个体不能表达GSTM1,因而酶活性下降。国外有学者研究认为GSTM1空白基因型与结肠癌发生相关[2-4],但是也有学者分析结肠癌患者基因型后,认为结肠癌的发生与GSTM1空白基因型不相关[5]。因此,我们推测GSTM1基因表达是否不仅只受到遗传层面的调控。
表观遗传调控是在不改变基因序列的情况下,对DNA或者组蛋白进行特定修饰,进而影响基因转录的调控方式。其中DNA甲基化是重要的表观遗传调控方式之一。基因启动子区高度甲基化可引起该基因转录抑制、表达静默。国外研究报道GSTM1基因启动子甲基化与多种肿瘤密切相关,如可能与头颈部肿瘤发生相关[6],还与急性白血病的预后有关[7]。但是目前无研究报道细致分析结肠癌细胞系中GSTM1基因的表达状态、遗传基因型、DNA甲基化状态及其三者之间的关系。
本研究发现6个结肠癌细胞系中除了SW1116细胞以外,均存在GSTM1基因表达缺失,而其中只有HCT116、Lovo、Colo 3种细胞系为GSTM1空白基因型,而且其GSTM1基因启动子呈甲基化状态,但是去甲基化药物不能使GSTM1表达复活,故其GSTM1基因表达缺失是遗传学空白基因型造成的;另外,HT29、SW480细胞系中GSTM1基因表达缺失,但是甲基化分析表明此两种细胞系中GSTM1基因呈启动子甲基化状态,去甲基化药物处理后,基因表达复活,故此两种细胞系中GSTM1基因表达缺失是由DNA甲基化造成,GSTM1基因并非为空白基因型。SW1116细胞中GSTM1基因为非空白基因型,而且启动子主要呈现非甲基化状态,可以检测到GSTM1基因表达,提示SW1116结肠癌细胞系中GSTM1基因不受以上遗传学和表观遗传学调控。
以上研究结果证明GSTM1基因表达缺失是由于空白基因型和DNA甲基化两种方式共同引起。与GSTM1基因类似的受到遗传和表观遗传共同调控的基因很多,例如抑癌基因RUNX3。杂合缺失和启动子甲基化均调控RUNX3表达[8]。因而在肿瘤相关基因研究中,需要结合遗传学和表观遗传学。既往单独从遗传学角度分析GSTM1基因型与结肠癌关系的研究不够全面,未来需要进一步结合两者共同分析。尤其是完善结肠癌实体肿瘤中GSTM1基因型和DNA甲基化状态的研究更具有重要意义。另外,如何利用DNA甲基化的可逆性,调控GSTM1基因表达,提高其酶活性,降低肿瘤易患性,也是有意义的课题,有可能为GSTM1基因与结肠癌相关性研究提供更多的思路。
参考文献:
[1] HOENSCH H, PETERS WH, ROELOFS HM, et al. Expression of the glutathione enzyme system of human colon mucosa by localization, gender and age[J]. Curr Med Res Opin, 2006, 22(6):1075-1083.
[2] KOH WP, NELSON HH, YUAN JM, et al. Glutathione S-transferase(GST) gene polymorphisms, cigarette smoking and colorectal cancer risk among Chinese in Singapore[J]. Carcinogenesis, 2011, 32(10):1507-1511.
[3] WANG J, JIANG J, ZHAO Y, et al. Genetic polymorphisms of glutathione S-transferase genes and susceptibility to colorectal cancer: a case-control study in an Indian population[J]. Cancer Epidemiol, 2011, 35(1):66-72.
[4] ZUPA A, SQAMBATO A, BIANCHINO G, et al. GSTM1 and Nat2 polymorphisms and colon, lung and bladder cancer risk: a case-control study[J]. Anticancer Res, 2009, 29(5):1709-1714.
[5] CSEJTEI A, TIBOLD A, VARGA Z, et al. GSTM1, GSTT and p53 polymorphisms as modifiers of clinical outcome in colorectal cancer[J]. Anticancer Res, 2008, 28(3B):1917-1922.
[6] SHARMA R, PANDA NK, KHULLAR M. Hypermethylation of carcinogen metabolism genes, CyP1A1, CYP2A13 and GSTM1 genes in head and neck cancer[J]. Oral Dis, 2010,16(7):668-673.
[7] OHGAMI RS, MA L, REN L, et al. DNA methylation analysis of ALOX12 and GSTM1 in acute myeloid leukaemia identifies prognostically significant groups[J]. Br J Haematol, 2012, 159(2):182-190.
[8] XIAO WH, LIU WW. Hemizygous deletion and hypermethylation of RUNX3 gene in hepatocellular carcinoma[J]. World J Gastroenterol, 2004, 10(3):376-380.

