胎儿先天性心脏病与染色体及22q11微缺失异常的临床研究
闫亚妮,吴青青,姚 苓,王 欣,山 丹,安园园,高凤云
(首都医科大学附属北京妇产医院:1. 超声科;2. 产科,北京 100026)
先天性心脏病(congenital heart disease, CHD)是目前最常见的先天性畸形之一,在足月活产新生儿中发病率为6.5‰~10‰,在流产、早产或死产中的发病率更高,是目前婴幼儿死亡的主要原因[1]。卫生部发布《中国出生缺陷防治报告(2012)》指出,CHD占出生缺陷的首位。2011年,CHD占所有监测发现病例的26.7%。我国每年有约13万的CHD胎儿出生,新发CHD生命周期的总经济负担超过126亿元,CHD的现状成为影响经济发展和人们正常生活的社会问题[2]。CHD的病因通常包括遗传因素(染色体异常、基因突变等)、环境因素(妊娠期疾病、环境污染、风疹病毒及其他感染、用药等)及遗传-环境因素共同作用(多因素遗传)。多数学者认为,除了部分CHD是单基因突变和染色体畸变所致,大多数CHD属于多基因遗传病[3-4]。因此,本文从遗传学和临床学角度对CHD做进一步的研究和总结,有利于对该病的进一步认识、诊断和治疗。本文分析胎儿CHD与染色体及22q11微缺失综合征的关系。
1材料与方法
1.1临床资料选择2011年1月至2012年12月在首都医科大学附属北京妇产医院超声科行常规检查(孕18~28周)的孕妇26 042例,孕妇年龄20~45岁,平均年龄为31.51岁,平均孕周为23.65周。胎儿超声心动图检查胎儿CHD 伴或不伴心外畸形情况。遵循胎儿伦理学原则,在充分告知病情的基础上,根据胎儿父母的意愿,选择是否终止妊娠及(或)行胎儿常规G-显带核型分析、尸检。
1.2超声心动图检查切面采用ISUOG指南要求进行使用GE E8型超声诊断仪,参照“ISUOG胎儿心脏筛查指南”[5]。首先,核对孕周,确定心脏位置,在胎儿腹部横切面,根据胃、腹主动脉、下腔静脉等结构判断心脏的位置是否正常,确定心脏方位。然后,超声心动图常用胎儿四腔心切面、左右室流出道切面、三血管切面、三血管气管切面筛查胎儿CHD。
1.3常规G显带染色体核型分析常规检查发现胎儿心脏结构异常者,行超声心动图筛查提示胎儿为CHD伴或不伴心外畸形的孕妇,根据孕周不同,患者知情同意并签署知情同意书后,在超声引导下分别采用羊水穿刺或脐带血穿刺取样采集标本,行产前细胞遗传学常规G显带核型分析诊断胎儿染色体核型。其中染色体常规核型分析未见异常的31例行FISH检测22q11.2微缺失/微重复,继续妊娠者追踪妊娠结局并在新生儿出生后进一步超声诊断。终止妊娠者行胎儿尸体解剖,所有CHD病例均为确诊病例。
1.4FISH法检测染色体22q11.2微缺失/微重复对染色体核型分析未见异常的64例CHD病例,经知情同意后,31例行FISH法检测染色体22q11.2微缺失/微重复,应用LSI双色荧光探针(Vysis,USA)进行检测,目标基因TUPLE1位于22q11.2区域,用位于22q13的ARSR基因作为对照位点,操作程序按照Vysis公司的说明,依次进行滴片、干燥、变性、杂交、后洗、染色和镜检。在每个染色体核型中两条22号染色体长臂上均见到1绿1红杂交信号,表明无22q11缺失或重复;如果仅1条22号染色体上见1绿1红杂交信号,另1条染色体1绿2红杂交信号,则表明22q11有重复;仅见1个绿色杂交信号则为22qll有缺失。或在间期核中发现2绿2红信号则判别为正常,发现2绿1红或2绿3红则判别为22q11缺失或重复。
1.5统计学分析实验数据采用SPSS 17.0统计软件进行统计学分析,组间比较采用χ2检验分析,以P<0.05为差异具有统计学意义。
2结果
2.1CHD常规G显带染色体核型分析确诊的CHD病例中18例伴有染色体异常,三体征14例,其中18-三体8例,21-三体4例,13-三体2例;性染色体异常3例;三倍体1例,占所有异常的5.56%。18-三体以室间隔缺损、右室双出口,心脏房室间隔缺损及瓣膜病变等为主,且87.5%同时存在心外畸形(图1);21-三体以室间隔缺损、心脏房室间隔缺损、心内膜垫缺损、肺动脉狭窄等为主,且75%同时存在心外畸形; 13-三体以室间隔缺损、单心室、共同动脉干等为主,且100%同时存在心外畸形;性染色体异常以室间隔缺损、房间隔缺损,单心室瓣膜病变为主,且100%同时存在心外畸形;三倍体以左心发育不良等心脏异常为主。结果显示,相同的染色体异常可伴有不同的心脏及心外畸形,且不同染色体异常发生心脏及心外畸形的比率也各不相同(表1)。
2.2FISH法检测CHD22q11.2微缺失/微重复31例常规G显带染色体核型分析未见异常的胎儿,采用FISH法检测22q11.2微缺失/微重复,发现3例胎儿存在染色体22q11.2微缺失,这3例胎儿中2例超声表现为法洛氏四联症;1例表现为室间隔缺损,大动脉共干(表2)。在这3例病例的胎儿间期细胞中,仅一条22号染色体上见1绿(ARSA探针)1红(TUPLEl探针)杂交信号,另一条染色体仅见1个绿色杂交信号,则表明22q11.2有缺失(病例2,如图2、图3)。
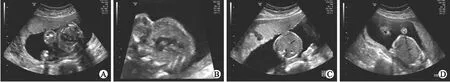
图1 病例1诊断为18-三体综合征的超声图像
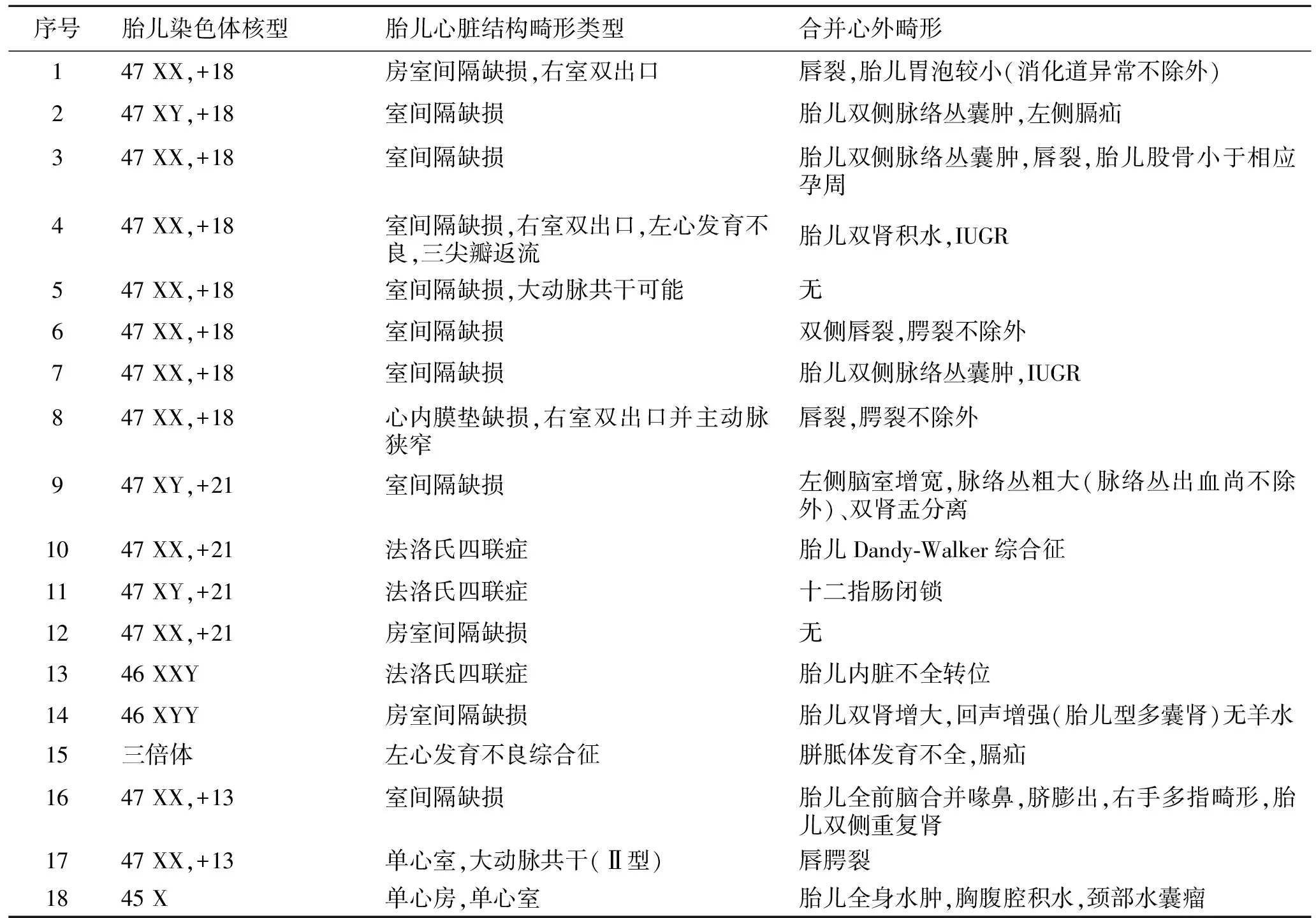
表1 胎儿CHD与染色体异常的病例分析

表2 胎儿CHD与22q11.2微缺失的关系
2.3单纯CHD及CHD合并心外畸形的胎儿染色体异常分析82例病例中,单纯CHD42例,其中常规核型分析染色体异常者2例,发现染色体22q11.2微缺失3例,占 11.9%(5/42);40例CHD合并其他畸形者,有16例染色体异常(占40%),CHD合并心外畸形染色体异常的比例明显高于单纯CHD(两者比较差异有统计学意义)[11.9%(n=5/42)vs. 40%(n=16/40),P<0.05]。
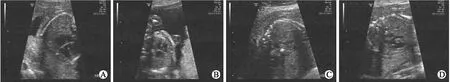
图2 FISH检测存在22q11.2微缺失的超声诊断为法洛氏四联症患者的超声图像
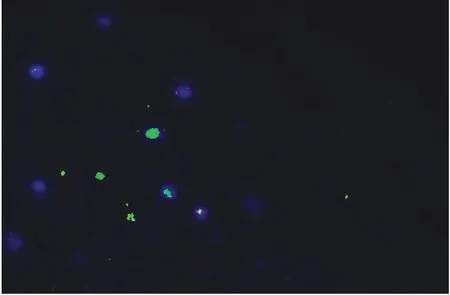
图3 22q11.2微缺失综合征的FISH图像
3讨论
CHD的发病率高,其发病机制目前仍不完全清楚。多数学者认为CHD为多基因遗传病,染色体畸变是导致该病的主要原因之一。染色体数目和结构异常均可导致CHD,即使染色体有极轻度的畸变也可导致多个邻近基因的异常,从而影响心脏及心外器官的发育,导致先天性心脏和心外多个器官畸形[6]。本研究确诊的18例CHD合并染色体异常者,发现有三体征的14例,性染色体异常的3例,有三倍体的1例,所有染色体畸变患者中存在不同类型的先天性心脏或心外畸形。由于不同染色体承载的基因不同,合并心脏和心外畸形的比率也不同[7],可见相同的染色体异常可伴有不同的心脏及心外畸形,且不同染色体异常发生心脏及心外畸形的比率也各不相同。
22q11.2微缺失综合征为人类最常见的基因组异常综合征,新生儿发病率约1/4 000,典型临床表现为CHD、面部畸形、免疫缺陷、腭裂、低钙、学习障碍、行为异常等。CHD中,以法洛氏四联征(25%)、主动脉弓离断(50%)、共同动脉干(10%)、室间隔缺损(17%)、肺动脉闭锁伴室间隔缺损(14%)等发生率较高[8]。近年来研究表明TUPLE1 基因是22q11 微缺失综合征的主要致病基因,此基因的缺失是导致CHD的重要病因之一[9-10]。荧光原位杂交技术既有分子杂交的高度特异性和敏感性,又能在染色体原位显色,因而定位准确,结果稳定,且检测结果直观,所需标本少,已成为当前检测微缺失的金标准[11]。 HARTMAN等[12]通过大样本研究发现在患CHD的婴幼儿中22q11.2 微缺失发生率为12.2%。在我们的研究中,常规G显带染色体核型分析未见异常的胎儿,采用FISH法检测发现3例存在22q11.2微缺失,占9.7%(3/31),其发病率与文献报告相似。FISH 技术检测22q11.2微缺失综合征可作为传统核型分析必要的补充,可提高CHD的检出率,具有一定的诊断价值。
胎儿结构异常往往提示着有较高的染色体异常发病风险,尤其是CHD与染色体异常密切相关。超声检查对胎儿心血管系统的显像直观清晰,胎儿心脏的扫查切面从四腔心切面能够延伸到更多的扩展标准切面,从而提高了阳性检出率。产前系统超声筛查尤其是胎儿超声心动图检查是诊断胎儿CHD的最佳方法[13]。染色体畸变患者由于存在众多基因增加或减少,常伴心脏及心外多发畸形。既往研究发现CHD胎儿的染色体异常发生率约为25%~30%,而当合并有心外畸形时染色体异常发生率可高达40%[14]。本研究中,心脏畸形合并心外畸形的染色体异常的比例为40%,明显高于单纯CHD的比例11.9%,两者比较差异有统计学意义。因为CHD为多基因疾病,相同的染色体异常可表现为不同的心脏及心外畸形,并且不同染色体异常发生心脏和心外畸形概率也各不相同。对于存在心脏畸形合并心外畸形的胎儿,我们应该引起足够的重视,一定要进行染色体检测[15]。
因此,我们认为,在以后的产前诊断工作中,对超声产前筛查出CHD或CHD合并其他心外畸形的胎儿时,应告知并建议孕妇进行侵入性产前检查,行G显带染色体常规核型分析和FISH法22q11.2微缺失/微重复检测以排除染色体异常,减少和避免染色体异常综合征患儿出生,降低围生儿病死率,提升产前诊断质量。
参考文献:
[1] VOTINO C, CANNIE M, SEGERS V, et al. Virtual autopsy by computed tomographic angiography of the fetal heart: a feasibility study[J]. Ultrasound Obstet Gynecol, 2012, 39(6):679-684.
[2] 中华人民共和国卫生部.中国出生缺陷防治报告(2012)[J]. 中国当代医药,2012, 19(28):1.
[3] ZHANG W, LI X, SHEN A, et al. Screening NKX2.5 mutation in a sample of 230 Han Chinese children with congenital heart diseases[J]. Genet Test Mol Biomarkers, 2009, 13(2):159-162.
[4] KUEHL K, LOFFREDO C, LAMMER EJ,et al. Association of congenital cardiovascular malformations with 33 single nucleotide polymorphisms of selected cardiovascular disease-related genes[J]. Birth Defects Res A Clin Mol Teratol,2010, 88(2):101-110.
[5] CARVALHO JS, ALLAN LD, CHAOUI R, et al. ISUOG practice guidelines (updated): sonographic screening examination of the fetal heart[J]. Ultrasound Obstet Gynecol, 2013, 41(3):348-359.
[6] 张磷,张晓红,任梅宏,等.胎儿染色体异常与不同先天性心脏病的关系研究[J].四川大学学报:医学版,2010,41(2):312-315.
[7] GOLDMUNTZ E. DiGeorge syndrome: new insights[J]. Clin Perinatol, 2005, 32(4):963-978.
[8] SCAMBLER PJ, KELLY D, LINDSAY E, et al. Velo-cardio-facial syndrome associated with chromosome 22 deletions encompassing the DiGeorge locus[J]. Lancet, 1992, 339(8802):1138-1139.
[9] 孙晓燕,王云英,瓮占平,等. TUPLE1 基因缺失在先天性心脏病发病机制中作用的研究[J]. 中国优生与遗传杂志, 2013, 21(2) :11-13.
[10] MCCLARREN J, DONNENFELD AE, RAVNAN JB. Prenatal diagnosis of an unexpected interstitial 22q11.2 deletion causing truncus arteriosus and thymic hypoplasia in a ring 22 chromosome derived from a maternally inherited paracentric inversion[J]. Prenat Diagn, 2006, 26(13):1212-1215.
[11] TOMITA-MITCHELL A, MAHNKE DK, LARSON JM, et al. Multiplexed quantitative real-time PCR to detect 22q11.2 deletion in patients with congenital heart disease[J]. Physiol Genomics, 2010, 42A(1): 52-60.
[12] HARTMAN RJ, RASMUSSEN SA, BOTTO LD, et al. The contribution of chromosomal abnormalities to congenital heart defects: A population-based study[J]. Pediatr Cardiol, 2011, 32(8):1147-1157.
[13] FADDA GM, CAPOBIANCO G, BALALA A, et al. Routine second trimester ultrasound screening for prenatal detection of fetal malformations in Sassari university hospital, Italy: 23 years of experience in 42,256 pregnancies[J]. Eur J Obstet Gynecol Reprod Biol, 2009, 144(2):110-114.
[14] MOGEA R, ZIDERE V, ALLAN LD. Prenatally detectable congenital heart defects in fetuses with Down syndrome[J]. Ultrasound Obstet Gynecol, 2011, 38(3):320-324.
[15] 阎萍,张晓航,姚宏,等.胎儿先天性心脏病与染色体异常的临床分析[J]. 第三军医大学学报, 2013;34(2):126-128.

