花青素主要成分与HER-2激酶区的分子对接
罗丽萍,余小平,韩彬,陈祥燕,彭晓莉,陈玮,周杰,李遂焰
1 西南交通大学 生命科学与工程学院,四川 成都 610031 2 成都医学院 公共卫生系,四川 成都 610500
近年来,天然植物化学物质的健康防护作用越来越受到研究者们的重视,但其与细胞相互作用的衔接位点研究较少,特别是化合物成分如何与靶点作用发挥生物学效应不甚明了,该问题一直困扰诸多研究者。此外,天然植物提取物成分复杂,传统试验方法在筛选有效成分方面费时耗力,周期长成本高,利用各种生物信息学方法进行新药研发和靶点预测已经成为热点[1-3]。
MVD采用MolDock的演算法来预测小分子配体和大分子蛋白的相互作用,能够根据配体准确预测大分子蛋白的活性位点,是一款精确半柔性分子对接程序,通过增加限定条件,其对结合模式的识别有较好的准确度[4]。与其他对接软件相比,MVD对活性位点预测的准确率较高 (MVD:87%, Glide: 82%, Surflex: 75%, FlexX: 58%)[5]。
人表皮生长因子受体 HER-2,又称 ErbB-2或Neu,基因位于染色体17q21.1,其过表达可导致多种恶性肿瘤 (如乳腺癌、前列腺癌、卵巢癌、宫颈癌等) 的发生,且患者预后差[6]。花青素属于黄酮类化合物,大量研究表明,花青素能通过阻断 HER-2受体信号传导发挥抗癌作用,是潜在的HER-2靶向治疗联用药物[7-9],但其如何与HER-2受体作用尚不明确。目前已发现27种天然存在的花青素苷元 (Anthocyanidin或Aglycone),其中6种 (结构见图1) 较常见:矢车菊色素 (Cyanidin,Cy)、飞燕草色素(Delphinidin,Dp)、锦葵色素 (Malvidin,Mv)、天竺葵色素 (Pelargonidin,Pg)、芍药色素(Peonidin,Pn) 和牵牛花色素 (Petunidin, Pt);此外,由于花青素苷元性质活泼不稳定,常与葡萄糖、阿拉伯糖、鼠李糖等结合形成花色苷[10]。
本研究利用生物信息学方法对花青素中主要抗癌活性成分与HER-2酪氨酸激酶区进行对接,试图阐明二者相互作用机制,为研究该类化合物发挥抗癌作用的分子机制提供理论基础。
1 材料与方法
1.1 材料
1.1.1 受体晶体结构
以人HER-2同源二聚体激酶结构域的晶体结构 (PDB ID: 3PP0, MMDB ID: 89546)[11]为基础,选择单体A作为计算机分子对接的受体模型,使用Molegro Virtual Docker 5.5 (MVD)软件进行对接研究。
1.1.2 配体三维结构
六种花青素苷元及其对应的单葡糖苷 (-G)及 ATP共 13种化合物的三维结构文件,均从PubChem Compound (http://www.ncbi.nlm.nih.gov/pccompound/) 上下载,CID号分别为:花青素苷元:Cy (128861),Dp (128853),Mv (159287),Pg(440832),Pn (441773),Pt (441774);花青素单葡糖苷:Cy-G (441667),Dp-G (443650),Mv-G(443652),Pg-G (443648),Pn-G (443654),Pt-G(443651);ATP (UNX_0)。
1.1.3 细胞和试剂
人乳腺癌细胞株 MDA-MB-453 (HER-2高表达) 购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。黑米花青素BRA-90 (Black Rice Anthocynins, BRACs) 购自吉林新星天然植物开发有限责任公司。RPMI 1640培养基购自美国Hyclone公司,胎牛血清购自TBD公司。RIPA (强) 裂解液购自碧云天生物科技研究所。兔抗人磷酸化HER-2多克隆抗体、FITC标记山羊抗兔IgG抗体分别购自美国Bioworld和北京中杉金桥生物科技有限公司。
1.2 方法
1.2.1 对接程序
采用 Molecular Virtual Docker 5.5(http://www.molegro.com/mvd-product.php) 软件,以HER-2激酶区 (HER-2 receptor tyrosine kinase domain, HER2TK, 氨基酸序列:706–993)单体A全域进行对接,检测活性位点数设为10,采用标准MVD对接程序进行分子对接。对接范围采用球形,半径 15Å,其他参数默认。将得到的配体构象进行成簇分析(成簇参数为0.5 Å),然后基于对接的分子能量对各种结合模式进行MolDock评分,最后依据成簇情况和最低MolDock Score来选取合理的对接结果。氢键供体-受体间的最大距离为0.30 nm[12]。
1.2.2 细胞培养及Western blotting
MDA-MB-453细胞用RPMI 1640 (含10%胎牛血清) 培养基,在37 ℃、饱和湿度、5% CO2条件下常规传代培养。用RIPA裂解液提取经BRACs(0、25 μg/mL、50 μg/mL、100 μg/mL) 处理后细胞总蛋白。BCA法测定蛋白样品浓度后,与5×上样缓冲液混匀,煮沸5 min,每孔上样100 μg,进行10% SDS-PAGE电泳,半干法转至PVDF膜。5%BSA室温封闭2 h,加1∶500一抗于4 ℃孵育过夜;次日,TBST漂洗10 min,重复漂洗4次后,加入1∶5 000二抗室温孵育2 h,TBST漂洗10 min,重复漂洗4次后,化学发光显色,暗室压片曝光,常规程序显影、定影,晾干底片后扫描条带图像,以 Quantity One 软件进行条带光密度值分析。
1.2.3 数据处理
结果以±s表示,采用GraphPad Prism 5.0统计软件分析,组间比较使用单因素方差分析。
2 结果
2.1 花青素苷元与HER-2激酶区的分子对接
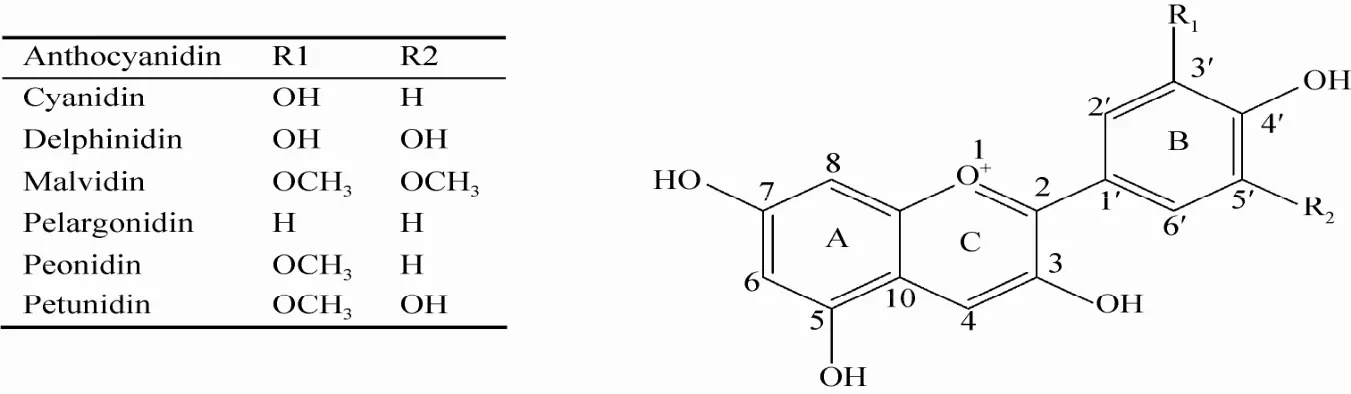
图1 花青素苷元基本化学结构[13]Fig. 1 Chemical structures of anthocyanidins[13].
花青素的基本结构单元是 3,5,7-三羟基-2-苯基苯并吡喃型阳离子 (图 1),能选择性作用于 HER-2受体激酶区 (图 2)。对接发现,6种花青素苷元都能结合在HER2TK区同一活性腔中,且MolDock Score都低于–100 kJ/mol,相互作用值 (Interaction) 低于–125 kJ/mol,表明对接结果良好,可用于后续研究 (表1)。
以Cy与HER2TK对接结果为例,图3展示了最适构象结合位点的微环境,Cy分子处于Val734、Ala751、Leu755、Ile767、Ala771、Met774、Leu785、Leu796、Leu852、Phe864等疏水氨基酸形成的疏水腔中,可产生较强的输水作用;另一方面,Ile767、Glu770、Ser783、Thr798、Thr862等氨基酸与 Cy之间还有氢键作用;带正电的Lys753还能与带微弱负电荷的酚羟基相互作用。综合分析,花青素苷元与HER2TK结合的主要驱动力是疏水作用力和氢键,静电作用力较弱。
2.2 花青素单葡糖苷与 HER-2激酶区的分子对接
图 4显示,6种花青素单葡糖苷均结合在HER2TK的同一活性腔中,且与苷元结合的活性腔相同。此外,MolDock Score都低于–130 kJ/mol,相互作用值低于–150 kJ/mol,表明对接结果良好 (表 2)。

图2 花青素苷元与HER2TK对接最适构象Fig. 2 Optimum conformations of HER2TK docking with anthocyanidins.
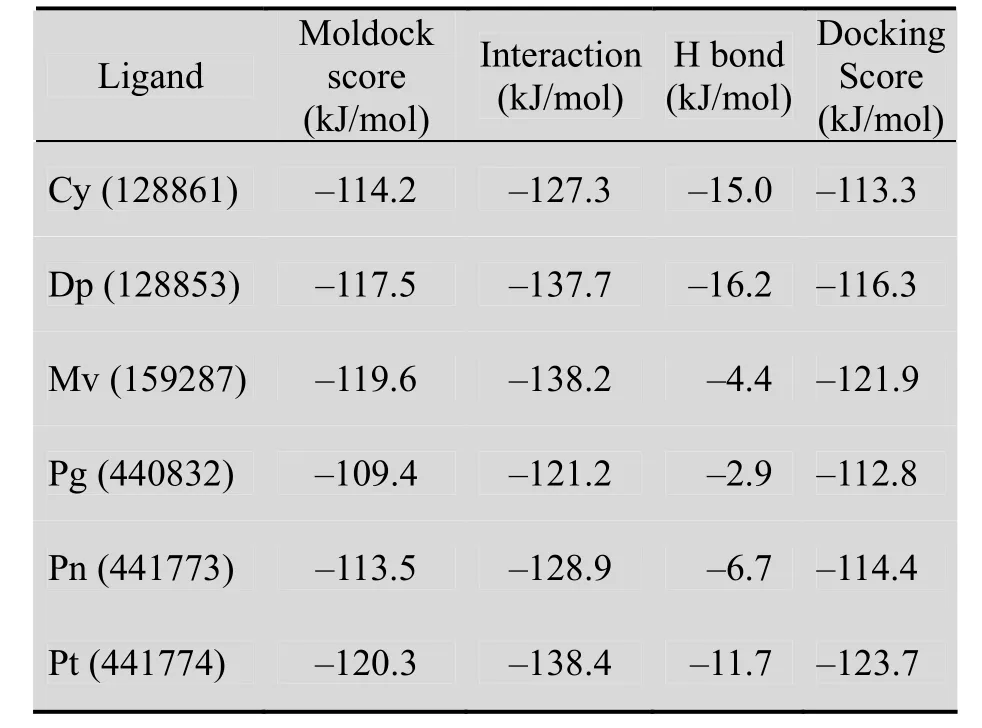
表1 花青素苷元与HER2TK对接最适构象参数Table 1 Optimum parameters of HER2TK docking with anthocyanidins
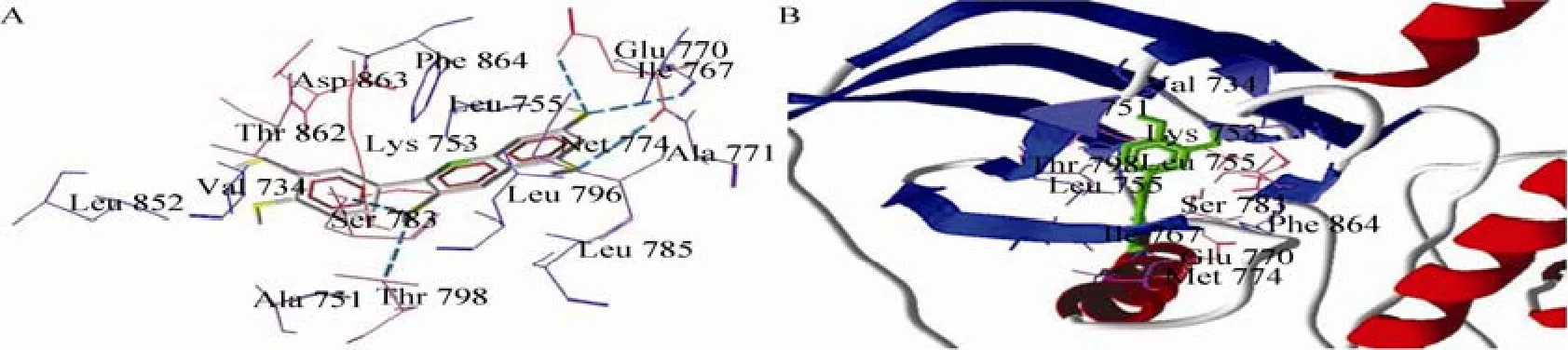
图3 Cy与HER2TK对接最适构象微环境Fig. 3 Microenvironment around binding site of Cy and HER2TK.
Supported by:National Natural Science Foundation of China (No. 81273047), Research Fund of Chengdu Medical School (No.CYZ12-015), Discipline Construction Project of Chengdu Medical College (No. CYXK2012010).
Corresponding author:Suiyan Li. Tel: +86-28-87600185; E-mail: suiyanli_@163.com
国家自然科学基金 (No. 81273074),成都医学院科研基金 (No. CYZ12-015),成都医学院学科建设项目 (No. CYXK2012010) 资助。
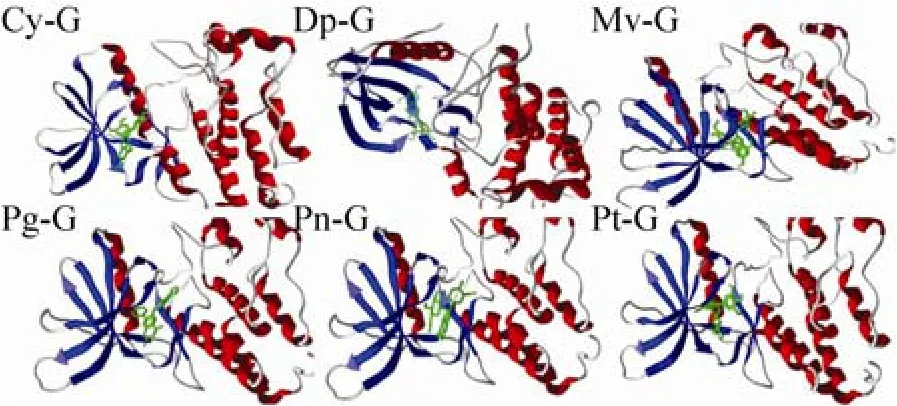
图4 花青素单葡糖苷与HER2TK对接最适构象Fig. 4 Optimum conformations of HER2TK docking with anthocyanidins-glc.
以Cy-G与HER2TK对接结果为例,图5展示了最适构象结合位点的微环境,Cy-G分子处于 Leu726、Gly727、Gly729、Val734、Ala751、Ile752、Leu796、Leu800、Met801、Pro802、Gly804、Cys805、Leu852等疏水氨基酸形成的疏水腔中,疏水作用较强;另一方面,Leu726、Ser728、Ala751、Lys753、Leu796、Thr798、Cys805、Arg849、Asn850、Thr862、Asp863等氨基酸与Cy-G之间还能产生很强的氢键作用;带正电的 Lys753、Arg849还能与带微弱负电荷的酚羟基相互作用。综合分析,花青素单葡糖苷与 HER2TK的主要驱动力是疏水作用力和氢键,静电作用力较弱。
2.3 花青素对HER2TK的竞争性抑制机制
为进一步分析花青素对 HER2TK的抑制机制,我们将HER2TK的底物,即ATP也进行了对接,其MolDock Score为-161 kJ/mol,低于花青素苷元和单葡糖苷。
图 6和图 7分别为 Cy/HER2TK和Cy-G/HER2TK与 ATP/HER2TK结合位点的比较,比较发现,三者均在同一活性腔中且存在明显竞争性。进一步分析发现,能与 ATP形成氢键的氨基酸有 Ser783、Thr798、Met801、Arg849、Asn850、Thr862、Asp863,结合 2.1和 2.2的对接结果可知,Cy可能干扰ATP与Ser783、Thr798、Thr862间氢键的形成;而Cy-G可能阻碍ATP与Arg849、Asn850、Asp863间氢键的形成。
2.4 黑米花青素对HER-2磷酸化水平的影响
为验证花青素能否竞争性抑制 HER-2的磷酸化,我们用不同浓度BRACs对HER-2高表达乳腺癌细胞株进行处理。Western blotting结果显示,BRACs能显著抑制 HER-2的磷酸化(P<0.05),且有剂量依赖性 (图8)。
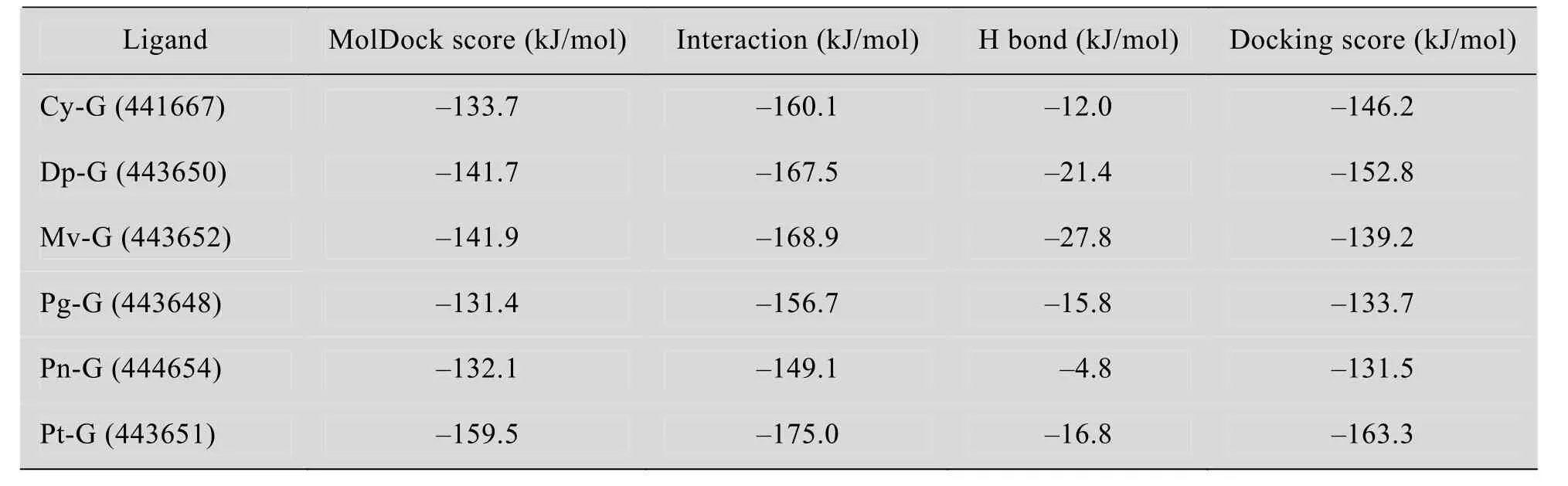
表2 花青素单葡糖苷与HER2TK对接最适构象参数Table 2 Optimum parameters of HER2TK docking with anthocyanidins-glc
Received:June 28, 2013; Accepted: October 29, 2013
Supported by:National Natural Science Foundation of China (No. 81273047), Research Fund of Chengdu Medical School (No.CYZ12-015), Discipline Construction Project of Chengdu Medical College (No. CYXK2012010).
Corresponding author:Suiyan Li. Tel: +86-28-87600185; E-mail: suiyanli_@163.com
国家自然科学基金 (No. 81273074),成都医学院科研基金 (No. CYZ12-015),成都医学院学科建设项目 (No. CYXK2012010) 资助。
网络出版时间:2013-11-05 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20131105.1011.001.html
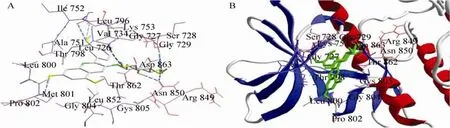
图5 Cy-G与HER2TK对接最适构象微环境Fig. 5 Microenvironment around binding site of Cy-G and HER2TK.
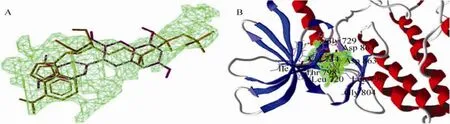
图6 ATP和Cy与HER2TK对接最适构象比较Fig. 6 Comparison of interaction between HER2TK and Cy against ATP. Purple: Cy; Brown: ATP.
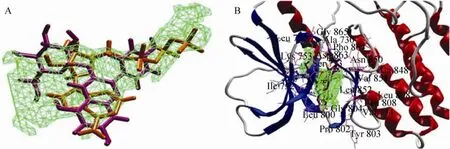
图7 ATP和Cy-G与HER2TK对接最适构象比较Fig. 7 Comparison of interaction between HER2TK and Cy-G against ATP. Purple: Cy-G; Brown: ATP.

图8 Western blotting (A)和光密度分析法(B)检测BRACs处理后HER-2磷酸化水平变化Fig. 8 HER-2 phosphorylation level variation after BRACs treatment by Western blotting technology (A)and optical density analysis (B). N=3; *: P <0.05, ***:P <0.001.
3 讨论
分子对接方法在药物研究领域发挥了重要作用,为先导化合物的发现和优化提供了有效的工具:研究小分子探针与细胞内生物大分子的结合机制,确认小分子在生物体内的作用靶点,指导和解释实验现象,为新药开发寻找新的突破口;以结构生物学为基础,进行药物与靶标蛋白相互作用的动力学模拟研究,充分利用现有天然植物化学物质中有效成分,经修饰和优化,设计具有更高活性的先导化合物,较好的软件成功率高达 70%–80%[14-16]。Chalopin等[17]用分子对接方法发现Dp能直接与ERα的激活位点作用,促进血管扩张,证明红酒多酚尤其是Dp对心血管疾病有防护效应。与袁江兰等[18]利用AUTODOCK 3.05分子对接软件探究了染料木黄酮与EGFR-TK (EGFR酪氨酸激酶区) 的结合作用,发现染料木黄酮能通过干扰TK催化活性结构中 Lys721/Glu738离子对的形成而抑制了EGFR-TK的活性,且属于非竞争性结合。
HER-2是分子量约138 kDa的受体膜蛋白,其过度表达能引起HER-2同源二聚体的形成,引发不受配体激活的自发磷酸化,导致下游促癌信号通路持续性激活;还能通过 INTERNET(Integral trafficking from the ER to the nuclear envelope transport, 从内质网到核膜的整合转运)途径转运入核,参与COX-2、rRNA等基因转录的调控,使细胞周期紊乱,转移增加,并引发药物耐受[19-20]。HER-2含一个胞外EGF相关的配体结合区,一个跨膜螺旋区,一个胞内区,包括酪氨酸激酶区和 C-端调控区,本研究选择HER-2的激酶区作为对接受体,因该区域含ATP结合位点,为激活下游信号通路所必需。
作为天然植物多酚化合物,花青素具有较强的健康促进作用而倍受肿瘤学家和营养学家的关注。已有研究表明,花青素是酪氨酸激酶 (Protein tyrosine kinase, PTK) 的抑制剂[13],能通过抑制HER-2的激酶活性发挥抗癌效应,且具有无毒、不致畸、不致癌、不致敏、不致突变等特性[21],但因其作用位点不明确阻碍了研发。在植物体内,花青素很少以游离状态 (苷元) 存在,在花色苷合成酶催化合成的极短时间内,易在C环3-位被类黄酮3-O-糖基转移酶糖基化,与单糖或多糖结合形成稳定的花青素,再转运至酸性液泡中发挥作用[22],其在人体内的吸收亦受糖苷配基的性质和结构的影响[23]。因此,本研究选择花青素苷元和对应单葡糖苷进行对接研究。
Received:June 28, 2013; Accepted: October 29, 2013
Supported by:National Natural Science Foundation of China (No. 81273047), Research Fund of Chengdu Medical School (No.CYZ12-015), Discipline Construction Project of Chengdu Medical College (No. CYXK2012010).
Corresponding author:Suiyan Li. Tel: +86-28-87600185; E-mail: suiyanli_@163.com
国家自然科学基金 (No. 81273074),成都医学院科研基金 (No. CYZ12-015),成都医学院学科建设项目 (No. CYXK2012010) 资助。
网络出版时间:2013-11-05 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20131105.1011.001.html
对接结果表明,6种花青素苷元及其单葡糖苷均能在同一活性腔与 HER2TK结合,但后者的结合能更低,可能是糖基增加了氢键作用力。提示花青素与 HER2TK的结合位点主要取决于母核结构,糖的结合可增加花青素与 HER-2激酶区结合的稳定性。但花青素结合糖基的种类和数目对 HER-2激酶活性的抑制作用是否有规律还有待探究。
由分子对接结果,我们推测:花青素能竞争性与ATP结合于HER2TK同一活性腔,并干扰氢键的形成,且单葡糖苷的竞争结合能力强于苷元。由于ATP结合的稳定性高于花青素,因而解释了花青素发挥抗癌效应时对正常细胞具有保护效应[4-5,24-25]。值得注意的是,目前研究主要集中在丰度较高的Cy-G和Dp-G[4,16],但本研究发现,Pt-G的结合能低于 ATP,具备很高的作为ATP小分子抑制剂开发的价值。
前有研究证实花青素主要抗癌活性成分Cy-G和Dp处理高表达HER-2乳腺癌细胞株后,均能抑制HER-2的磷酸化水平,但并不影响总HER-2含量[7,26]。本研究进一步证实,黑米花青素能以剂量依赖方式抑制HER-2的磷酸化。该结果与推测结果一致:花青素能竞争性抑制HER-2和ATP结合,从而抑制HER-2的磷酸化激活,但并不影响总HER-2的表达水平。
综上所述,该研究表明花青素中12种主要抗癌活性成分均能与 HER-2酪氨酸激酶区对接,且对ATP与HER-2的结合存在竞争性。该对接位点的信息对分析该类化合物抑制 HER-2酪氨酸激酶活性的分子机制提供了依据,有助于花青素等天然植物化学物质用于肿瘤治疗及相关药物的研发。
[1]Meng XY, Zhang HX, Mezei M, et al. Molecular docking: a powerful approach for structure-based drug discovery. Curr Comput Aided Drug Des,2011, 7(2): 146–157.
[2]Hu YB, Peng JB, Gu S, et al. Molecular docking in Xin-Ke-Shu preparation’s multi-target effect on coronary heart disease. Acta Phys-Chim Sin, 2012,28(5): 1257–1264 (in Chinese).
胡衍保, 彭静波, 顾硕, 等. 复方心可舒治疗冠心病多靶点作用的分子对接. 物理化学学报,2012, 28(5): 1257–1264.
[3]Xu ZG, Xu X, Yuan CN. Molecular docking on taxotere binding to αβ-tubulin. Acta Phys Chim Sin, 2008, 24(10): 1839–1844 (in Chinese).
徐志广, 许旋, 袁传能. 紫杉醚与 αβ微管蛋白的分子对接. 物理化学学报, 2008, 24(10):1839–1844.
[4]De Azevedo WF. MolDock applied to structure-based virtual screening. Curr Drug Targets, 2010, 11(3): 327–334.
[5]Thomsen R, Christensen MH. MolDock: a new technique for high-accuracy molecular docking. J Med Chem, 2006, 49(11): 3315–3321.
[6]Nahta R, Shabaya S, Ozbay T. Personalizing HER2-targeted therapy in metastatic breast cancer beyond HER2 status: what we have learned from clinical specimens. Curr Pharmac Person Med,2009, 7(4): 263–274.
[7]Tuba O, Rita N. Delphinidin inhibits HER2 and Erk1/2 signaling and suppresses growth of HER2-overexpressing and triple negative breast cancer cell lines. Breast Cancer: Basic Clin Res, 2011, 5:143–154.
[8]Chang H, Mi MT, Ling WH. Effects of anthocyanin-rich extract from black rice alone or combined with chemo-therapeutic agents on proliferation of different cancer cells. Acta Acad Med Milit Tert, 2007, 29(20): 1943–1946 (in Chinese).
常徽, 糜漫天, 凌文华. 黑米花色苷及联合化疗药物对不同肿瘤细胞增殖的影响. 第三军医大学学报, 2007, 29(20): 1943–1946.
[9]Fridrich D, Teller N, Esselen M. Comparison of delphinidin, quercetin and (–)-epigallocatechin-3-gallate as inhibitors of the EGFR and the ErbB2 receptor phosphorylation. Mol Nutr Food Res 2008, 52: 815–822.
[10]Wang LS, Carmella S, Keyes R, et al.Anthocyanins and cancer prevention//Sarkar FH Ed. Nutraceuticals and Cancer. Springer Science Business Media BV, 2012.
[11]Aertgeerts K, Skene R, Yano J, et al. Structural analysis of the mechanism of inhibition and allosteric activation of the kinase domain of HER2 protein. J Biol Chem, 2011, 286(21): 18756–18765.
[12]Shaikh F, Sanehi P, Rawal R. Molecular screening of compounds to the predicted protein-protein interaction site of Rb1-E7 with p53-E6 in HPV.Bioinformation, 2012, 8(13): 607–612.
[13]Tsuda T. Dietary anthocyanin-rich plants: biochemical basis and recent progress in health benefits studies.Mol Nutr Food Res, 2012, 56: 159–170.
[14]Duan AX, Chen J, Liu HD, et al. Applications and developments of molecular docking method.J Analytical Sci, 2009, 25(4): 473–477 (in Chinese).
段爱霞, 陈晶, 刘宏德, 等. 分子对接方法的应用与发展. 分析科学学报,2009, 25(4): 473–477.
[15]Zhu ZY, Zhang Y, Li Z, et al. Progress in receptor protein and drug molecule docking approaches.Chin J Clin Pharmacol Ther, 2009, 14(11):1308–1313 (in Chinese).
朱志远, 张燕, 李征, 等. 受体蛋白与药物分子对接的研究进展. 中国临床药理学与治疗学,2009, 14(11): 1308–1313.
[16]Chauhan P, Shakya M. Model based design of inhibitors for c-jun. Bioinformation, 2009, 4(6):223–228.
[17]Chalopin M, Tesse A, Martínez MC, et al.Estrogen receptor alpha as a key target of red wine polyphenols action on the endothelium. PLoS ONE, 2010, 5(1): e8554.
[18]Yuan JL, Liu H, Kang X, et al. Molecular docking of epidermal growth factor receptor tyramine kinase domain and its inhibitor genistein. Chin J Biotech, 2008, 24(10): 1813–1817 (in Chinese).
袁江兰, 刘晖, 康旭, 等. 表皮生长因子受体酪氨酸激酶结构域与其抑制剂染料木素的模拟对接. 生物工程学报, Chin J Biotech, 2008, 24(10):1813–1817.
[19]Wang YN, Hung MC. Nuclear functions and subcellular trafficking mechanisms of the epidermal growth factor receptor family. Cell Biosci, 2012, 2: 13.
[20]Lo HW. Nuclear mode of the EGFR signaling network: biology, prognostic value, and therapeutic implications. Discov Med, 2010, 10(50): 44–51.
[21]Teller N, Thiele W, Boettler U, et al. Delphinidin inhibits a broad spectrum of receptor tyrosine kinases of the ErbB and VEGFR family. Mol Nutr Food Res, 2009, 53: 1075–1083.
[22] Zhao QM, Li P, Li F. Research advances on core enzymes of anthocyanidin biosynthesis.Biotechnol Bull, 2012, 12: 25–32 (in Chinese).
赵启明, 李萍, 李范. 花青素生物合成关键酶的研究进展. 生物技术通报,2012, 12: 25–32.
[23]Janet AN, Beverly AC, Anne CK. Anthocyanin kinetics are dependent on anthocyanin structure.Brit J Nutr, 2012, 107: 504–509.
[24]Ana F, Diogo P, Diana T, et al. Blueberry anthocyanins and pyruvic acid adducts: anticancer properties in breast cancer cell lines. Phytother Res, 2010, 24: 1862–1869.
[25]Chang H, Yu B, Yu XP, et al. Anticancer activities of an anthocyanin-rich extract from black rice against breast cancer cellsin vitroandin vivo.Nutrit Cancer, 2010, 62(8): 1128–1136.
[26]Xu M, Bower KA, Wang SY, et al.Cyanidin-3-Glucoside inhibits ethanol-induced invasion of breast cancer cells overexpressing ErbB2. Mol Cancer, 2010, 9: 285.

