重组白介素-2增强口蹄疫病毒多表位疫苗免疫效果研究
苏春霞,段相国,陈溥言
(1.宁夏医科大学基础医学院病原生物学与免疫学系,宁夏银川 750004;2.宁夏医科大学检验学院临床免疫学检验系,宁夏银川 750004;3.南京农业大学农业部动物疫病诊断与免疫重点开放实验室,江苏南京 210095)
口蹄疫(Foot-and-mouth disease,FMD)是由口蹄疫病毒(FMDV)引起的反刍动物的一种高度传染性疾病,FMD在国际上被称为“政治经济病”,主要是因为其传播速度快,防控难度较大,而造成的经济损失巨大。目前,疫苗接种仍然是发展中国家控制FMD的一项重大策略[1-2],但传统的FMD疫苗存在不能区分疫苗接种与自然感染以及潜在的生物安全隐患等问题,因此,FMD新型疫苗如亚单位疫苗、合成肽疫苗、DNA疫苗和重组病毒疫苗等被广泛研究[3-4]。以往的研究表明,合成肽疫苗或重组蛋白疫苗能诱导中和抗体的产生并能有效保护病毒对实验动物的攻击[5-6],但这些疫苗的免疫原性不如传统灭活疫苗。因此,研究者试图通过增加抗原表位的数量或加入T辅助细胞表位等方法增强新型疫苗的免疫原性[7-8]。我们前期构建了串联表达FMDV多表位基因,同时引入通用型辅助性T淋巴细胞表位(PARDE)[9-10],但其诱导小鼠抗体水平和细胞免疫应答略低于灭活疫苗。很多研究者试图利用细胞因子佐剂与FMD疫苗联合免疫动物,以增强后者的免疫原性。本研究通过联合免疫表达猪IL-2的重组腺病毒(rAd5poIL-2)和串联表达FMDV多表位的重组腺病毒(rAd5EGS),观察IL-2对FMDV多表位疫苗诱导小鼠免疫功能的影响,为IL-2作为FMDV表位疫苗的候选佐剂提供实验数据。
1 材料与方法
1.1 材料
表达猪IL-2的重组腺病毒(rAd5poIL-2)、表达FMDV多表位重组腺病毒(rAd5EGS)、重组FMDV VP1蛋白由宁夏医科大学病原生物学与免疫学系实验室保存;O型FMD灭活疫苗为中牧股份兰州生物药厂产品;HRP标记的山羊抗小鼠抗体为Caltag Laboratories公司产品;细胞因子IL-4和IFN-γ检测试剂盒为Raybiotech公司产品;其他试剂均为国产或进口分析纯试剂。
1.2 方法
1.2.1 动物的分组与免疫接种 6周龄雌性Balb/c小鼠分为4组,每组12只,第1组联合免疫rAd5poIL-2和rAd5EGS,第2、3和4组分别注射rAd5EGS、灭活疫苗和PBS,免疫剂量均为1×108TCID50/只,灭 活 疫 苗 和 PBS 组 分 别 注 射200μL,间隔2周免疫接种1次,共免疫接种3次。
1.2.2 脾淋巴细胞增殖试验 首次免疫接种后6周,参考文献[7]采用MTT法检测淋巴细胞增殖功能,简述如下:无菌制备小鼠单个脾细胞悬液,接种到96孔板中,同时加入终浓度为10μg/mL的重组VP1蛋白,37℃培养44h,加入MTT溶液,继续培养4h后弃上清,每孔加100μL DMSO,在微量振荡器振荡,用酶标仪测570nm吸光度值。
1.2.3 抗体和抗体亚型检测 分别于免疫接种后1周~6周尾静脉采血,分离血清,常规ELISA检测小鼠血清中抗VP1特异性IgG水平;首免后6周,ELISA检测血清中IgG1和IgG2a抗体亚型水平[7]。
1.2.4 血清中IL-4和IFN-γ的测定 首次免疫接种后6周,定量ELISA检测小鼠血清中IL-4和IFN-γ的表达水平,操作按Raybiotech公司试剂盒说明书进行。
1.2.5 统计学分析 采用Graphpad Prism5软件,数据表示为D,方差分析或t检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠特异性淋巴细胞增殖水平
首次免疫接种后6周,rAd5EGS能诱导小鼠淋巴细胞增殖,但其诱导淋巴细胞增殖能力略低于灭活疫苗;rAd5poIL-2和rAd5EGS联合免疫后,诱导小鼠淋巴细胞增殖水平显著高于单独免疫rAd5EGS组(P<0.01),而且联合免疫组诱导小鼠淋巴细胞增殖能力也明显高于灭活疫苗组(P<0.05);采用 Graphpad Prism5中的t检验分析,结果见图1。
2.2 特异性抗体和抗体亚型的检测
ELISA结果显示,rAd5EGS能刺激抗FMDV VP1特异性IgG的分泌,但其分泌水平低于灭活疫苗;rAd5poIL-2和rAd5EGS联合免疫后能明显提高小鼠血清中抗VP1特异性IgG的分泌水平,与单独免疫rAd5EGS组相比,差异极显著(P<0.01),而且联合免疫组诱导小鼠抗体分泌水平略高于灭活疫苗组,采用Graphpad Prism5中的方差分析,结果见图2。IgG抗体亚型检测结果表明,免疫接种后6周,rAd5EGS能刺激小鼠抗VP1特异性IgG1和IgG2a的分泌,与灭活疫苗相比,其诱导小鼠IgG2a的分泌水平略高;与单独免疫rAd5EGS相比,联合免疫rAd5poIL-2与rAd5EGS后,能明显提高血清中IgG1和IgG2a的分泌(P<0.05),采用Graphpad Prism5中的方差分析,结果见图3。

图1 小鼠淋巴细胞增殖试验Fig.1 Mouse lymphocyte proliferation test

图2 抗FMDV VP1特异性抗体IgG检测Fig.2 Detection of anti-FMDV VP1specific IgG
2.3 小鼠血清中IL-4和IFN-γ的测定
首免后6周,rAd5EGS能诱导IL-4和IFN-γ的产生,但诱导IL-4的分泌水平低于灭活疫苗,rAd5poIL-2与rAd5EGS联合免疫小鼠后能明显增强rAd5EGS诱导IL-4和IFN-γ分泌的能力,差异极显著(P<0.01);联合免疫组诱导小鼠IL-4和IFN-γ分泌的能力也高于灭活疫苗组;采用Graphpad Prism5中的方差分析,结果见图4。
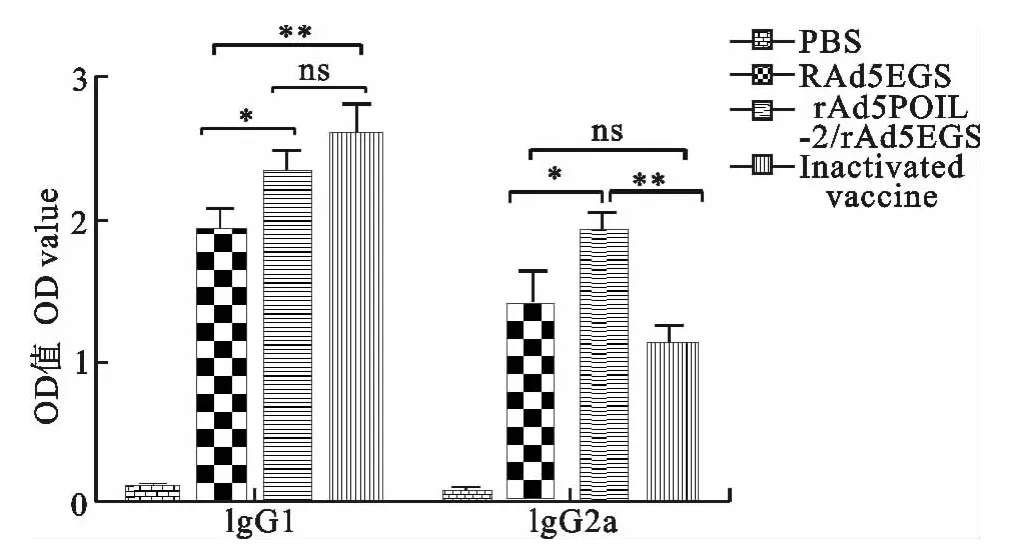
图3 抗VP1特异性抗体IgG亚型检测Fig.3 Detection of specific VP1IgG subtypes

图4 小鼠血清中IL-4和IFN-γ的水平Fig.4 Expression level of IL-4and IFN-γin mouse serum
3 讨论
近年来,FMD新型疫苗的研究发展很快,但就表位疫苗或重组蛋白疫苗而言,其免疫效果依然不如传统的灭活疫苗,因此,研究者试图通过增加抗原表位或引入合适的辅助性T细胞表位以增强疫苗的免疫原性。我们前期通过Linker将O型FMDV的5个B细胞表位和2个T细胞表位基因串联,同时引入PARDE,构建重组腺病毒(rAd5EGS),小鼠免疫试验显示rAd5EGS能诱导特异性抗体分泌与细胞免疫应答,但其免疫原性略低于灭活疫苗[9-10]。在FMD疫苗设计策略中,细胞因子如干扰素,IL-2、IL-6、IL-15等常常被用于增强疫苗免疫效果[11-12],其中IL-2是促进T细胞生长的主要细胞因子,能促进各种免疫效应细胞的分化,包括T、B淋巴细胞,因此,在疫苗研究中,IL-2的应用最为广泛[13-14]。
机体抵抗FMDV感染过程中主要依赖于中和抗体发挥的体液免疫应答,但细胞免疫应答对清除病毒也是必不可少的。我们前期研究结果显示,rAd5EGS免疫小鼠后诱导细胞免疫应答能力高于重组VP1疫苗,可见增加表位数量能明显增强细胞免疫应答,但是rAd5EGS诱导小鼠特异性抗体产生的能力仍低于灭活疫苗[11]。本研究结果显示,联合免疫rAd5poIL-2和rAd5EGS后不但能提高疫苗诱导的抗体分泌水平,而且可以增强疫苗诱导的淋巴细胞增殖能力,且免疫效果强于灭活疫苗。
在小鼠体内,Th1型细胞会介导B细胞产生IgG2a型抗体,Th2型细胞则会介导B细胞产生IgG1型抗体。本研究中,rAd5EGS免疫小鼠后既能诱导IgG1的分泌,又能诱导IgG2a的分泌,与灭活疫苗相比,有促进IgG2a分泌的优势,即促进Th1免疫应答;而联合免疫rAd5poIL-2和rAd5EGS后能同时提高IgG1和IgG2a的分泌水平,与灭活疫苗组相比,联合免疫组能明显增强IgG2a的分泌水平,诱导IgG1的分泌水平略低于灭活疫苗组,但差异不显著(P>0.05)。
IFN-γ、IL-4分别是Th1和Th2细胞的特征性细胞因子。IL-4在体液免疫应答中发挥重要作用;IFN-γ在抗病毒感染方面起着非常重要的作用,IFN-γ水平是衡量FMD疫苗能否预防亚临床感染的重要指标。本研究中,rAd5EGS免疫小鼠后既能诱导IFN-γ的分泌又能诱导IL-4的分泌,但其诱导IL-4的能力低于灭活疫苗,而联合免疫组能同时提高IFN-γ和IL-4的分泌水平,且诱导细胞因子分泌的能力高于灭活疫苗。
在小鼠体内,Th1细胞亚群主要介导细胞免疫应答,Th2细胞亚群介导体液免疫应答,本研究结果显示rAd5EGS免疫小鼠后能明显提高Th1免疫应答,即促进细胞免疫应答。联合免疫rAd5poIL-2和rAd5EGS后能同时增强Th1和Th2免疫应答,有效地调节了Th1和Th2的平衡,既促进了细胞免疫应答,又促进了体液免疫应答,为重组IL-2作为FMD重组疫苗佐剂的临床研究奠定了基础。
[1]施程洪,朱明旺,王继华,等.口蹄疫灭活疫苗免疫增强剂的可行性应用分析[J].中国预防兽医学报,2014(1):58-62.
[2]Jamal S M,Belsham G J.Foot-and-mouth disease:past,present and future[J].Vet Res,2013:44:116.
[3]Park J H.Requirements for improved vaccines against footand-mouth disease epidemics[J].Clin Exp Vac Res,2013,2(1):8-18.
[4]李婷婷,王君伟.口蹄疫合成肽疫苗研究进展[J].动物医学进展,2012,33(4):76-79.
[5]Su C X,Duan X G,Liang L J,et al.Lycium barbarum polysaccharides as an adjuvant for recombinant vaccine through enhancement of humoral immunity by activating Tfh cells[J].Vet Immunol Immunopathol,2014,158(1-2):98-104.
[6]Cao Y,Lu Z,Li D,et al.Evaluation of cross-protection against three topotypes of serotype O foot-and-mouth disease virus in pigs vaccinated with multi-epitope protein vaccine incorporated with poly(I:C)[J].Vet Microbiol,2014,168(2-4):294-301.
[7]Su C,Duan X,Wang X,et al.Heterologous expression of FMDV immunodominant epitopes and HSP70inP.pastorisand the subsequent immune response in mice[J].Vet Microbiol,2007,124:256-263.
[8]Shao J J,Wang J F,Chang H Y,et al.Immune potential of a novel multiple-epitope vaccine to FMDV type Asia 1in guinea pigs and sheep[J].Virol Sinica,2011,26(3):190-197.
[9]王 锋,段相国,赵 瑞,等.串联表达FMDV多表位基因重组腺病毒免疫小鼠的效应研究[J].宁夏医科大学学报,2012,34(10):989-992.
[10]苏春霞,段相国,张艳丽,等.表达口蹄疫病毒多表位基因重组腺病毒的构建[J].宁夏医学杂志,2009,31(12):1111-1112.
[11]Kim S M,Kim S K,Park J H,et al.A recombinant adenovirus bicistronically expressing porcine interferon-αand interferon-γenhances antiviral effects against foot-and-mouth disease virus[J].Antiviral Res,2014,104:52-58.
[12]Su C,Duan X,Zheng J,et al.IFN-αas an adjuvant for adenovirus-vectored FMDV subunit vaccine through improving the generation of T follicular helper cells[J].PLoS One,2013,8(6):e66134.
[13]苏春霞,段相国,郑 洁,等.共表达FMDV VP1-2A基因与猪IL-2重组腺病毒的构建及其免疫原性研究[J].动物医学进展,2014,35(2):1-5.
[14]苏春霞,段相国,曹瑞兵,等.重组猪IL-2对口蹄疫重组腺病毒免疫增强效果的研究[J].免疫学杂志,2014,30(2):110-113.

