一株裂解奶牛源致病性大肠埃希菌噬菌体的分离与鉴定
杨亚东,王礼伟,屈勇刚,李 飞,杨一鸣,杨 蓓
(石河子大学动物科技学院,新疆石河子 832000)
奶牛乳房炎是奶牛的常见多发病,直接给我国的奶产业带来了严重的经济损失[1]。目前在临床防治中大多采用抗菌药物来治疗,普遍存在耐药性和用药成本增加等问题。同时,由于长期使用抗生素,使畜产品存在严重药物残留,导致产品品质下降,很难满足人们对绿色健康养殖的要求。噬菌体是感染细菌、真菌、放线菌或螺旋体等微生物的生物病毒的总称。自1917年人们发现噬菌体以来,如何利用噬菌体预防和治疗细菌性疾病引起了人们的关注[2]。早在20世纪初噬菌体治疗就已经取得过可喜的成果,国外第一次公开报道的噬菌体治疗是在1921年,Richard B等利用噬菌体制剂治疗葡萄球菌皮肤感染,24h~48h之内,感染消退[3]。现今,噬菌体的应用越来越广泛[4]。利用噬菌体治疗细菌感染具有一些抗菌药物无法比拟的优势,如噬菌体超强的繁殖能力、裂解细菌的特异性、无耐药性、无残留等。本研究从牛粪便中分离到1株裂解致奶牛乳房炎大肠埃希菌的噬菌体,对其生物学特性进行分析,为开展奶牛乳房炎噬菌体治疗研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和粪便 21株奶牛源致病性大肠埃希菌(Eco1~Eco21)由石河子大学兽医传染病实验室分离鉴定所得,用甘油在-40℃保存。26份牛粪便采自石河子周边奶牛场。
1.1.2 主要试剂 LB培养液配方按文献[5]配制;普通营养琼脂购于北京奥博星生物技术有限责任公司。
1.2 方法
1.2.1 宿主菌的准备 将21株牛源致病性大肠埃希菌分别接种到装有3mL LB液体培养基的试管中,于37℃条件下,180r/min摇床培养6h,置4℃冰箱保存。
1.2.2 噬菌体的富集与分离 参照文献[6]将牛粪便样品放入1 000mL自来水中充分混匀,自然沉降10min后,取上清液用16层纱布粗过滤,所得滤液4℃冰箱过夜,后将上清以10 000r/min离心10 min。取上清液,放置4℃冰箱过夜。将所得上清液20mL,以及21株菌悬液各3mL,分别加入100mL LB液体培养基中,37℃摇床培养24h,10 000r/min离心10min,取上清液备用。取21支试管,每管分别加大肠埃希菌菌悬液0.1mL和处理后的噬菌体液0.1mL,振荡使其充分混匀,静置15min,使噬菌体和宿主菌充分吸附。将7g/L半固体LB培养基融化后自然降温到50℃左右,取10mL加入试管,摇晃,充分混匀,再倒入LB平板,37℃培养6h,观察结果。
1.2.3 噬菌体的纯化 当有噬菌斑出现时,用灭菌牙签挑取单个噬菌斑接种于相应的宿主菌菌悬液中,37℃、180r/min摇床培养8h,10 000r/min离心处理10min,重复此挑斑步骤2次~3次即可得到较纯的噬菌体。
1.2.4 噬菌体的保存 取最终纯化的噬菌体加入甘油分6管冻存。
1.2.5 滴度测定 参照文献[6],以LB液体培养基为稀释液,将纯化后的噬菌体作连续10倍稀释。分别取100μL稀释后的各个梯度噬菌体与100μL对应宿主菌菌悬液充分作用后,采用双层平板法进行培养,观察结果。上述每个稀释度分别做三个平行重复。计数时,选取噬菌斑数在30~300之间的平板,采用平均数计算滴度。噬菌体的滴度(PFU/mL)=稀释倍数×噬菌斑个数的平均数×10。
1.2.6 裂解谱的测定 取纯化后的噬菌体原液0.1mL,分别加入到21株奶牛乳房炎大肠埃希菌菌悬液(0.1mL)中,室温静置15min,采用双层琼脂平板法观察分离株噬菌体对不同大肠埃希菌的裂解情况。
1.2.7 最佳感染复数的测定 感染复数是指感染发生之前,噬菌体与宿主菌数量的比值。最佳感染复数(Multiplicity of infection,MOI)表示子代最高产出率。参照文献[7],取分离株噬菌体对应的对数期菌悬液,按感染复数分别为0.1、1、10、100加入噬菌体。37℃摇床培养8h,采用双层琼脂平板法测定最佳感染复数。
1.2.8 pH 稳定性的测定 制备pH 为4、5、6、7、8、9的LB液体培养基。取6个试管,分别加入9 mL不同pH的LB液体培养基,再分别加入1mL纯化后的噬菌体原液,于37℃条件下作用2h。采用双层琼脂平板法分析不同pH对噬菌体滴度的影响。
1.2.9 温度稳定性的测定 将噬菌体分别在30℃、40℃、50℃、60℃温度条件下处理1h,采用双层琼脂平板法分析不同温度对噬菌体滴度的影响。
1.2.10 紫外线稳定性的测定 将1mL噬菌体稀释液(1.98×102PFU/mL)加入平板中,直接暴露在超净工作台中,紫外线灯照射。在0、2、4、6、8、10、12min时,取0.1mL噬菌体处理液加入0.1mL相应宿主菌,震荡使其充分混匀,室温静置15min,倒板,测定不同照射时间条件下噬菌体的滴度。
2 结果
2.1 大肠埃希菌噬菌体的分离及噬菌斑观察结果
采用双层琼脂平板法培养6h后,肉眼可见直径相差不大,边缘整齐,无晕环、透明清晰的噬菌斑(图1),将其命名为EcP1。
2.2 噬菌体EcP1滴度测定结果
通过双层琼脂平板法测定计数可知,噬菌体EcP1的滴度为7.75×1010PFU/mL。
2.3 噬菌体EcP1裂解谱测定结果
通过裂解谱的测定,可知EcP1的裂解率为33.3%(表1)。
2.4 噬菌体EcP1的最佳感染复数测定结果
经过4h的培养,通过滴度的测定,在MOI为0.1、1、10、100时进行试验,当 MOI=10时,噬菌体EcP1产生子代的滴度为1.65×109PFU/mL,是4种感染中最高的(表2)。
图1 噬菌体EcP1形成的噬菌斑Fig.1 The plaque of bacteriophage EcP1

表1 噬菌体EcP1的裂解谱Table 1 The lysis spectrum of bacteriophage EcP1

表2 最佳感染复数的测定Table 2 Determination of optimal multiplicity of infection(MOI)
2.5 噬菌体EcP1的pH稳定性测定结果
噬菌体EcP1经过不同的pH处理2h后,pH为6时滴度最高,滴度维持在1011左右。当pH为4、10时,滴度为零。这种趋势说明强酸、强碱都会严重影响噬菌体的活性(图2)。
2.6 噬菌体EcP1热稳定性测定结果
噬菌体EcP1经过不同温度处理1h后,温度为30℃时滴度最高,达到1.00×1011PFU/mL,同时,40℃~50℃时滴度均维持在1010,当60℃的时候,滴度明显下降,这种趋势说明高温也严重影响噬菌体的活性(图3)。
2.7 噬菌体EcP1紫外线稳定性测定结果
随着紫外线照射时间的持续,噬菌体EcP1的活性逐渐降低。紫外线持续照射12min时仅产生2个噬菌斑,紫外线的照射直接导致噬菌体的快速失活(图4)。
2.8 噬菌体EcP1在-20℃保存
经本实验室在-20℃冰箱中保存1个月后,可重新分离到噬菌体,其滴度没有发生明显的变化,维持在105。保存10个月后依然可以分离到噬菌体,滴度维持在104。

图2 噬菌体EcP1对pH的耐受能力Fig.2 The resistance of bacteriophage EcP1to different pH
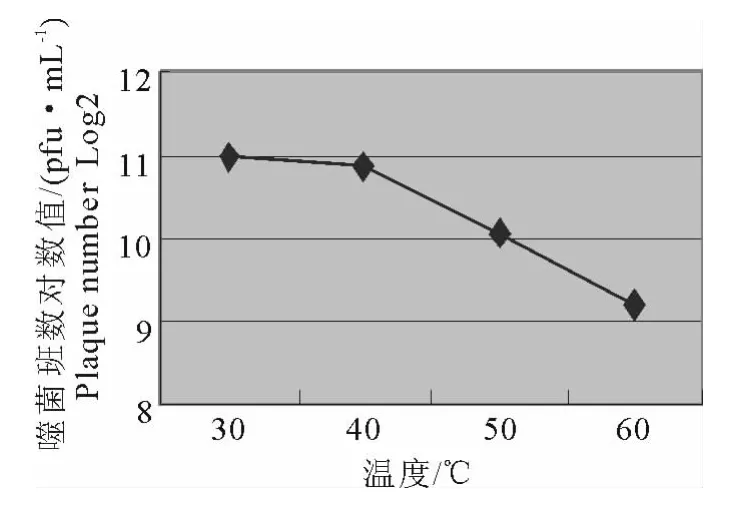
图3 噬菌体EcP1对温度的耐受能力Fig.3 The resistance of bacteriophage EcP1 to different temperatures

图4 噬菌体EcP1对紫外线的耐受能力Fig.4 The resistance of bacteriophage EcP1to ultraviolet rays
3 讨论
奶牛乳房炎是奶牛的常见多发病,在奶牛养殖中危害最大,是投入药费最多、防治最难的奶牛主要疾病之一。目前,全世界约有2.2亿头奶牛,其中1/3患有各种类型的乳房炎。我国奶牛乳房炎发病率在20%~70%之间,有的甚至更高[8-10]。现已证实大肠埃希菌是引致奶牛乳房炎的主要病原菌之一,检出率为7.22%[11-12]。传统的抗生素治疗方法因其在临床上容易出现耐药和药物残留等问题受到广泛争议。所以,探索新型的治疗方案迫在眉睫。以中草药制剂、疫苗等为代表的生物制剂因具有较多的优点而被人们广泛关注[13]。近年来,噬菌体作为一种微生态制剂已经广泛的在医学、兽医学、食品行业、养殖业、环境等相关领域得到了广泛的应用[14-15]。作为一种微生态制剂,噬菌体治疗具有取材广泛、较强的复制能力、宿主特异性、无耐药性、无残留等优点,越来越多受到人们的重视。本研究在前期病原分离的基础上,以致奶牛乳房炎的大肠埃希菌为宿主菌分离到1株裂解性噬菌体,该分离株噬菌体滴度为1010PFU/mL,与国内有关研究的结果相似[16]。该株噬菌体对试验中21株大肠埃希菌的裂解率为33.3%,最佳感染复数为10,在pH 5~9范围内作用2h、30℃~40℃时作用1h其滴度变化不显著,紫外线照射14min可被全部灭活,在-20℃条件下保存10个月仍保持活性。
根据本试验对于最佳感染复数的测定结果表明,噬菌体的分离与最佳感染复数有关,本试验中在最佳感染复数为0.1时,没有出现相应的噬菌斑,可能是由于噬菌体数量的过少导致噬菌体增殖速度跟不上细菌的增殖速度,被菌苔覆盖,无法获得明显的噬菌斑。所以,调节菌悬液的浓度可以提高噬菌体的分离率。
噬菌体与细菌作用的过程中,只有完全充分的吸附后才有可能使噬菌体依附细菌大量繁殖,在噬菌体富集的时候,保证噬菌体与宿主菌混合后静置15min~20min是很有必要的;摇床培养的时候转速过高也会对噬菌体与细菌的吸附过程造成影响,选择180r/min是本试验采用的方法。
噬菌体的常规保存方法是甘油冻存,本试验将所得噬菌体甘油冻存的同时,取一部分于-20℃冰箱冷冻,经10个月后,测定其滴度,发现该噬菌体依旧保持较高生物活性,证实了该保存方法的可行性。
[1]富艳玲,刘爱玲,李旭东.奶牛乳房炎防治技术研究进展[J].中国兽药杂志,2010,44(7):51-54.
[2]武 英.应对耐药菌的新方法-噬菌体制剂[J].国外医药抗生素分册,2011,32(5):223-227.
[3]王 静,王 劲,孙运峰,等.治疗性噬菌体制剂的研究进展[J].食品与药品,2011,13(9):366-370.
[4]赵庆友,朱瑞良.噬菌体制剂的研究现状及发展前景[J].中国兽药杂志,2010,44(7):40-43.
[5]Sambrook J,Russell D W.分子克隆实验指南[M].3版.黄培堂,等,译.科学出版社,2002:27-30.
[6]Jamalludeen N,Johnson R P,Friendship R,et al.Isolation and characterrization of nine bacteriophages that lyse O149enterotoxigenic Escherization coli[J].Vet Microbiol,2007,124:47-57.
[7]孙荣华,李菁华,史红艳,等.大肠埃希菌噬菌体的分离鉴定及其生物学特性研究[J].中国病原生物学杂志,2009,4(2):88-90.
[8]刘建平,杜 江,刘 琴.奶牛乳房炎研究概况[J].动物医学进展,2008,29(增):40-41.
[9]邓海平,蒲万霞,俞诗源,等.奶牛乳房炎主要病原菌及其分离鉴定方法研究进展[J].中国草食动物,2009,29(2):52-55.
[10]王 凤,宋 立,汤德元,等.奶牛乳房炎病原菌的分离鉴定、血清型、及耐药性研究[J].动物医学进展,2013,34(6):62-67.
[11]高 潮,刘国庆,连英琪,等.奶牛隐性乳房炎病原菌的分离鉴定与DGGE追溯[J].上海交通大学学报:农业科学版,2014,31(3):88-94.
[12]McGrath S,Sinderen D V.Bacteriophage:Genetics and molecuLar biology[M].Caister Academic Press,2007:1221.
[13]钱 立,丁建平,陶 勇,等.中草药防治奶牛乳房炎[J].动物医学进展,2006,27(5):105-108.
[14]李宏胜,郁 杰,李新圃,等.奶牛乳房炎类型与病原菌感染之间相关性的研究[J].动物医学进展,2004,25(6):80-84.
[15]张 娜,李书光,陈金龙,等.噬菌体制剂治疗细菌感染的研究进展[J].中国畜牧兽医,2011,38(9):221-223.
[16]李陇平,张智英.金黄色葡萄球菌烈性噬菌体的分离鉴定和最佳保存方法研究[J].中国畜牧兽医,2011,38(6):141-146.

