不同疗程三联疗法治疗幽门螺旋杆菌阳性消化性溃疡疗效观察*
张 豹 崔姗姗 张诒凤 付明燕 张汝建
(1.泰山医学院,山东 泰安 271016; 2.泰山医学院附属医院,山东 泰安 271000)
幽门螺旋杆菌(helicobacter pylori,Hp)自1983年由澳大利亚学者 Warren和 Marshall从胃黏膜活检组织中成功分离后,人类对Hp的研究就从未间断过。经大量临床研究证实,幽门螺旋杆菌与多种疾病的发生密切相关,最常见的疾病是消化性溃疡、慢性胃炎、胃黏膜相关淋巴组织(MALT)淋巴瘤和胃癌等。临床上通过药物根除幽门螺旋杆菌,能提高消化性溃疡的治愈率,降低复发率,获得临床医生的一致认可。目前国内根除幽门螺旋杆菌的方案多推荐质子泵抑制剂加两种抗生素(即标准三联)的7日疗法[1],而在美国多推荐采用 10日或 14日疗程[2]。随着抗菌药物的广泛应用,幽门螺旋杆菌耐药性增强,而将“标准三联”疗法疗程延长,能否带来更好的疗效和安全性报道不多。本研究采用国内常用标准三联:泮托拉唑、克拉霉素、阿莫西林,通过观察比较不同疗程的HP根除率、溃疡愈合率及不良反应发生率,了解疗程对疗效的影响,以寻求合理治疗时间。
1 资料和方法
1.1临床资料 所选病例均来自泰山医学院附属医院消化科,于2012年7月~2013年6月因反酸、烧心、上腹痛来院就诊的病人,并经电子胃镜检查,并同时行14C尿素呼气试验(UBT)检查确诊为Hp阳性的消化性溃疡患者。共选择120例病人,年龄在20~65岁。经电子胃镜检查,所选病例在治疗前溃疡直径约0.4~1.0 cm。排除标准是:(1)严重的心肺、肝脏、肾脏功能不全,(2)治疗前4周内有抗生素和H2受体阻滞剂(H2RA)、质子泵抑制剂(PPI)用药史及2周内规律服用非甾体类抗炎药物者,(3)既往幽门螺旋杆菌治疗史,(4)既往上消化道疾病手术史,(5)严重的精神或神经系统疾病,(6)目前怀孕或哺乳期妇女,(7)对研究方案中药物过敏者。所有研究均获得患者的知情同意,并签署知情同意书。
1.2研究方法 根据Maastricht-3共识[3]及相关文献[4],我们采用标准三联疗法:泮托拉唑(湖南健朗药业有限责任公司)、阿莫西林(山东淄博新达制药有限公司)、克拉霉素(山东鲁抗辰欣药业)。泮托拉唑40 mg,每日2次,阿莫西林1.0 g每日2次,克拉霉素0.5 g,每日2次。泮托拉唑于饭前半小时服药,阿莫西林和克拉霉素于饭后半小时服药。随机将患者分为A、B、C 3 组, 每组各40 例, 每组用药方案相同,但服药疗程不同, A 组服药7日,B组服药10日, C组服药14日。每组病例在年龄、性别、病情等方面差异无统计学意义。
1.3观察指标 每组患者按疗程完成治疗结束后满4周来院,复查电子胃镜和14C尿素呼气试验,了解消化性溃疡愈合情况及幽门螺旋杆菌根除情况,并评价药物不良反应发生情况。
1.4疗效判订标准[5]消化性溃疡:痊愈:内镜下溃疡完全愈合,周围无红肿等炎症反应;显效:内镜下溃疡完全愈合,但周围仍有红肿等炎症反应;有效:内镜下溃疡面积较治疗前缩小超过50 %;无效:内镜下溃疡面积较治疗前缩小不足50 %;总有效=痊愈+显效+有效。幽门螺旋杆菌的根除[6]:14C尿素呼气试验(UBT)检查Hp阳性转为阴性。
1.5统计学处理 各组的Hp根除率和溃疡愈合率均用按意愿治疗(intention-to-treat, ITT)和符合方案集分析(perprotocol, PP)进行评价。本实验数据采用 SPSS 17.0统计学软件,进行统计分析,计量资料用方差分析,计数资料用χ2检验,P≤0.05为差异有统计学意义。
2 结 果
本研究结束实际共完成病例114例,其中3例病人失访,3例病人未按规定服药,具体情况见表1。
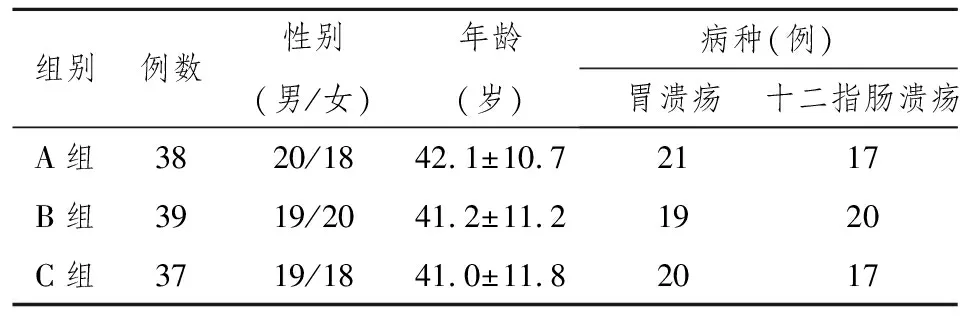
表1 各组患者一般资料
2.1Hp根除率 ITT分析和PP分析,两者结果一致。A组与B组和C组之间比较,差异有统计学意义(P<0.05)。B组和C组之间比较,差异无统计学意义(P>0.05)。各组患者HP根除情况见表2。

表2 各组HP根除率比较
2.2溃疡愈合率 ITT分析和PP分析,两者结果一致。A组、B组、C组之间比较,差异无统计学意义(P>0.05)。对于远期疗效观察,未纳入本次研究。具体详见表3。
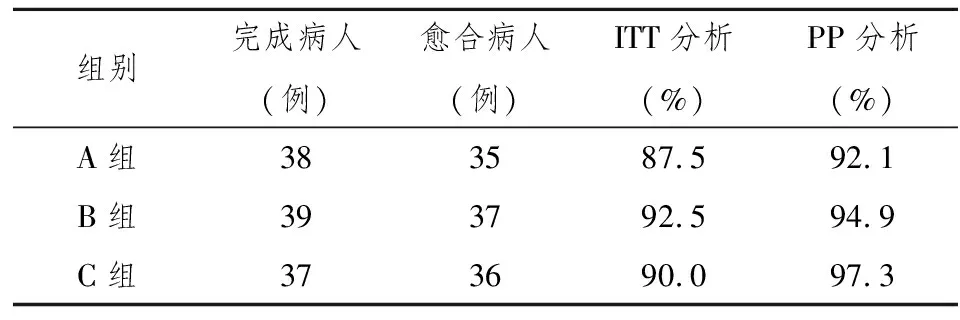
表3 各组HP愈合率比较
2.3不良反应发生率 A、B、C三组患者治疗前后行血常规、肝功、肾功、血无机离子检查,均无明显变化。A组不良反应 2例,B组不良反应2例,C组不良反应8例,所有不良反应症状轻微,患者均可耐受,停药后症状自行消失,未作特殊处理。A组和 B组不良反应发生率均明显低于 C组(P<0.05),而 A组与 B组之间差异无统计学意义(P>0.05)。各组患者不良反应情况,详见表4。
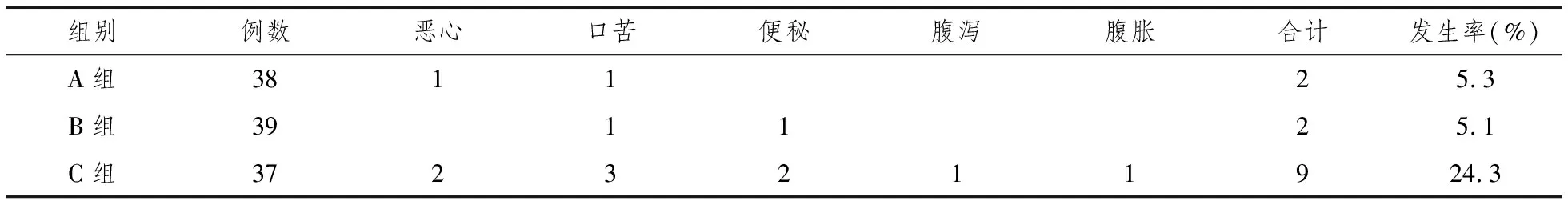
表4 各组不良反应发生情况及发生率
3 讨 论
消化性溃疡病是消化系统的常见病和多发病,全球约有 5%~10%的人一生中患过此病。消化性溃疡最常见的是胃溃疡和十二指肠溃疡,在临床上表现为慢性、周期性、节律性疼痛,常伴有上腹胀、嗳气、反酸等症状,也可无明显症状或症状较轻微,不为患者所注意。消化性溃疡是一种多因素所致的疾病,其中最常见的原因是幽门螺旋杆菌感染和服用非甾体抗炎药(NSAID)。幽门螺旋杆菌引起消化性溃疡主要基于两个方面的证据:(1)在消化性溃疡患者的人群中,幽门螺旋杆菌检出率比对照的普通人群高。(2)根除幽门螺旋杆菌可降低消化性溃疡复发率,如单纯用常规抑酸治疗愈合的溃疡,复发率为50%~70%,而根除 HP可使溃疡年复发率降至 5%以下,这就证明去除病因后,消化性溃疡可获治愈[4]。根除 Hp使绝大多数消化性溃疡不再是一种慢性、复发性疾病,而是可彻底治愈[7]。
全球半数人口曾经感染幽门螺旋杆菌[8],流行病学调查表明,我国 Hp感染率总体上仍然很高,成人中感染率达 40%~60%[9], Hp治疗方案一直是广大临床医师研究的热点。理想的 Hp根除方案应符合:根除率达到≥90%(PP分析)或≥80%(ITT分析),溃疡愈合迅速、症状消失快,患者依从性好,耐药率低,治疗简便和价格便宜等[10]。2007年江西庐山第三次全国Hp会议共识,也把PPI联合 2种抗生素的1周“三联”疗法作为根除 Hp治疗的一线推荐方案首选。传统“三联”疗法是“奥美拉唑、阿莫西林、甲硝唑或克拉霉素”。奥美拉唑是第一个用于临床的苯丙咪唑类PPI,为单烷氧基吡啶化合物,服药2h后血浆浓度达高峰,半衰期约1h。单剂量的生物利用度为35%,多剂量生物利用度增至60%。而泮托拉唑是新一代PPI制剂,可通过 H+-K+-ATP酶的活性抑制中枢或外周介导的胃酸分泌[11]。泮托拉唑为合成的二烷氧基吡啶化合物,在吡啶环 4位上去甲基并与硫酸盐结合,在壁细胞小管中转化为嗜硫的环化次硫酰胺,与膜表面的 H+/H+-ATP酶第 5,6节段的半胱氨酸作用,形成复合物使酶失活。其生物利用度比奥美拉唑提高 7倍,对壁细胞的选择性更专一。因为泮托拉唑更高的选择性,在分子水平上泮托拉唑比奥美拉唑和兰索拉唑的作用更为准确;泮托拉唑既可降低胃酸的基础水平,又可减少餐后胃酸的分泌,还具有抗菌活性, Hp根除率高[12]。目前幽门螺旋杆菌根除率随着抗生素的广泛耐药而逐年下降。中华医学会消化病学分会幽门螺旋杆菌学组于2005年3月-2006年5月,完成了一项涉及全国16个省市,包括20多个中心的大规模幽门螺旋杆菌耐药(包括对阿莫西林、甲硝唑、克拉霉素耐药)流行病学调查和耐药原因分析,其结果显示甲硝唑耐药率为50%~100%(平均73.3%),克拉霉素耐药率为0~40%(平均23.9%),阿莫西林耐药率为0~2.7%。尤其是甲硝唑有明显的地区差异[13]。传统三联 7日疗法早期Hp根除率较高,Frevel M等人[14]研究发现Hp根除率达到94. 0%。但近年来文献报道,传统三联疗法的根除率已降至 66.6%[15]。国外学者研究表明,标准三联疗法的疗程从 7日延长至 10日或 14日,根除率较前能得到提高[16]。
此次研究结果:“泮托拉唑+阿莫西林+克拉霉素”的三联疗法,标准的7日疗法Hp根除率虽较往年明显偏低,根除率为71.1%,但通过延长疗程,改为10日和14日,仍取得理想效果。10日疗法Hp根除率为89.7%,14日疗法Hp根除率为94.6%,两者与7日疗法比较均有统计学意义,10日和14日Hp根除率无显著差异,无统计学意义。溃疡愈合率在三组未见显著差异,说明7日疗法已取得较高溃疡愈合。在不良反应反面,14日疗法明显高于7日和10日疗法,与后两者比较均有统计学意义。而7日疗法和10日疗法之间,不良反应发生率无显著差异,无统计学意义。本结果与任红兵等人[17]的研究结果不同,分析其原因可能是与其观察病例数较少,用药剂量较此次研究低有关。因此可以认为泮托拉唑、克拉霉素、阿莫西林三联 10日疗法为最佳治疗时间,可考虑作为本地区根除Hp感染的消化性溃疡较为理想的方案。因幽门螺旋杆菌耐药性有地区差异性,能否推广仍需多中心大样本研究。有条件者可行幽门螺旋杆菌培养及药物敏感试验,以获得最佳治疗效果。
[1] 田雨,王蔚虹,胡伏莲.中国幽门螺杆菌感染治疗共识意见[J].中国医药导刊,2007,9(2):104-105.
[2] Howden C W, Hunt R H. Guidelines for the management of Helicobacter pylori infection [J]. Am J Gastroenterol,1998, 93:2330.
[3] Malfertheiner P,Megraud F,0′Morain C,et al.Current concepts in the managementof Helicobacter pylori infection:the Maastricht III Consensus Report[J].Gut,2007,56:772-781.
[4] 陆再英,钟南山.内科学[M].第 7版.北京:人民卫生出版社,2008:387-394.
[5] 辛晓梅,丁士刚.幽门螺杆菌根除治疗失败后对策研究进展[J].胃肠病学,2011,16(9): 572-574.
[6] 胡伏莲,胡品津,刘文忠,等.第三次全国幽门螺杆菌感染若干问题共识报告(2007·庐山)[J].现代消化及介入诊疗,2008,13(1):73-76.
[7] Lang L.Barry Marshall 2005 Nobel laureate in medicine and physiology[J].Gastroenterology,2005,129(6): 1813-1814.
[8] Covacci A,Telford JL,Del Giudice G,et al.Helicobacter pylori virulence and genetic geography [J].Science,1999,284(5418):1328-1333.
[9] 张万岱,胡伏莲,萧树东,等.中国自然人群幽门螺杆菌感染的流行病学调查[J].现代消化及介入诊疗,2010,15( 5) : 265-270.
[10] 胡伏莲,周殿元.幽门螺杆菌感染的基础与临床[M].北京:中国科学技术出版社, 2002: 351.
[11] 王红丽.泮托拉唑治疗胃溃疡的疗效观察[J].中华医护杂志,2007,4(1):42-43.
[12] 樊德存,王永利.中国药物大全:西药卷[M].第2版.北京:人民卫生出版社, 2005:401.
[13] 胡伏莲.幽门螺杆菌感染治疗新进展[J].医学与哲学:临床决策论坛版,2007,28(6):12-14.
[14] Frevel M, Daake H, Janisch HD, et al. Eradication of Helicobacter pylori with pantoprazole and two antibiotics:a comparison of two short-term regimens[ J ] . Aliment Pharmacol Ther, 2000,14(9):1151-1157.
[15] Fischbach L,Evana EL.Meta-analysis; the effect of antibiotic resistance status on the efficacy of triple and quadruple first-line theraies for Helicobacter pylori[J].Aliment Pharmacol Ther,2007,26(3):343-357.
[16] Malfertheiner P,Megraud F,O' Morain CA,et al.Management of Heli-cobacter pylori infection-the Maastricht IV/Florence Consensus Report[J]. Gut, 2012, 61(5):646-664.
[17] 任红兵,谭俊华.幽门螺杆菌相关性消化性溃疡根除幽门螺杆菌治疗的疗程研究[J].中国医药导报,2008,5(26):50-51.

