p40、TTF-I、p63、CK5/6在肺腺癌和肺鳞癌中的表达及其意义
焦立卓,陈涵斌,赵灵灵,王玲,林中民,陈霖,陈国荣,蔡国平
(温州医科大学附属第一医院 病理科,浙江 温州 325015)
目前肺癌的发病率仍居高不下,严重威胁着人们的健康。肺腺癌有靶向治疗,但如果肺鳞癌患者采用了肺腺癌靶向治疗的药物会导致严重出血。 新治疗方法的疗效取决于肿瘤的组织学特征,所以肺腺癌和肺鳞癌的鉴别,尤其是中-低分化肺腺癌与中-低分化肺鳞癌的鉴别具有很重要的临床意义。目前应用TTF-1、p63、CK5/6等免疫组织化学指标来鉴别肺腺癌和肺鳞癌的技术已经比较成熟,但其特异度和敏感度均不是很高。近来,国外研究显示,ΔNp63(p40)似乎是一个更可靠的肺鳞癌的标记物[1]。本实验通过免疫组织化学法,检测p40、TTF-1、p63、CK5/6在肺腺癌和肺鳞癌中表达的差异性,并分析4种蛋白表达与肺癌患者临床病理指标之间的关系。
1 材料和方法
1.1 一般资料 收集2011年1月-2012年12月温州医科大学附属第一医院手术切除的肺腺癌标本108例、肺鳞癌病理标本66例。统计前经本院2位病理科医生重新读片,核实诊断。肺癌病理标本中男121例,女53例,年龄≥60岁的110例,<60岁的64例。肺癌中高分化组18例,中分化组92例,低分化组64例。TNM分期[2]:I期与II期139例,III期35例。肿块直径≥3 cm的103例,<3 cm的71例。无吸烟病史的83例,有吸烟史且<30年的20例,≥30年的71例。淋巴结转移62例,未转移112例。
1.2 试剂和仪器 所用一抗包括兔抗人单克隆抗体p40,鼠抗人单克隆抗体p63,鼠抗人单克隆抗体CK5/6及鼠抗人单克隆抗体TTF-1;二抗PV-9000试剂盒,显色DAB试剂盒均购自北京中杉金桥生物有限公司;p40购自Abcam(香港)有限公司,组织芯片制备仪TM-1购自北京博医康实验仪器有限公司。
1.3 方法
1.3.1 组织芯片制作:复习所有患者的常规HE切片,显微镜下观察,每例选取3个(2处癌,1处癌旁)最具代表性病变的位置做定位标记,在其对应蜡块上找出所标记部位,采用组织芯片制备仪在预先制备好的空白受体蜡块上打孔,在做好标记的蜡块上钻取定位部位的组织柱,按设计方案植入受体蜡块,形成一个微阵列。制作9×9组织芯片2个,9×8组织芯片5个,9×7组织芯片1个。同时收集乳腺癌、正常前列腺、皮肤、甲状腺组织各一块,脱水包埋,制作蜡块,取组织柱放在微阵列旁作对照。
1.3.2 免疫组织化学染色:常规4μm组织芯片切片,二甲苯脱蜡,梯度乙醇脱水,10%过氧化氢阻断液阻断内源性过氧化物酶10 min,高压热修复,修复液均为pH 8.0的EDTA液,自然冷却,加一抗,4 ℃过夜,加二抗后37 ℃孵育30 min,DAB显色。p40、p63、CK5/6、TTF-1分别用乳腺癌组织、前列腺组织、皮肤、甲状腺组织做阳性对照,阴性对照均以PBS液代替一抗。
1.3.3 结果判定:p40、p63及TTF-1阳性细胞染色均位于细胞核,CK5/6阳性细胞染色位于细胞质。由2位病理医师对免疫组织化学检测结果进行评估。染色强度评分标准:依据切片中4个40倍物镜视野中阳性细胞所占观察同类细胞数的百分比判断结果:阳性细胞0%~10%为“-”,11%~50%为“+”,51%~75%为“++”,75%~100%为“+++”。
1.4 统计学处理方法 应用SPSS 17.0软件进行统计学分析。组间差异性比较、蛋白表达与临床病理指标比较采用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 p40、p63、CK5/6、TTF-1蛋白在肺鳞癌中的表达 p40在66例肺鳞癌中的阳性表达率为93.9%(62/66),其中“+”12例、“++”27例、“+++”23例,见图1。p63在肺鳞癌中的阳性表达率为86.4%(57/66),其中“+”14例、“++”25例、“+++”18例,见图2。CK5/6在肺鳞癌中的阳性表达率为89.4%(59/66),其中“+”17例、“++”21例、“+++”21例,见图3。TTF-1的阳性表达率为6.1%(4/62),其中“+”2例、“++”1例、“+++”1例,见图4。
2.2 TTF-1、p40、p63、CK5/6蛋白在肺腺癌中的表达 TTF-1在108例肺腺癌中的阳性表达率为95.4%(103/108),其中“+”22例、“++”40例、“+++”41例(见图5)。p40的阳性表达率为3.7%(4/108),“+”4例,见图6。p63阳性表达率为22.2%(24/108),其中“+”20例、“++”4例。CK5/6的阳性表达率为24.1%(26/108),其中“+”18例、“++”8例。
2.3 p40在肺鳞癌诊断中的优势 p40、p63、CK5/6在肺鳞癌中的特异度分别是96.3%、77.8%、75.9%,三者的特异度经统计学分析差异有统计学意义(P<0.05),p40对肺鳞癌的特异度高于p63、CK5/6(P<0.05),p63与CK5/6对肺鳞癌的特异度差异无统计学意义(P>0.05);三者对肺鳞癌的灵敏度分别是93.9%、86.4%、89.4%,差异无统计学意义(x2=3.526,P=0.172),见表1。

图1 p40在肺鳞癌中呈强阳性表达(×400)
图4 TTF-1在肺鳞癌中的强阳性表达(×400)

图2 p63在肺鳞癌中呈强阳性表达(×400)

图5 TTF-1在肺腺癌中呈强阳性表达(×400)

图3 CK5/6在肺鳞癌中呈强阳性表达(×400)

图6 p40在肺腺癌中的弱阳性表达(×400)
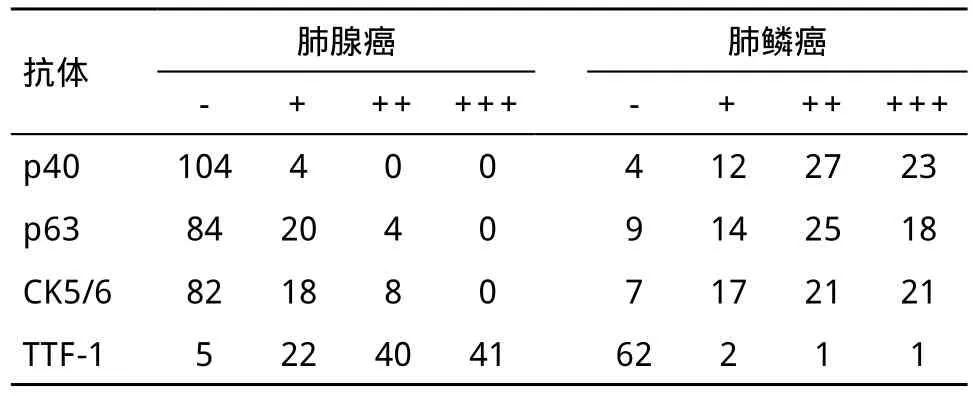
表1 p40、p63、CK5/6、TTF-1蛋白在肺癌中的表达
2.4 p40、p63、CK5/6、TTF-1与临床病理指标之间的相关性 p40、p63、TTF-1与性别、病理类型、肿块大小、吸烟史有关(均P<0.05),与年龄、分化程度、淋巴结转移及TNM分期无关(均P>0.05);CK5/6与性别、病理类型、肿块大小、吸烟史及分化程度有关(均P<0.05),与年龄、淋巴结转移及TNM分期无关(均P>0.05)。具体见表2。
2.5 p40、p63、CK5/6在不同分化程度肺鳞癌中的表达 在低分化肺鳞癌中p40的阳性表达率(为89.3%)高于p63(为78.6%)和CK5/6(为75.0%),在高、中分化肺鳞癌中三者的阳性表达率差异无统计学意义(P>0.05),见表3。
3 讨论
目前对于分化程度较好的肺腺癌和肺鳞癌,两者鉴别一般不存在困难,但是对于低分化肺腺癌和肺鳞癌的鉴别仍具有挑战性,需要进行免疫组织化学染色标记区分。组织芯片技术适于研究肿瘤群体,能够很好地反映免疫组织化学指标与肿瘤临床病理参数之间的关系。
3.1 p40、p63、CK5/6、TTF-1在肺腺癌和肺鳞癌中的表达情况 文献报道TTF-1在肺腺癌的阳性表达率为27%~100%[3-4]。国内王红梅等[5]研究发现TTF-1在肺腺癌中的阳性表达率为84.6%,在肺鳞癌中的阳性表达率为5%。TTF-1还可以在肺小细胞癌及脑组织中表达[6],阳性表达率各研究报道不一。本研究中TTF-1在108例肺腺癌中的阳性表达率为95.4%(103/108),在肺鳞癌中的阳性表达率为6.1%(4/62),肺腺癌中TTF-1的阳性表达率高于文献报道,可能与本研究采用的阳性判断标准及标本均为手术切除标本有关。肺鳞癌中TTF-1的阳性表达率与文献报道较一致。
p63基因编码两类转录产物:一类是与p53相似的酸性N端反式激活区的全长p63(TAp63),其功能与p53类似,能反式激活p53靶基因的转录并且可以诱导细胞凋亡;另一类为缺乏酸性N端反式激活区的截短p63(△Np63),其丧失了反式激活p53靶基因及诱导细胞周期停滞、细胞凋亡的功能[7]。Nonaka等[8]的研究中检测了p63、p40及TTF-1在150例肺腺癌和50例肺鳞癌中的表达,结果显示,p40选择性地表达在鳞癌,p63不仅限于鳞癌,在腺癌中的阳性表达率约15%,其表达可以是弥漫的,p63在除外黏液型腺癌的所有亚型腺癌中均表达。p40在所有肺腺癌呈阴性。p63阳性的低分化肺腺癌可能被错误地诊断为肺鳞癌。力超等[9]检测了p40、p63、TTF-1在107例肺鳞癌和119例肺腺癌中的表达,结果显示p40、p63的灵敏度、特异度分别为93.5%、97.5%和94.4%、74%。Bishop等[1]检测了p40、p63在81例肺鳞癌、237例肺腺癌和152例大细胞淋巴瘤中的表达,p40的灵敏度为100%,特异性为98%;p63的灵敏度为100%,特异性为60%。本实验结果显示p40、p63、CK5/6在肺鳞癌中的灵敏度分别是93.9%、86.4%、89.4%,差异无统计学意义(P>0.05);特异度分别是96.3%、77.8%、75.9%,经统计学分析差异有统计学意义(P<0.05)。p40在肺鳞癌中有50例呈“++、+++”(阳性细胞比例为51%~100%),12例呈“+”(阳性细胞比例为11%~50%),强阳性表达率为80.6%;p63强阳性表达率为75.4%(43/57);CK5/6强阳性表达率71.2%(42/59)。在肺腺癌中p40阳性表达率为3.7(4/108),4例均呈“+”(阳性细胞比例为11%~50%);p63阳性表达率为22.2%(24/108);CK5/6阳性表达率为24.1%。上述实验结果与文献报道的基本一致。证实p40与p63、CK5/6相比,是一个更可靠的肺鳞癌标记。

表2 p40、p63、CK5/6、TTF-1的表达与肺癌临床病理指标的相关性

表3 p40、p63、CK5/6的表达与鳞癌分化程度的关系 n(%)
3.2 p40、p63、CK5/6、TTF-1与临床病理指标之间的相关性 有文献报道TTF-1蛋白在女性、不吸烟、高分化及无症状者中升高明显,主要表达于肺腺癌。p63蛋白阳性多见于男性、有吸烟史者,其表达随着肺鳞癌的分化程度增加而增加,与临床分期呈负相关。logistic多因素分析显示,患者有无吸烟史及病理类型为影响TTF-1、p63表达的因素[10]。张瑞萍等[11]指出TTF-1的阳性表达率与肺癌组织类型密切相关,分化程度、淋巴结转移及临床分期无关。本研究中p40、p63、TTF-1的表达与性别、病理类型、肿块大小、吸烟史有关,与年龄、分化程度、淋巴结转移及TNM分期无关;CK5/6除了与性别、病理类型、肿块大小、吸烟史有关外,还与分化程度有相关性,与年龄、淋巴结转移及TNM分期无关。结果显示肺癌患者的一些临床病理指标与免疫组织化学指标表达的阳性率之间存在相关性。
3.3 p40、p63、CK5/6在不同分化程度肺鳞癌中的表达 在低分化肺鳞癌中p40的阳性表达率(为89.3%)高于p63(为78.6%)和CK5/6(为82.1%),本实验中由于收集的高分化鳞癌例数过少,尚不能说明各指标在高分化鳞癌中的阳性表达率是否存在差异,但在实际工作中,高分化肺鳞癌较易通过常规病理形态学得以确诊,而p40对低分化肺鳞癌的鉴别是优于p63、CK5/6的。
综上所述,p40在肺鳞癌的鉴别中有较高的特异度,其对低分化肺鳞癌的鉴别也存在优势,对临床工作中难以鉴别的肺鳞癌和肺腺癌具有较高的实用价值。但本实验只是初步探讨了p40、p63、CK5/6、TTF-1对肺鳞癌和肺腺癌的鉴别等应用价值及其表达与患者临床病理指标之间的关系,由于肺腺癌和肺鳞癌的明确鉴别具有重要的临床意义,所以我们需要进一步探索和寻找更好的免疫组织化学指标,并明确各免疫组织化学指标与患者临床病理指标之间的内在联系。
[1]Bishop JA, Teruya-Feldstein J, Westra WH, et al. p40(ΔNp63) is superior to p63 for the diagnosis of pulmonary squamous cell carcinoma[J]. Mod Pathol, 2012, 25(3): 405-415.
[2]叶波, 杨龙海, 刘向阳. 最新国际肺癌TNM分期标准(第7版)修订稿解读[J]. 中国医刊, 2008, 43(1): 21-23.
[3]Wu M, Wang B, Gil J, et al. P63 and TTF-1 immunostaining. A useful marker panel for distinguishing small cell carcinoma of lung[J]. Am J Clin Pathol, 2003, 119(5): 696-702.
[4]Marson VJ, Mazieres J. Expression of TTF-1 and cytokeratins in primary and secondry epithelial lung tumors: correlation with histological type and grade[J]. Histopathology,2004, 45(2): 125-134.
[5]王红梅, 周晓鸽. TTF-1在肺癌诊断和鉴别诊断中的应用价值[J]. 诊断病理学杂志, 2005, 12(6): 441-443 .
[6]Kargi A, Gurel D, Tuna B. The diagnostic value of TTF-1,CK 5/6, and p63 immunostaining in classification of lung carcinomas[J]. Appl Immunohistochem Mol Morphol, 2007,15(4): 415-420.
[7]周春辉, 王华新, 李晓楠, 等. 肺癌中p63与p53、E-cadherin、Ki-67表达的比较[J].临床与实验病理学杂志, 2004,20(4): 432-435.
[8]Nonaka D. A study of ΔNp63 expression in lung non-small cell carcinomas[J]. Am J Surg Pathol, 2012, 36(6): 895-899.
[9]力超, 韩维静, 何同梅, 等.p40(ΔNp63)在肺腺癌和鳞癌鉴别诊断中的价值[J]. 临床与实验病理学杂志, 2013, 29(8):855-858.
[10]张鹏, 韩一平, 黄玲, 等. TTF-1和p63在NSCLC组织中的表达及临床意义[J]. 中国肺癌杂志, 2009, 12(9): 995-999.
[11]张瑞萍, 高志安, 崔志, 等. Napsin A与TTF-1在肺癌中的表达及意义[J]. 中外医疗, 2012, 31(26): 10-12.

