稳定沉默黏着斑激酶结肠癌细胞株SW620的构建
洪卫文,苏国强,应红安,林峰,梁卫东
(1.台州市第一人民医院 普外科,浙江 台州 318020;2.厦门大学附属第一医院 普外科,福建厦门 361000;3.台州市第一人民医院 特需VIP病区,浙江 台州 318020)
黏着斑激酶(focal adhesion kinase,FAK)与肿瘤侵袭转移的高度相关性已在一些研究中得到证实[1-2]。FAK在原发性大肠癌、肝癌组织中高表达可能促进肿瘤侵袭转移,并有研究证实沉默FAK表达可以抑制乳腺癌、肝癌等恶性肿瘤细胞的增殖及转移[3-5]。FAK沉默有望成为结直肠癌治疗的新方法,而目前国内有关稳定沉默FAK的结肠癌细胞模型鲜有报道。本研究应用已构建的FAK RNA干扰(RNA interference,RNAi)慢病毒载体,通过包装293T细胞产生重组病毒,感染SW620结肠癌细胞,并使用新霉素G418筛选稳定感染病毒的细胞株,以建立稳定FAK沉默的结肠癌细胞株SW620模型。此方法将为进一步研究沉默FAK基因表达对人转移大肠癌细胞的侵袭和转移的裸鼠体内实验奠定基础。
1 材料和方法
1.1 材料 慢病毒表达载体pLentilox3.7、293T细胞、大肠杆菌DH5α均由厦门大学李博安教授惠赠。慢病毒包装系统由pLentilox3.7、PHR、VSVG质粒组成。
1.2 主要的仪器和试剂 CO2培养箱(美国Thermo Forma),倒置显微镜、倒置荧光显微镜、照相显微镜(日本Olympus),培养板(美国Costar),等。试剂:质粒小抽提取试剂盒(美国Qiangen),DMEM培养基、1640培养基、新生小牛血清、DMEM、G418、NEAA、RMPI 1640(美国Gibco),氨苄青霉素、TEMED(美国Sigma),TurboFect(美国Fermentas),PVDF膜、鼠抗人FAK、Matrigel(美国Millipore),24孔板、细胞计数板(美国Costar),Tris(美国Boehringer Mannheim),SDS(中国华美生物),羊抗鼠二抗(中国博士德)。
1.3 方法
1.3.1 重组RNAi质粒的扩增与提取:向DH5α感受态细菌100μL中加入构建好的重组RNAi质粒,冰浴30 min;42 ℃水浴锅中热休克90 s,冰浴2 min,然后铺于含氨苄霉素(30μg/mL)的琼脂平板表面,挑单个菌落,孵育12~16 h,按照试剂盒操作说明书提取纯化质粒。
1.3.2 重组FAK RNAi质粒的酶切鉴定将重组质粒和空载体同时双酶切:产物用3%琼脂糖凝胶电泳,分析酶切产物,进行酶切鉴定。①干扰质粒酶和对照空载体酶切体系:XbaI 1.0μL,NotI 1.0μL,10×M Buffer 2.0μL,质粒<1μg,无菌水补足至20.0μL,反应条件为37 ℃水浴锅中酶切2~3 h。②酶切产物电泳:预期结果为重组质粒组504 bp和7146 bp;空载体组为449 bp和7201 bp。1.3.3 慢病毒包装及滴度测定:采用改良的阳离子聚合物转染法:①转染前1 d将293FT细胞加入DMEM完全培养基,制成细胞悬液。②依次加入A体系:plasmid(pLL3.7 20μg,PHR 15μg,VSVG 6μg)10μL;B体系:Fermentas TurboFect转染试剂10 μL。③收集细胞上清加入新鲜的培养基,直到病毒完全被溶解。PBS将DAPI 1000倍稀释,在流式细胞仪下检测GFP表达频率。病毒滴度(IU/mL)=GFP阳性细胞数占总细胞数的百分比÷5×1.5×105×103。
1.3.4 肿瘤细胞培养、分组及重组慢病毒质粒感染肿瘤细胞:SW620细胞以1640培养基在5% CO2、37℃孵箱中培养,20~24 h至细胞融合度达90%。实验分三组:实验组(转染慢病毒质粒的pLL3.7 FAK的SW620细胞),阴性对照组(转染阴性对照慢病毒质粒pLL3.7的SW620细胞),未处理组(未转染质粒的SW620细胞)。在最佳病毒感染指数(multiplicity of infection,MOI)下感染对数生长期SW620细胞,感染慢病毒后,随MOI增加,感染细胞数逐渐增加,本实验设定MOI=20,并加入1000×Polybrene 10μL,48 h后荧光显微镜下观察转染效率。
1.3.5 筛选稳定转染重组慢病毒质粒的SW620细胞株:加入新霉素G418,使浓度达到800μg/mL,取14 d内完全杀死细胞的最低浓度作为筛选浓度,本实验采用700μg/mL进行前2周的筛选,2周后以50μg/mL维持筛选。
1.3.6 采用RT-PCR法检测干扰前后FAK的mRNA表达:①提取细胞总RNA;②RT反应:总RNA 1μg,RT Enzyne MIX 1μL,Primer MIX 1μL,5×RT buffer 4μL,ddH2O 20μL。混匀后,65 ℃ 5min;37 ℃ 20 min;98 ℃ 5 min。③PCR反应:FAK正义引物为5’-ACATTATTGGCCACTGTGGATGAG-3’,反义引物为5’-GGCCAGTTTCATCTTGTTGATGAG-3’,扩增片段为125 bp;内参β-actin 正义引物为5’-GATGCAG AAGGAGATCACTG-3’,反义引物为5’-GGGTGTAACGCAA CTAAGTC-3’,扩增片段为222 bp。先94 ℃变性3 min,随后94 ℃变性30 s,59 ℃退火30 s,72℃延伸60 s,共扩增35个循环,最后继续72 ℃延伸5 min,4 ℃放置,凝胶电泳并照相。
1.3.7 采用Western blot法检测干扰前后FAK的蛋白表达:①细胞总蛋白提取。②考马斯亮蓝染色法测定总蛋白浓度:样品的蛋白浓度=(样品的OD值-空白组的OD值)/(标准品的OD值-空白组的OD值)×5。③蛋白变性:100 ℃变性8 min,-20 ℃保存备用。④Western blot法的具体步骤:按照说明书首先SDS-PAGE垂直电泳,然后蛋白质转膜,最后行抗原-抗体反应及化学发光显色。
1.4 统计学处理方法 应用SPSS13.0统计软件进行统计学分析。数据用±s表示,样本均数间比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒包装及滴度测定 荧光倒置显微镜观察可见各组均表达大量的绿色荧光蛋白(green fluorescent protein,GFP),测定滴度为2.89×107 TU/mL,表明慢病毒包装成功(见图1)。

图1 转染293T细胞48 h荧光图(×100)
2.2 各组SW620细胞转染慢病毒后荧光图 相应的慢病毒转染入实验组与阴性对照组,各组均表达较多绿色荧光信号,表明慢病毒转染成功(见图2)。

图2 转染细胞表达绿色荧光图(×100)
2.3 稳定FAK沉默SW620细胞株的建立 shRNA重组慢病毒感染SW620细胞后使用浓度800μg/mL G418筛选14 d后实验组及阴性对照组细胞均恢复生长,形态转好,荧光较前亮,同时荧光率高(见图 3)。
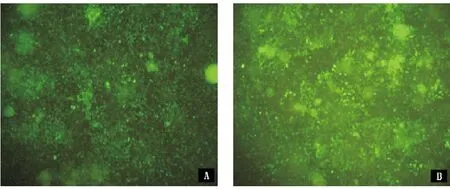
图3 稳定FAK沉默SW620细胞株筛选后荧光图(×100)
2.4 FAK RNAi载体的干扰效率检测
2.4.1 RT-PCR检测FAK mRNA表达:以β-actin作为内参照,各组细胞均能扩增出约125 bp的FAK基因片段,用Quantity-One定量分析软件进行条带灰度分析,测定出各样本FAK mRNA的相对表达量,结果显示各组FAK mRNA表达分别为:实验组为1.016±0.047、阴性对照组为3.971±0.127、未处理组为4.210±0.169,实验组中FAK mRNA表达较阴性对照组、未处理组明显降低,差异有统计学意义(P<0.05)。见图4。
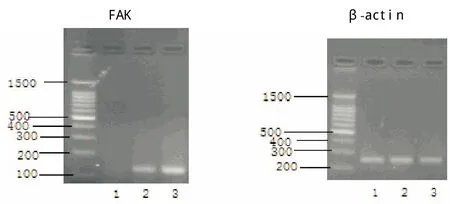
图4 RT-PCR实验结果
2.4.2 Western blot法检测FAK蛋白表达:以βactin作为内参照,用Quantity-One定量分析软件进行条带灰度分析,各组FAK蛋白表达分别为:实验组为0.374±0.022、阴性对照组为3.216±0.101、未处理组为2.926±0.142,实验组中FAK蛋白表达较阴性对照组、未处理组明显降低,差异有统计学意义(P<0.05)。见图5。

图5 Western blot法检测结果
3 讨论
大肠癌是胃肠道常见的恶性肿瘤,致死率高并容易发生转移,我国近年大肠癌的发病率呈逐年上升趋势,远处转移是大肠癌患者的主要死因。FAK在整合素介导的细胞迁移、细胞周期和细胞存活等功能中起关键作用[6-7],抑制FAK的表达可有效地降低肿瘤细胞的黏附和侵袭[8-10]。FAK有望成为新的肿瘤标志物、肿瘤治疗的重要靶点,为恶性肿瘤的综合诊治提供新的思路。
RNAi具有很强的抑制目的基因的作用,较反义寡核苷酸抑制目的基因的效果更强,被认为是继PCR后又一划时代的基因工程方法[11-13]。慢病毒载体可感染非分裂细胞、目的基因长期表达、免疫反应小,逐渐成为理想的基因转移载体[14]。本实验利用RNAi技术,使用慢病毒载体pLL3.7包装成慢病毒,并用改良的病毒感染方法成功感染SW620结肠癌细胞,通过慢病毒载体自带的新霉素抗性基因筛选单克隆细胞,并扩增培养,从而构建出稳定沉默FAK的结肠癌的细胞模型,是研究FAK在结肠癌细胞侵袭转移等作用机制中不可或缺的一步。为此,本研究就构建FAK的结肠癌细胞株进行探讨性研究,首先在选用结肠癌细胞株上,采用的是SW620,此细胞容易培养、生长速度适中,常规培养条件下能稳定传代,一般12~24 h分盘一次,另外SW620是从结肠癌患者转移淋巴结中获取并建立的,恶性程度较高,容易发生转移,是研究FAK在结肠癌转移中的合适的实验对象;另外采用的慢病毒载体pLL3.7为病毒载体,带有GFP及新霉素抗性基因,可以在体外甚至体内示踪细胞,方便细胞感染后筛选目的细胞,并且具有FAK基因沉默效率高、稳定等优点,通过Western blot法检测FAK蛋白表达下降90%以上,感染细胞通过多次的传代后FAK表达始终处于低水平,有效减少后期实验误差;病毒感染细胞是通过多次预实验,采用不同药物及剂量对照,最终选定Fermentas TurboFect转染试剂及最合适的剂量成功感染SW620细胞,通过观察发现感染率极高,感染后细胞生长无明显抑制。在细胞筛选过程中利用质粒中的neo抗性基因,使用不同剂量G418阶梯筛选预实验后,采用最合适的剂量对感染后细胞进行筛选,并选取荧光表达高的单克隆细胞株进行培养扩增,目的细胞能稳定传代扩增,从而最终构建了稳定沉默FAK的结肠癌细胞株;本细胞株的构建为下一步体外研究FAK基因在结肠癌细胞中的作用及相关机制提供前提,并为进一步将FAK沉默的肿瘤细胞移植至裸鼠体内的实验研究奠定基础。
[1]孙晓杰, 黄常志. PI3K-Akt信号通路与肿瘤[J]. 世界华人消化杂志, 2006, 14(3): 306-311.
[2]倪孔海, 翁志梁, 王思齐, 等. 粘着斑激酶在人良性前列腺增生组织中的表达及其意义[J]. 温州医学院学报, 2004, 34(4): 262-264.
[3]Seo CH, Jeong H, Feng Y, et al. Micropit surfaces designed for accelerating osteogenic differentiation of murine mesenchymal stem cells via enhancing focal adhesion and actin polymerization[J]. Biomaterials, 2013, 12 (35): 2245-2252.
[4]Baotran Ho, Gretchen Olson, Sheila Figel, et al. Nanog Increases Focal Adhesion Kinase (FAK) Promoter Activity and Expression and Directly Binds to FAK Protein to Be Phosphorylated[J]. J Biol Chem, 2012, 287(22): 18656-18673.
[5]袁周, 郑起, 黄新余, 等. 抑制黏着斑激酶表达对人肝癌细胞转移潜能的作用[J]. 中华外科杂志, 2007, 45(19): 1350-1353.
[6]Kobayashi-Sakamoto M, Isogai E, Holen I, et al. Osteoprotegerin induces cytoskeletal reorganization and activates FAK, Src, and ERK signaling in endothelial cells[J]. Eur J Haematol, 2010, 6(85): 26-35.
[7]Mitra SK, Hanson DA, Schlaepfer DD, et al. Focal adhesion kinase: in command and control of cell motility[J]. Nat Rev Mol Cell Biol, 2005, 6(1): 56-68.
[8]Serrels A, Canel M, Brunton VG, et al. Src/FAK-mediated regulation of E-cadherin as a mechanism for controlling collective cell movement: insights from in vivo imaging[J].Cell Adh Migr, 2011, 5(4): 360-365.
[9]Cabodi S, del Pilar Camacho-Leal M, Di Stefano P, et al.Integrin signalling adaptors: not only figurants in the cancer story[J]. Nat Rev Cancer, 2010, 10(12): 858-870.
[10]Figel S, Gelman I. Focal adhesion kinase controls prostate cancer progression via intrinsic kinase and scaffolding functions[J]. Anticancer Agents Med Chem, 2011, 11(7):607-616.
[11]Maliyekkel A, Davis BM, Roninson IB. Cell cycle arrest drastically extends the duration of gene silencing after transient expression of short hairpin RNA[J]. Cell Cycle, 2006,5(20): 2390-2395.
[12]Cheng TL, Chang WT. Construction of simple and efficient DNA vector-based short hairpin RNA expression systems for specific gene silencing in mammalian cells[J]. Methods Mol Biol, 2007, 408: 223-241.
[13]黄坊, 赵颖海. RNAi干扰技术在鼻咽癌研究中的应用进展[J]. 肿瘤防治研究, 2009, 36(1): 73-75.
[14]Yang H, He S, Quan Z, et al. Small Interfering RNA-mediated Caveolin-1 Knockout on Plasminogen Activator Inhibitor-1 Expression in Insulin-stimulated Human Vascular Endothelial Cells[J]. Acta Biochim Biophys Sin, 2007, 39(3): 224-233.

