α放射核素靶向治疗研究进展
李明起,潘俊男,段玉春,邓启民,3,王邦金
(1.成都云克药业有限责任公司,四川 成都 610041; 2.成都市放射性药物工程技术研究中心,四川 成都 610041; 3.四川大学 生物治疗国家重点实验室,四川 成都 610041)
随着现代医学对疾病治疗理念的不断更新,肿瘤治疗向靶向治疗发展。除了靶向化疗药物外,放射性核素靶向治疗愈来愈得到肿瘤临床医学的重视。适合于肿瘤靶向治疗的核素主要有β放射核素和α放射核素,因β放射核素比α放射核素更易获得而研究较多,如90Y。但β射线是低线性能量转换(LET)射线,对细胞的杀伤力较弱[1-2];β射线在生物组织中的射程为1 mm~10 mm,对于微小病灶和非实体瘤,因病灶或细胞的直径远小于β射线的射程,β粒子的部分能量会释放到周围正常组织而不是在病灶或肿瘤细胞内,在杀死肿瘤细胞的同时会带来较大的毒副作用[3]。Larsen等[4]通过放射剂量测定法表明,α粒子放射体作为亲骨物质比β-粒子放射体优势明显。即当放射源位于骨表面时,较短射程的α放射体引起较少的骨髓辐射。在该研究中将两个α放射二磷酸酯骨探查剂与两个具有相似的化学结构和骨亲和力的β放射化合物相比较, 结果表明,α放射体与β放射体相比骨表面与骨髓剂量比高3倍,α放射骨探查剂比β放射化合物更具有优势,因为辐射剂量能够更强的浓缩至骨表面(见图1)。与β放射核素相比,α放射核素射线能量高(25 keV/μm~230 keV/μm)、射程短(40 μm~85 μm)、对肿瘤细胞杀伤力强,而对正常组织影响小[5]。正因为α放射核素具有以上优势,近年来,已经成为放射性药物研究热点。2013年,第1个α放射核素类药物Xofigo(223RaCl2注射液)已经在美国和欧盟上市,在临床上具有较好的疗效,从而进一步激发了科学家对其他α放射核素类药物的研究兴趣。
α放射核素的种类较多,其都有各自的优缺点。多数α放射核素的纯化较困难,大部分α放射核素的半衰期(过短或过长)都不适合用于医学用途。目前报道适合于治疗用α放射核素主要有223Ra、225Ac、213Bi、211At、212Bi、149Tb、227Th[7]等,其中223RaCl2已于2013年5月被FDA批准用于治疗伴骨转移而无内脏转移的去势抵抗性前列腺癌,几种适合治疗的α放射核素性质列于表1。
本文主要介绍了以上核素的来源制备及用于肿瘤靶向治疗的最新进展,对存在的问题、现状及临床应用前景进行了简要的探讨。
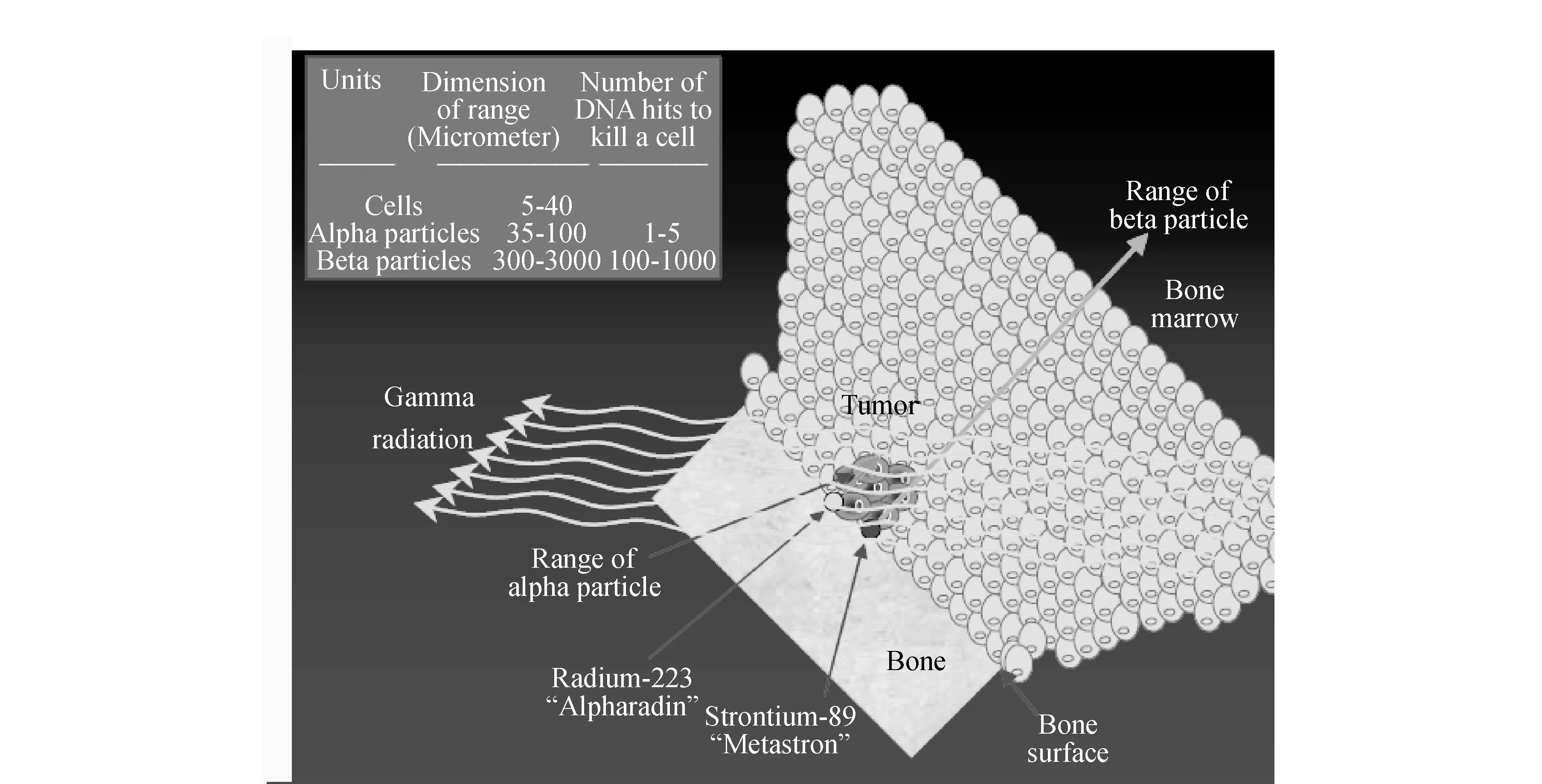
图1 α粒子放射体与β粒子放射体治疗作用示意图[6]Fig.1 The therapeutic effect of α-particle emitters and β-particle emitters
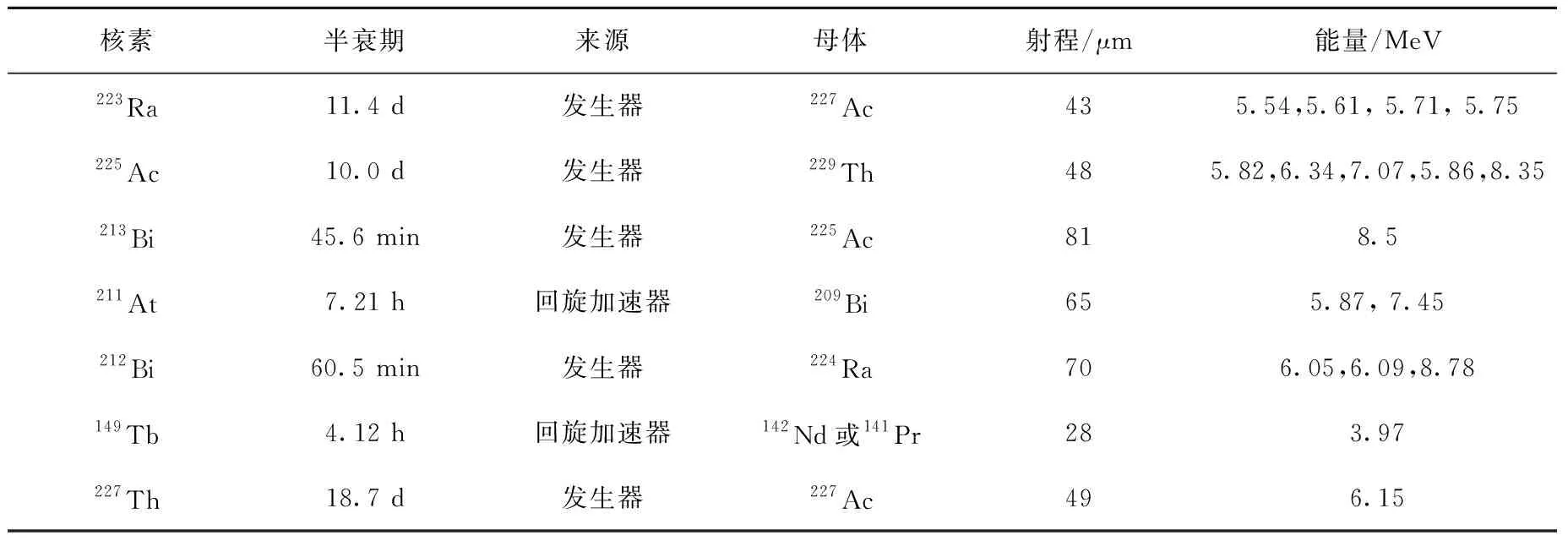
核素半衰期来源母体射程/μm能量/MeV223Ra11.4 d发生器227Ac435.54,5.61, 5.71, 5.75 225Ac10.0 d发生器229Th485.82,6.34,7.07,5.86,8.35213Bi45.6 min发生器225Ac818.5211At7.21 h回旋加速器209Bi655.87, 7.45 212Bi60.5 min发生器224Ra706.05,6.09,8.78149Tb4.12 h回旋加速器142Nd或141Pr283.97227Th18.7 d发生器227Ac496.15
1 几种重要α放射性核素靶向治疗进展
1.1 223Ra靶向治疗
223Ra(T1/2=11.4 d)为天然235U衰变系列中的成员,其半衰期相对较长,适合于运输及治疗。223Ra通过6阶段衰减为短寿命子体,最后衰变为稳定207Pb,主要发射α 射线,同时还有不同能量和比例的β射线和γ射线。223Ra的制备以227Ac为源,227Ac发生β衰变为227Th,227Th发生α衰变为223Ra(见图2)。227Ac主要由中子辐照226Ra来制备,通过反应226Ra(n,γ)227Ra,生成的227Ra发生β衰变为227Ac。
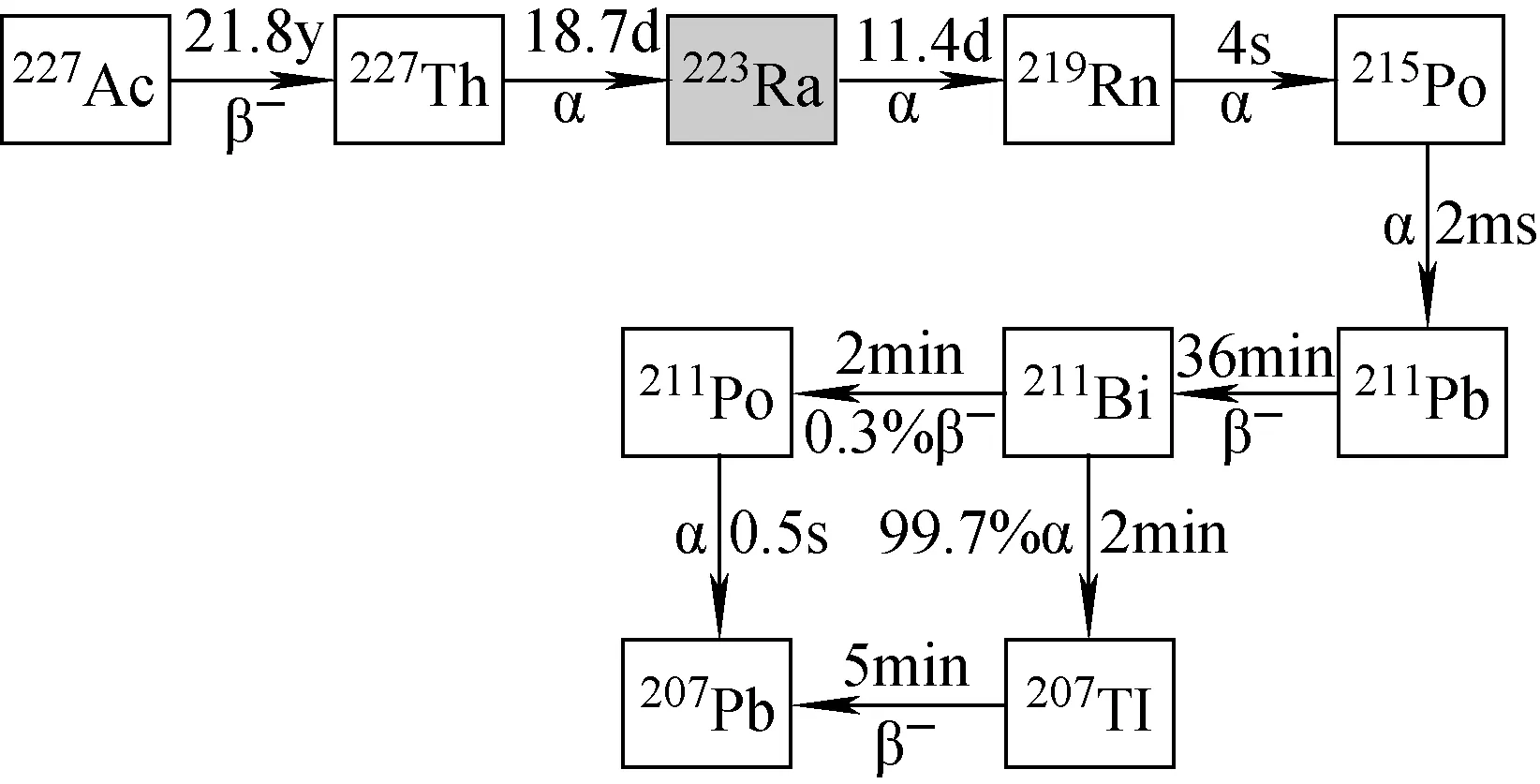
图2 223Ra生成及衰变链Fig.2 The generation and decay chain of 223Ra
223Ra与钙同族,可以模拟钙并且在骨更新增多的部位,例如骨转移部位,与骨矿物质羟基磷灰石形成复合物。223Ra发射的高线性能量转移射线(80 keV/μm)可引起邻近细胞的双链DNA断裂,进而对骨转移产生抗肿瘤作用。223Ra发射α粒子的射程短(不到10个细胞直径),能够最大限度地减少对周围正常组织的伤害[8]。与其他α核素相比,223Ra具有如下优势:(1)223Ra具有较长的半衰期,在发生衰变之前大部分的223Ra将从软组织中去除可降低骨与软组织的吸收剂量比。(2) 较长的半衰期可使223Ra与骨表面结合牢固,大大降低其和子体的易位,降低对正常组织的毒性。(3) 来自223Ra的较短半衰期子体219Rn(T1/2=4 s),可以使来自223Ra的子体核素具有较少的易位。因此,223Ra是一种具有较低毒性的α放射治疗核素[9]。
223Ra是第一个被批准用于临床治疗的α靶向治疗核素,223RaCl2注射液于2013年5月和11月,分别由美国食品和药物管理局(FDA)和欧盟药品管理局(EMA)批准上市,用于治疗伴有骨转移症状并无内脏转移的去势抵抗性前列腺癌(CRPC),商品名为Xofigo。
223RaCl2的I 期临床试验结果显示,在最高剂量下也未见明显的毒副作用[10]。而在以安慰剂作为对照组的II期临床试验中,研究者发现CRPC骨转移患者对223RaCl2的耐受性良好,未见明显的血液毒副反应,并且在223RaCl2治疗组中CRPC患者的血BAP 及PSA 下降明显,同时中位OS ( 65周vs 46周) 及2年生存率( 30% vs 13% ) 明显延长[11]。
Ⅲ期随机对照临床试验,纳入人群为去势抵抗的前列腺癌患者,有两处或以上的骨转移,一组615例, 用223RaCl2治疗,一组307例,用安慰剂治疗,比较这两组的疗效。223RaCl2组的中位OS是14.9 个月,安慰剂组是11.3 个月。使用223RaCl2患者的副作用很小。数据显示[12],223RaCl2与安慰剂相比,可以减低30.5%的死亡率,骨骼并发症的发生推迟了6个月,同时改善了患者的生活质量。以上结果提示,223RaCl2治疗有可能成为去势抵抗的前列腺癌骨转移患者的一个新的标准治疗方案。
1.2 225Ac靶向治疗
225Ac(T1/2=10 d)由长寿命的229Th(T1/2=7 430 y)衰变而来(见图3)。225Ac在衰变过程中产生三种短半衰期α子体核素,分别为221Fr(T1/2=4.9 min,Eα=6.458 MeV)、217At(T1/2=32.3 ms,Eα=7.202 MeV)、213Bi(T1/2=45.59 min,Eα=8.537 MeV)。因此225Ac也可以作为213Bi的母体核素吸附到树脂上制成225Ac/213Bi发生器[13]。225Ac价格非常昂贵,来源有限,只能维持少量的临床研究。美国橡树岭国家实验室每两个月能提供180 MBq~2 200 MBq的225Ac,主要是从233U衰变的229Th中提取225Ac,由于229Th资源有限,从而限制了225Ac的产量[14]。德国Karlsrhue超铀元素研究所和俄罗斯物理和动力工程研究院可生产225Ac,生产方法与美国类似,也是从229Th中提取225Ac[14]。

图3 225Ac和213Bi生成及衰变链Fig.3 The generation and decay chain of 225Ac and 213Bi
225Ac每次衰变可释放四个α粒子和两个β粒子,因而较其他α核素的细胞毒性更强。但由于225Ac在体内并不能主动靶向作用于某个组织,因此需要选用合适的双功能偶联剂将其与合适的载体稳定地连接,并将225Ac标记物准确地输送至靶细胞。但释放的α发射子体引起的肾脏辐射毒性是一个严峻的问题[15]。225Ac在体内的毒性很强,静脉注射225Ac后,其主要沉积于肝脏、骨、肾和心脏,清除速率非常慢,注射6个月后,体内仍残留50%的剂量。为了降低225Ac在体内的毒性,需要选择合适的偶联剂,增加体内清除速率。最早应用的偶联剂有EDTA、DTPA和PEPA,均可降低225Ac在各器官内的沉积,但器官毒性水平仍然很高,特别是肝脏。近年来合成出一类新的偶联剂HEHA,既可与225Ac稳定结合,且体内清除速率很快,各器官的沉积较低[16]。
McDevitt等[17]的体外实验表明,225Ac能以比213Bi低1 000倍的剂量杀死多种癌细胞。HuM195为人源化抗CD-33单抗林妥珠单抗,能靶向于骨髓白血病细胞,具有一定的抗急性骨髓白血病(AML)活性。Joseph等[18]将225Ac标记的单抗HuM195药物用于急性骨髓白血病的Ⅰ期临床研究,以评价药物对人体的药效、剂量及其安全性等。18位患者参与研究,评价了18.5 kBq/kg(n=3)、37 kBq/kg(n=4)、74 kBq/kg(n=3)、111 kBq/kg(n=6)和148 kBq/kg(n=2)几个225Ac剂量水平,未见急性毒性反应,在1位剂量为111 kBq/kg和2位剂量为148 kBq/kg的患者中观察到剂量限制毒性(骨髓抑制持续35 d以上;脓毒病死亡);骨髓外毒性仅限于短暂的肝功能异常;平均5个月的随访未发现放射性肾炎;通过γ计数仪分析了血浆药代动力学,发现呈两相代谢动力学,α粒子和β粒子的血浆平均半衰期分别为1.9 h和35 h。16位患者中有10位的外周血癌细胞被消除,15位患者中有10位的骨髓癌细胞减少33%以上,由以上结果可看出,225Ac标记的单抗HuM195用于人体的安全剂量为111 kBq/kg,所有剂量水平均有抗白血病的活性。
F3是一种血管肿瘤归巢肽,连接在肿瘤内皮细胞表面的核仁上,可以内化进入细胞核,将F3与225Ac稳定结合,从而实现靶向传递225Ac进入肿瘤细胞。Markus等[19]进行了225Ac-DOTA-F3对于腹膜转移癌的体内外研究,体外研究显示225Ac-DOTA- F3的ID50为1.8 μCi/L,选择6×50 nCi的225Ac-DOTA-F3进行体内实验,结果显示,225Ac-DOTA-F3能控制肿瘤生长,与对照组相比,可增加患腹膜转移癌小鼠的存活率,副作用主要表现为部分肾脏纤维化。
Franziska等[20]研究了225Ac标记生长抑制素受体对大鼠胰腺腺泡癌细胞(AR42J)的作用,结果显示,225Ac-DOTATOC能引起肿瘤细胞DNA双键断裂,导致细胞死亡。
1.3 213Bi靶向治疗
213Bi(T1/2=45.6 min)为225Ac衰变子体(见图3),其α射线的能量为8.5 MeV,是所有可用于放射治疗的α核素中半衰期最短的核素。另外,由于213Bi衰变时发射出440 keV的γ射线(26.1%),因此可在治疗过程中同时进行显像,有利于研究剂量和生物分布情况[21]。尽管213Bi的半衰期很短,但可通过淋洗225Ac/213Bi发生器而获得213Bi,因此截止目前,213Bi仍是临床研究应用最多的α靶向治疗核素。213Bi主要由225Ac/213Bi发生器制备[14]。
Rosenblat 等[22]完成了213Bi标记HuM195对急性骨髓白血病的Ⅱ期临床研究,以评价药物对人体的最大耐受剂量和治疗白血病的效果。31位患者参与了研究,首先给予5 d阿糖胞苷(200 mg/m2/d),再给予213Bi-HuM195,剂量范围为18.5 MBq/kg~46.25 MBq/kg。结果显示,213Bi-HuM195的最大耐受剂量为37 MBq/kg,5位患者可见短暂的肝功能异常,2位剂量为37 MBq/kg的患者发生了与治疗相关的死亡,所有剂量均可显著降低骨髓萎缩,平均疗效持续时间为6个月。生物分布和药理学研究显示,213Bi-HuM195可在CD33位点达到饱和状态。以上结果显示,阿糖胞苷和213Bi-HuM195的联合给药是可行的,并且能减轻急性骨髓白血病患者的病情。
神经肽P物质是神经源性炎症反应中的重要介质,主要由初级感觉神经末梢释放,靶向于多形性胶质瘤中过度表达的神经激肽1型(NK-1)受体,Morgenstern 等[23]报道了213Bi-DOTA-P物质用于复发性多形性神经胶质细胞瘤的首次临床研究,17位患者参与研究,给予1~4次213Bi-DOTA- P物质,每次间隔2个月,剂量为50 mCi,结果显示,接受4次(200 mCi)的患者耐受性很好,仅出现轻微短暂的副反应,显像结果显示,213Bi-DOTA-P物质能长时间停留在肿瘤部位。在有效的16位患者中,5位患者死亡(4人死于疾病进展,1人死于非治疗相关的原因),2位患者疾病进展,9位患者疾病稳定或肿瘤减小。综上,213Bi-DOTA- P物质用于多形性神经胶质细胞瘤的治疗是安全的,毒副反应小。接受4×50 mCi剂量的患者疾病能很好地被控制,213Bi-DOTA-P物质有可能成为一种新的复发性、多形性神经胶质细胞瘤的α靶向治疗药物。
Bryan等[24]将人类的胰腺癌细胞MiaPaCa-2异种移植至裸鼠中,研究213Bi标记嵌合抗体chTNT3联合顺铂和吉西他滨治疗实验胰腺癌的效果,分别对比了单独给予700 μCi213Bi-chTNT3、化疗药物治疗3 d后再给予700 μCi213Bi-chTNT3、单独给予chTNT3和化疗药物。结果显示,213Bi-chTNT3相比化疗药物,能显著减缓MiaPaCa-2肿瘤的生长,而且毒副作用很小。
1.4 211At靶向治疗
211At(T1/2=7.2 h)衰变释放出近100%的α射线,衰变为稳定核素207Bi(见图4),射线平均能量6.8 MeV,其LET为(97~99) keV/μm;在软组织中的射程约为6~8个细胞的范围(55 μm~88 μm),就放射治疗而言,是除硼中子俘获治疗外仅有的高传能线密度体系。衰变过程同时释放γ射线,有利于显像和剂量标准研究。目前该核素只能通过回旋加速器生产,来源有限使其不能被广泛应用于临床研究[25]。211At的生产可按照反应209Bi(α,2n)211At,在回旋加速器中用加速的氦离子辐照209Bi而产生211At。美国有三个机构可提供211At,分别是Duke大学、The National Institutes of Health PET Center和华盛顿大学;法国的Nantes建起了一个70 MeV的回旋加速器用于生产211At[14]。国内四川大学原子核科学研究所也进行了基于CS-30回旋加速器制备211At的研制和生产[26]。

图4211At生成及衰变链
Fig.4 The generation and decay chain of211At
Albertsson等[27]报道了211At标记鼠源化单抗MX35治疗复发性卵巢癌的I期临床研究,结果表明,211At-MX35对人体毒副反应小,中期分析时,没有复发病例,所有患者均存活。目前准备开展211At标记人源化单抗MX35治疗晚期卵巢癌的Ⅱ/Ⅲ期临床研究。Thorsten等[28]的研究结果表明,211At标记抗CD-33单抗对白血病细胞HL-60和K-562具有很强的细胞毒性,能杀死癌细胞。刘宁等[29]对核素211At进行了系统研究,合成了一系列的211At标记化合物(SPC,ATE和TCP)双功能偶联剂,对其分别进行了211At标记偶联牛血清白蛋白(BSA)的研究,结果表明,三种不同偶联剂制得的标记物在体内外都具有较高的稳定性。其研究小组利用骨骼体系对胺基膦酸类化合物具有高亲和性的特点,通过SPC双功能偶联剂进行了211At的合成及其生物学性能评价,并与99Tcm-MDP进行了比较。结果表明,211At标记化合物和99Tcm-MDP都对小鼠骨骼具有明显的亲和性。211At标记化合物在小鼠骨骼的摄取都远高于游离At在骨骼的摄取,6 h时即可达23.7% ID/g。结果提示,将211At标记的胺基膦酸类化合物用于骨肿瘤治疗是可行的。此外本课题组还进行了211At标记胶体、胰岛素和单克隆抗体等化合物的标记研究,已有的研究结果[30-32]证实,211At是一个有应用前景的理想的靶向治疗核素。
1.5 212Bi靶向治疗
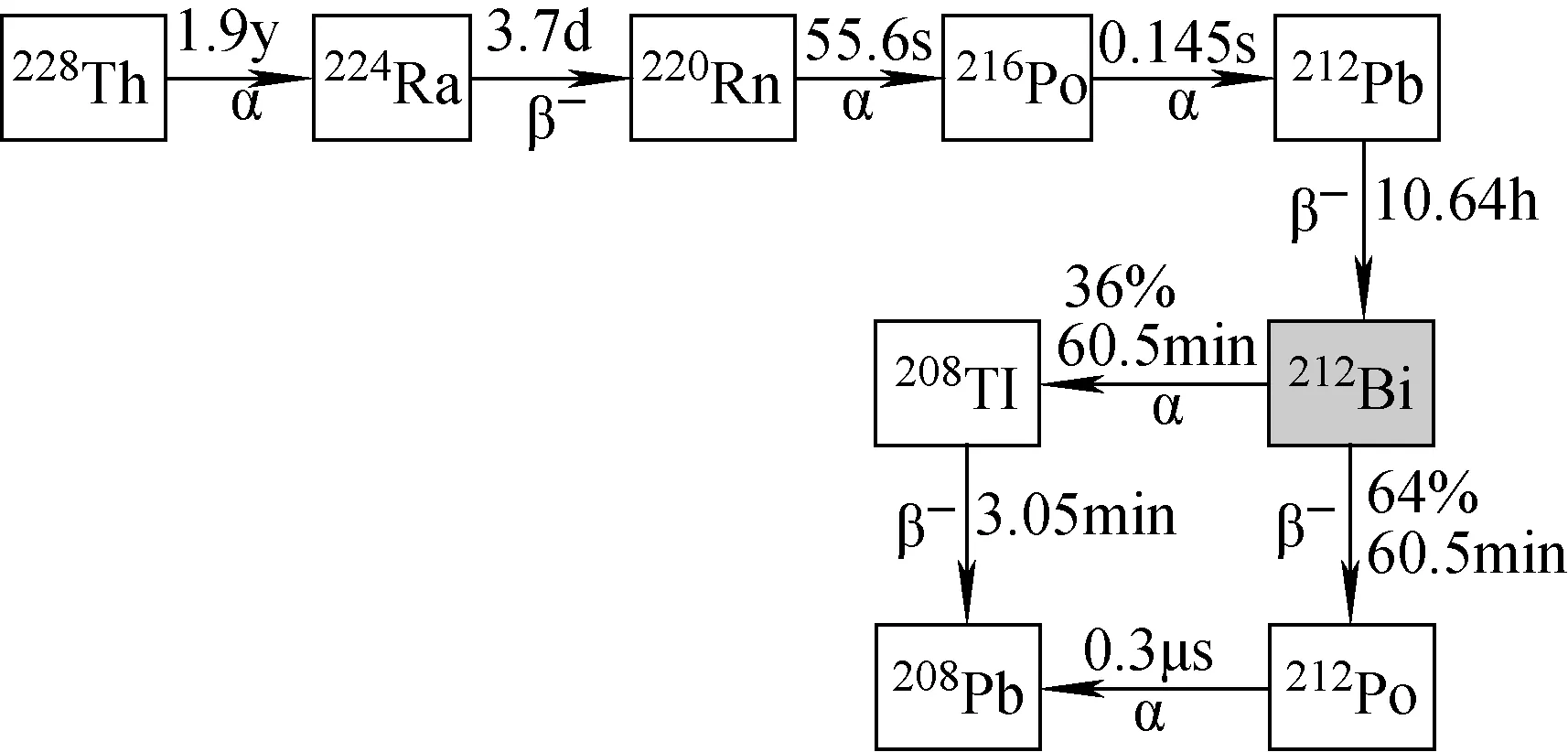
图5 212Bi生成及衰变链Fig.5 The generation and decay chain of 212Bi
212Bi是天然232Th衰变链中的成员(见图5),其半衰期(T1/2=60 min)较短,212Bi一般可通过224Ra/212Pb/212Bi发生器制备,从224Ra中提取出212Pb(T1/2=10.6 h)与螯合剂结合进入体内,在体内发生β衰变为212Bi。212Bi有64%发生β衰变为212Po,212Po(T1/2=0.29 ms)会发生α衰变为稳定的208Pb;212Bi有36%发生α衰变为208Ti,208Ti(T1/2=3 min)再发生β衰变为稳定的208Pb。208Ti的衰变含高能量(2.6 Mev)的γ射线,因此,患者必须采用特殊的辐射防护程序[33]。212Bi主要由224Ra/212Pb/212Bi发生器制备,224Ra可从232U中提取,也可由经反应226Ra(2n,γ)228Ra,228Ra发生β衰变为228Ac,228Ac发生β衰变生成的228Th中提取[14]。
212Bi放射性治疗药物的研究在20世纪80年代以后引起国外学者的重视,国内也对212Pb/212Bi 标记化合物进行了初步探索[34]。标记212Bi化合物已用于临床前研究中的小鼠淋巴瘤[35]、黑色素瘤[36]、卵巢癌[37]、弥散性腹膜转移[38]和骨转移[39]等疾病的研究。Kozak 等[40]用DTPA作为双功能配体,将双212Bi对抗体进行了标记,研究发现其可特异性识别人白细胞介素-2(IL-2)受体。Macklis 等[41]将212Bi标记单克隆抗体用于小鼠肿瘤细胞株(Thy1.2+EL-4)的培养,研究显示,标记药物能显著抑制淋巴瘤细胞的增殖,其抑制率可达98%。经3H胸腺嘧啶脱氧核苷渗入分析表明,此时每个靶细胞吸收了3个212Bi。 Brechbiel 和 Waldmann[42]将212Pb/212Bi与抗HER2/neu单克隆抗体结合,其能够彻底杀灭小鼠体内的乳腺癌细胞。HER2/neu是一种受体蛋白,其过度表达与乳腺癌预后差相关,结果表明,212Bi抗体的应用是预防和治疗乳腺癌转移的一个策略。Milenic等[38]将212Pb/212Bi标记的曲妥珠单抗用于治疗小鼠弥散性腹膜转移疾病。将212Pb/212Bi与多肽标记,其对治疗转移性黑素瘤具有较好的效果[36],以上研究表明,α放射性核素和其他的放射性核素在治疗人类肿瘤转移中具有重要作用。
1.6 149Tb靶向治疗
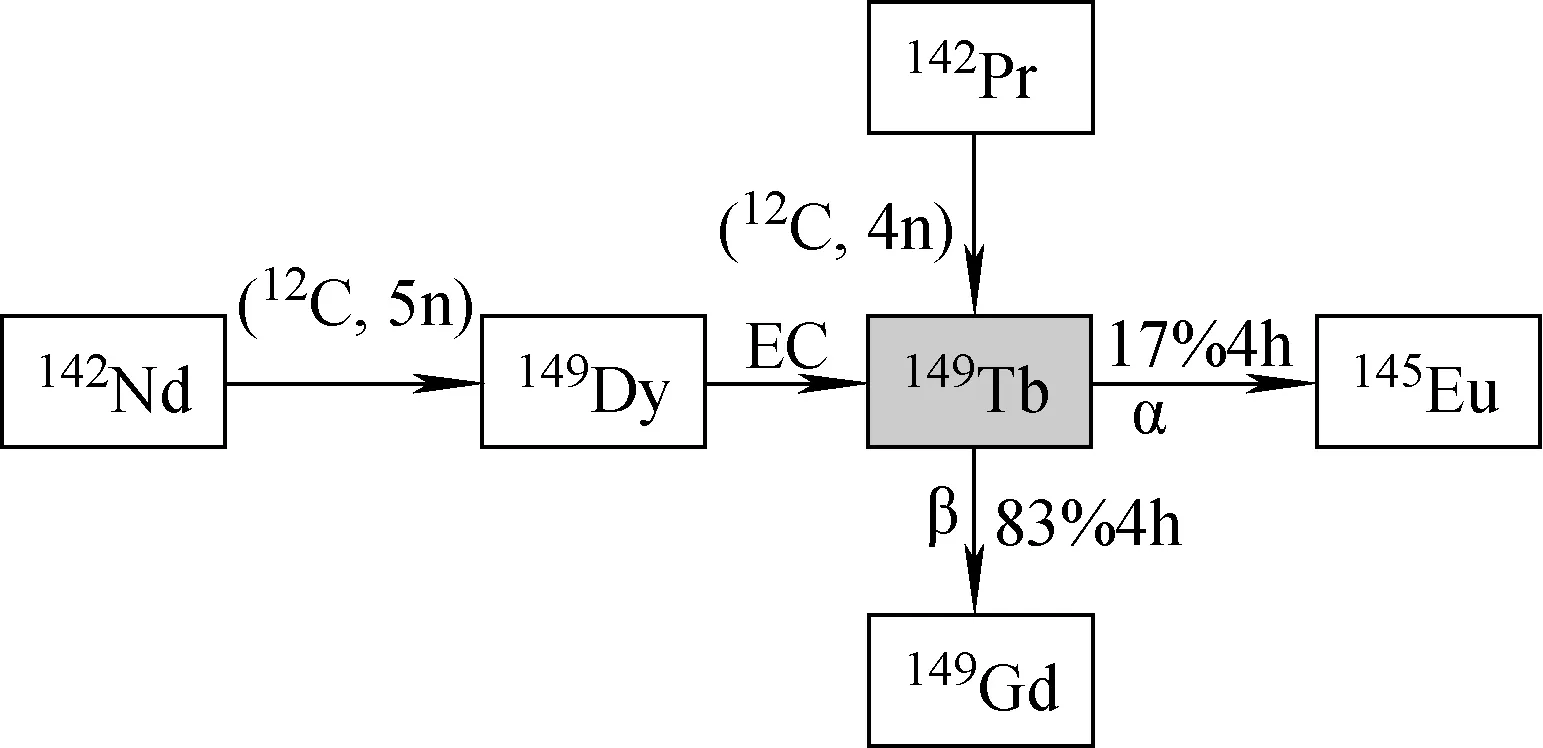
图6 149Tb生成及衰变链Fig.6 The generation and decay chain of 149Tb
149Tb具有较短的半衰期(T1/2=4 h),其衰变时,17%发生α衰变,能量为4 MeV,4%发生β衰变,79%发生电子俘获(见图6)。低活度(1.48 MBq)的149Tb可在串列加速器上利用142Nd(12C,5n)149Dy→149Tb核反应制得,更大量(1 GBq)的149Tb 则需要利用CERN 的散裂源[7]。由于149Tb的半衰期较短,其使用的地点必须要在其生产加速器的附近。目前对该同位素进行的相关研究主要位于塞尔维亚的贝尔格莱德、澳大利亚的堪培拉国立大学的串列加速器和瑞士日内瓦的CERN质子加速器,目前仍没有149Tb商业供应商[14]。
149Tb 衰变放出α 粒子(3.97 MeV)和γ 射线(165 keV)。与213Bi相同,在治疗过程中可同时进行显像。因此149Tb具有潜在的用于癌症放射免疫治疗的价值[43]。Abbas 等[44]用对急性骨髓白血病细胞有特异性的单抗WM-53进行了149Tb标记,其标记率可达90%~95%。其体外结合与杀伤细胞实验表明,标记后免疫反应与标记前一致。进一步的研究表明,149Tb能阻止细胞的DNA 合成,且即使剂量仅为74 kBq~111 kBq 时仍能选择性地杀死肿瘤细胞。Allen 等[3]的研究表明,149Tb 对病变前期的癌细胞的治疗具有很大的潜力。对骨髓内白血病细胞的清除,其效率是225Ac 的 5 倍以上,其比211At 或212Bi 的效率高一个数量级。利比亚原子核研究中心的科学家评估了149Tb和213Bi对人成纤维细胞的放射生物学效应,通过评估DNA损伤和修复正确的概率来进行评估。结果表明,149Tb比213Bi具有更高的治疗潜力[45]。149Tb 的α粒子比213Bi的α粒子具有更高的概率来诱导细胞凋亡。因此149Tb 是对有针对性的肿瘤放射治疗更有用。但因其来源比较困难,目前有关149Tb研究的报道并不多见。
1.7 227Th靶向治疗
227Th为227Ac衰变链中的第一个子体,半衰期(T1/2=18.7 d)适中,发生α衰变为223Ra(见图2)。作为223Ra的母体核素,其制备同223Ra类似。227Th的制备也是以227Ac为源,227Ac发生β衰变为227Th。
由于223Ra具有非常适合人体治疗的核素性质,因此最近几年其母体核素227Th已经被考虑用于活性剂,或作为在体内产生了223Ra的体内发生器,用于肿瘤放射免疫治疗。Washiyama等[46]研究了Th元素为正三价时,与螯合剂(DTPA、EDTMP)络合用于乳腺癌和前列腺癌的骨转移的放射免疫治疗。Dahle 等[47]将227Th由DOTA络合连接到利妥昔单抗,并已被建议作为用于治疗非霍奇金淋巴瘤的新放射免疫疗法。Larsen 等[48]研究了227Th的体内发生器,将227Th通过与双功能螯合剂络合,再与抗体、生长因子、多肽及激素类似物等靶向分子连接,用于治疗任何形式的癌症以及风湿病,尤其对于皮肤癌、前列腺癌、宫颈癌、乳腺癌和炎性疾病具有较好的治疗效果。但是由于227Th在体内衰变要获得治疗效果所需的剂量极易引起其他器官高毒性反应,甚至有可能致死,其用于人体时所需的剂量大小很难控制,因此限制了其应用。
2 展望
α放射核素经过几十年的研究,已经证实其在肿瘤治疗领域拥有独特地位。目前已有拜尔公司的Xofigo(223RaCl2注射液)于2013在美国和欧盟上市,可以看出α放射核素药物具有极好的市场价值。目前α放射核素治疗研究呈现如下趋势:(1) α放射核素来源呈现多途径化,一种核素可以来源于自然衰变提取、核反应或者发生器等多种途径,这为α放射核素的制备和应用提供了方便。(2) α放射核素治疗靶向性进一步增强,由于α放射核素的性质决定了其治疗时必须高靶向性,因此科学家在靶向性方面进行了多方面研究,如具有靶向性的新型螯合剂或化合物,可携带α放射核素进入到细胞核,使核素内化,可以更强的杀灭肿瘤细胞,进一步降低毒副作用;开发出了多种α放射核素的体内发生器,可使α放射核素到达靶向组织,特异进行衰变治疗,扩大了α放射核素的适应症。(3) α放射核素的肿瘤治疗呈现多样化,前期研究主要集中于血液和骨系统肿瘤,最近随着具有靶向性的螯合剂或化合物的深入研究,α放射核素已经用于黑色素瘤、乳腺癌、胰腺癌、卵巢癌等其他实体瘤的治疗,其中部分研究已经进入临床评价。
α放射核素治疗药物近年来虽然取得了很大进展,但是还存在诸多问题,包括:(1) α放射核素制备较困难,提纯难度较大,导致其价格昂贵,我国缺乏生产医学用途α放射核素的生产单位和机构,因此国家应大力提倡设施建设和资金投入;(2) 进一步深入α核素药物的剂型研究应包括α核素的标记化合物、螯合剂和载体等的研究,进一步提高α核素药物在体内的靶向性和稳定性,提高安全性。(3) 制定α核素药物的使用和剂量规范,指导合理用药,调高疗效,降低副作用,使α核素药物真正成为低毒高效的潜力药物。国内α放射核素研究极少,因此在我国有很大的发展和研究空间。
参考文献:
[1] Hoefnagel C A. Radionuclide therapy of tumors: general aspects and considerations[J]. Int J Biol Markers, 1993, 8(3): 172-179.
[2] Breitz H B. Dosimetric considerations for radioimmunotherapy[J]. Diagn Oncol, 1993, 3(4): 209-215.
[3] Allen B J, Blagojevic N. α and β emitting radiolanthanides in targeted cancer therapy: the potential role of149Tb[J]. Nucl Med Commun, 1996, 17(1): 40-47.
[4] Larsen R H, Murud K M, Akabani G, et al. Has high in vivo stability and bone accumulation of211At-and131I-labeled bisphosphonates[J]. Nuclear Medicine ,1999, 40(7): 1 197-1 203.
[5] Sgouros G. Alpha-particles for targeted therapy[J]. Adv Drug Deliv Rev, 2008, 60(12): 1 402-1 406.
[6] Larsen R H, Bruland ØS. Targeting of skeletal metastases by the alpha-emitter Radium-223[C/OL]. http:∥www.bruland.info/PDF/195-202.pdf.
[7] 昝亮彪,刘宁,杨远友,等. α核素用于肿瘤靶向治疗研究的进展[J]. 核技术,2006,29(4):279-285.
Zan Liangbiao, Liu Ning, Yang Youyuan, et al. Progress of the targeted tumor therapy with α-emitting nuclides[J] . Nuclear Techniques, 2006, 29(4): 279-285(in Chinese).
[8] Parker C, Nilsson S, Heinrich D, et al. Alpha emitter radium-223 and survival in metastatic prostate cancer[J]. N Engl J Med, 2013, 369(3): 213-223.
[9] Larsen R H, Henriksen G. Preparation of radium-223, physically accepted preparation and kit:Norway, CA2358498A1[P]. 1999-12-17.
[10] Nilsson S, Larsen R H, Fossa S D, et al. First clinical experience with alpha-emitting radium-223 in the treatment of skeletal metastase[J]. Clin Cancer Res, 2005, 11(12): 4 451-4 459.
[11] Nilsson S, Franzen L, Parker C, et al. Bone-targeted radium-223 in symptomatic,hormone-refractory prostate cancer: a randomised, multicentre, placebo-controlled phase II study[J]. Lancet Oncol, 2007, 8(7): 587-594.
[12] Goyal J, Antonarakis E S. Bone-targeting radiopharmaceuticals for the treatment of prostate caner with bone metastases[J]. Cancer lett, 2012, 323(2): 135-146.
[13] Geerlings M W, Kaspersen F M, Apostolidis C, et al. The feasibility of225Ac as a source of alpha-particles in radioimmunotherapy[J]. Nucl Med Comm, 1993, 14(2): 121-125.
[14] Darrell R F. Commercial Availability of Alpha-Emitting Radionuclides for Medicine[J]. Current Radiopharmaceuticals, 2008, 1(3): 127-134.
[15] Chappell L L, Deal K A, Dadachova E, et al. Synthesis conjugation and radiolabeling of a novel bifunctional chelating agent for225Ac radioimmunotherapy applications[J]. Bioconjug Chem, 2000, 11(4): 510-519.
[16] Taylor D M. The metabolism of actinium in the rat[J]. Health Phys, 1970, 19(3): 411-418.
[17] McDevitt M R, Dangshe M, Lawrence TL, et al. Tumor Therapy with Targeted Atomic Nanog-enerators[J]. Science, 2001,294(5 546): 1 537-1 540.
[18] Jurcic J G, Rosenblat T L, McDevitt M R, et al. Alpha-Particle Immunotherapy for Acute Myeloid Leukemia (AML)with Bismuth-213 (213Bi) and Actinium-225 (225Ac)[C]. 8thInternational Symposium on Targeted Alpha Therapy, 2013, June 4-6: 14.
[19] Markus E, Alfred M, Frank B, et al. Therapeutic efficacy and toxicity of225Ac labelled tumour-homing peptides in treatment of peritoneal carcinomatosis[C]∥7thSymposium on Targeted Alpha Therapy, July 17-19, 2011. [s.n.], 2011: 21.
[20] Franziska G, Jorg F, Stephan M, et al. DNA double strand break assessment by γH2AX-foci quantification after alpha-particle emitter Ac-225 and electron emitter Lu-177 somatostatin receptor targeted radiotherapy correlates with cell death and apoptosis in vitro[C]∥8thInternational Symposium on Targeted Alpha Therapy, June 4-6, 2013. [s.n.], 2013: 28.
[21] Sartor O, Maalouf B N, Hauck C R, et al. Targeted use of Alpha Particles:Current Status in Cancer Therapeutics[J]. J Nucl Med Radiat Ther, 2012, 3(4): 136-144.
[22] Rosenblat T L, McDevitt M R, Mulford D A, et al. Sequential cytarabine and alpha-particle immunotherapy with bismuth-213-lintuzumab (HuM195) for acute myeloid leukemia[J]. Clin Cancer Res, 2010, 16(21): 5 303-5 314.
[23] Morgenstern A, Krolicki L, Kunikowska J, et al. Targeted alpha therapy of glioblastoma multiforme with213Bi-substance P[C]∥8thInternational Symposium on Targeted Alpha Therapy. [s. n.], 2013: 15.
[24] Bryan R A, Jiang Z, Jandl T, et al. Treatment of experimental pancreatic cancer with 213-Bismuthlabeled chimeric antibody to single-strand DNAin combination with cisplatin and Gemcitabine[C]∥8thInternational Symposium on Targeted Alpha Therapy. [s. n.], 2013: 22.
[25] Zalutsky M R, Pruszynski M. Astatine-211:production and availability[J]. Curr Radiopharm, 2011, 4(3): 177-185.
[26] 刘宁,杨远友,金建南,等. 基于CS-30回旋加速器的同位素研制及应用[J]. 同位素,2012,25(3):189-192.
Liu Ning, Yang Youyuan, Jin Jiannan, et al. Preparation of radioactive isotopes by CS-30 cyclotron and their applications[J]. Journal of Isotopes, 2012, 25(3): 189-192(in Chinese).
[27] Albertsson P, Andersson H, Back T, et al. Clinical update of a phase I study on alpha particle radioimmunotherapy with astatine-211 in relapsed ovarian carcinoma[C]∥ 8thInternational Symposium on Targeted Alpha Therapy. [s. n.], 2013: 16.
[28] Thorsten P, Zekiye K, Doris K, et al. In vitro experimental211At-anti-CD33 antibody therapy of leukaemia cells overcomes cellular resistance seen in vivo against gemtuzumab ozogamicin[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2010, 37(5): 851-861.
[29] 刘宁,杨远友,廖家莉,等. 近年来211At放射性药物研究的新进展[J]. 同位素,2011,24(S1):36-43.
Liu Ning, Yang Youyuan Liao Jiali,et al. New progress of211At labelled radiopharmaceuticals recently[J]. Journal of Isotopes, 2011, 24(S1): 36-43(in Chinese).
[30] Liu N, Jin J N, Mo S W, et al. Prepartion and preliminary evaluation of astatine-211 labeled IgG via DTPA anhydride[J]. J Radioanal Nucl Chem, 1998, 227(1-2): 187-190.
[31] Liu N, Jin J N, Zhang S Y, et al.211At labeling of a monoclonal antibody and its Fab fragment: Cytotoxicity on human gastric cancer and biodistribution in nude mice with tumor exnografts[J]. J Radioanal Nucl Chem, 2001, 247(1): 129-133.
[32] Liu N, Jin J N, Zhang S Y, et al. Astatine-211 labeling of monoclonal antibody and its fab fragment: Synthesis,immunoreactivity and expermental therapy[J]. J Lablled Comp Radiopharm, 1995, 36(11): 1 105-1 113.
[33] Elgqvist J, Frost S, Pouget J P. The potential and hurdles of targeted alpha therapy-clinical trials and beyond[J]. Targeted alpha therapy, 2014, 3: 324-333.
[34] 牛芳,马桃桃,孙秀华,等.212Pb/212Bi发生器的分离研究[J]. 核化学与放射化学,1991,20(3):189-192.
Niu Fang, Ma Taotao, Sun Xiuhua, et al. Separation studies of212Pb-212Bi Radionuclidic generator[J]. 1991, 20(3):189-192(in Chinese).
[35] Stuart F P, Perdrizet G, Steranka B, et al. Specific destruction of allogeneic tumor cells in vivo by a bismuth-212 immunotoxin[J]. Transplant Proc, 1987, 19(1): 605-606.
[36] Miao Y, Hylarides M, Fisher D R, et al. Melanoma therapy via peptide-targeted {alpha}-radiation[J]. Clin Cancer Res, 2005, 11(15): 5 616-5 621.
[37] Rotmensch J, Whitlock J L, Schwartz J L, et al. In vitro and in vivo studies on the development of the alpha-emitting radionuclide bismuth-212 for intraperitoneal use against microscopic ovarian carcinoma[J]. Gynecol, 1997, 176(4): 833-840.
[38] Milenic D E, Garmestani K, Brady E D, et al. Potentiation of high-LET radiation by gemcitabine: targeting HER2 with trastuzumab to treat disseminated peritoneal disease[J]. Clin Cancer Res, 2007, 13(6): 1 926-1 935.
[39] Hassfjell S P, Bruland Ø S, Hoff P.212Bi-DOTMP: an alpha particle emitting bone-seeking agent for targeted radiotherapy[J]. Nucl Med Biol, 1997, 24(3): 231-237.
[40] Kozak R W, Atcher R W, Gansow O A, et al. Bismuth-212-labeled anti-Tac monoclonal antibody: alpha-particle-emitting radionuclides as modalities for radioimmunotherapy[J]. Proc Natl Acad Sci USA, 1986, 83(2): 474-478.
[41] Macklis R M, Kinsey B M, Kassis AI, et al. Radioimmunotherapy with alpha-particle-emitting immunoconjugates[J]. Science, 240(4 855): 1 024-1 026.
[42] Brechbiel M W, Waldmann T A. Anti-HER2 radioimmunotherapy[J]. Breast Dis, 2000, 11: 125-132.
[43] Beyer G J, Offord R, Allen B J, et al. Targeted Cancer Therapy: The Potential Role of Terbium-149. In Proc[C]∥6thInternational Conference on Radiopharmaceutical Dosimetry. Tennessee: [s. n.], 1996: 7-10.
[44] Abbas Rizvi S M, Henniker A J, Goozee G, et al. In vitro testing of the leukaemia monoclonal antibody WM-53 labeled with alpha and beta emitting radioisotopes[J]. Leukemia Res, 2002, 26(7): 37-43.
[45] Natouh S A. Radiobiological evaluation of213Bi and149Tb radioisotopes for targeted alpha therapy by computational methods[M]. Libya : Tajoura Nuclear Research Center, 2012: 1-4.
[46] Washiyama K, Amano R, Sasaki J, et al.227Th-EDTMP: a potential therapeutic agent for bone metastasis[J]. Nucl Med Biol, 2004, 31(7): 901-908.
[47] Dahle J, Borrebk J, Melhus KB, et al. Initial evaluation of (227)Th-p-benzyl-DOTA-rituximab for low-dose rate alpha-particle radioimmunotherapy[J]. Nucl Med Biol, 2006, 33(2): 271-279.
[48] Larsen R H. Oeyvind Bruland.Thorium-227 for use in radiotherapy of soft tissue disease: Norway, CA2522148A1[P]. 2004-04-15.

