自动化合成11C-Raclopride及质量控制
张锦明,张晓军,李云钢,刘 健,徐白萱,王瑞民,田嘉禾
(中国人民解放军总医院 核医学科,北京 100853)
11C-Raclopride为经典的多巴胺D2受体显像剂,临床用于帕金森氏病(PD)的鉴别诊断和研究[1-2]。通常采用11C-CH3I或11C-CH3-Triflate与去甲基Raclopride前体化合物芳香环上的氧-碳甲基化反应合成11C-Raclopride,合成效率为5%~60%[3-5],由于采用气相法合成11C-CH3I的效率低(20%~30%),以及没有选择合适的甲基化反应方式等,致使最终产品的放射性活度较低[6],通常合成产物的放射性活度低于2 GBq。试尝用18F-Fallypride取代11C-Raclopride,但18F-Fallypride为D2和D3受体显像剂,其对D2的亲和力远高于11C-Raclopride[7]。18F-Fallypride在早期PD患者时,由于纹状体摄取放射性很高,不容易区别单侧纹状体的上调,因此临床诊断仍依赖11C-Raclopride。
11C-Raclopride已经成功应用于PET/CT显像,文献也报导了多种11C-Raclopride的合成方法,每种方法均有优缺点。合成原料采用高活性的11CH3-Triflate替代11CH3I,可以提高合成效率,降低前体用量[8-10]。仍有文献[11]用11CH3I作为标记前体,直接合成11C-Raclopride,其不校正合成效率为9%~14%(从有11CO2计),该方法效率高于Ishiwata 等的采用11CH3-Triflate合成效率11%~14%(从11CH3I计),但采用11CH3I合成时前体用量为11CH3-Triflate 的4倍。合成方法有三种:1) 溶液法,即将前体溶于合适溶剂,放射性气体通入到溶剂中,该方法的优点是溶剂对放射性气体的捕获效率高度,由于接触面小,导致合成效率偏低;2) SEP-PAK柱上反应法[12],即将前体溶于微量溶液后装载于SEP-PAK柱上,放射性气体通过SEP-PAK柱,在柱上反应,放射性的捕获效率与溶剂种类相关,效率同样不高;3) LOOP法[12],即将溶有前体的溶剂装载于HPLC的LOOP环中,将放射性气体通过LOOP环,通过增加接触面提高反应效率,放射性气体的捕获效率与溶剂有关,其中以2-丁酮和环已烷效率最高,但该方法需制备特殊的前体[13]。Shaw等[14]为了减少有机溶剂在产品中残留,采用乙醇作溶剂合成11C-Raclopride,合成效率仅为3.7%,与实际应用有较大的差距。因此,在临床实际应用中,必须选择一种合适的方法,以保证产品的放化纯度和比活度达到要求,产品的活度和放射性浓度要较高,注射体积不宜过大,产品中乙醇浓度低于10%。目前文献报导合成总活度及浓度均偏低,有的仅合成1.1 GBq[15],导致注射体积大或乙醇浓度高。
本研究选择液相法合成11CH3I,合成效率达60%,并将之转化为高活性11CH3-Triflate,以丙酮为溶剂,采用分析型HPLC分离产品,提高11C-Raclopride浓度,减小体积。采用国产商品化的碳-11多功能合成模块,通过提高液相法合成11C-CH3I的效率,并优化合成流程及纯化工艺,使产品可满足PET/CT检查的需求。
1 实验材料
HM-20 回旋加速器:日本住友重机械株式会社;自动化碳-11多功能合成模块:内置液相法碘代甲烷合成仪、 Triflate在线转换、半制备HPLC系统(配紫外和放射性检测器),派特(北京)科技有限公司;分析型HPLC仪:配Biocan Flow Count放射性检测器和2487紫外检测器,美国Waters公司;Endosafe-PTS细菌内毒素快速检测仪:美国 Charles River公司;Sep-Pak C-18柱和CM柱:美国Waters公司;1 mol/L的氢化锂铝四氢呋喃溶液:美国Aldrich公司;57%HI(AR), 百灵威J&K公司,乙醇(USP级):美国Milennium公司;丙酮(AR):美国Sigma公司; 去甲基Raclopride和2-丁酮:江苏常熟华益化工有限公司产品;Raclopride氢溴酸盐标准品和1 mol/L 四丁基铵水溶液:美国Aldrich公司。
2 实验方法
2.1 11C-CH3-Triflate(11C-CH3-SO2CF3)的合成[9]
采用HM-20加速器经14N(p,α)11C反应在靶内产生11CO2,直接将11CO2传到自动化碳-11多功能合成模块,用液氮冷却的不锈钢LOOP环捕获,随后从液氮中移出LOOP环,将LOOP环内的11CO2释放到有0.2 mL 1 mol/L的氢化锂铝四氢呋喃(THF)溶液反应管中,随后,通入氮气并加热除去THF,反应管中加入0.2 mL 57%氢碘酸,生成11C-CH3,加热并用氮气将之蒸至Triflate转化炉中,11C-CH3在线转换成11C-CH3-Triflate。
2.2 11C-Raclopride的合成与纯化
将含有0.1~0.4 mg的Nor-Raclopride溶于0.2 mL丙酮中,加入10 μL 0.1~ 5 moL/L NaOH, 通入在线转化的11C-CH3-Triflate,常温或者85 ℃加热5 min后,经半制备HPLC分离,分离柱为Alltech C-18 250×10 mm,流动相为V(乙腈)∶V(0.1 mol/L 甲酸铵溶液)=4∶6,收集7~8 min的产品,根据峰面积分析产品的标记率。
2.3 自动化合成11C-Raclopride
将11C-CH3-Triflate通入到新配制的200 μL含0.2 mg去甲基Raclopride/10 μL的0.5 mol/L氢氧化钠的丙酮溶液(图1中的C)内,观察R4的放射性计数达到最大时,停止通气。常温下反应1 min后,将V14内的流动相加到反应瓶终止反应,并转移到中转瓶,将中转瓶内溶液转移到HPLC柱上纯化(图1中D部分),流动相为V(乙腈)∶V (0.1 mol/L 甲酸铵溶液)=4∶6,流速为6 mL/min,收集7~8 min的放射性溶液入固相萃取瓶,固相萃取瓶中预先加入60 mL水,以稀释HPLC收集液。将经稀释后溶液转移到Sep-Pak C-18柱上,用10 mL水清洗Sep-Pak C-18柱后,用1 mL乙醇将产品从Sep-Pak C-18柱上洗脱(图1中E部分),并加生理盐水稀释,过无菌滤膜。
2.4 产品的质量控制
在铅玻璃后检查产品的澄明度, 用pH试纸检测。根据最终体积计算乙醇浓度,采用Endosafe-PTS细菌内毒素快速检测仪测注射液的热原;按中国药典 2010年版二部附录Ⅺ H进行细菌检测。
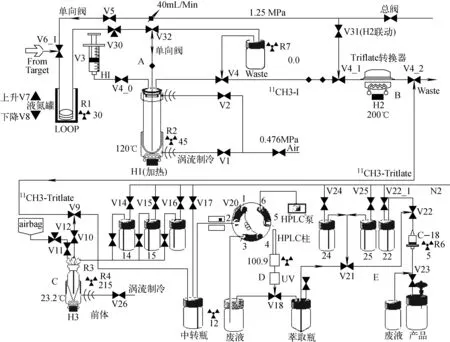
图1 全自动合成11C-Raclopride的模块Fig.1 The module of auto-synthesis for 11C-Raclopride

图2 合成11C-Raclopride线路图Fig.2 Scheme of 11C-Raclopride synthesis
采用HPLC测量放化纯度和比活度,检测波长为254 nm;分析柱为反相Nova-Park C-18柱(3.9 mm×150 mm),流动相为V(乙腈)∶V (0.1 mol/L 甲酸铵溶液)=4∶6,流速为1 mL/min。分别采用11C-Raclopride、标准品、11C-Raclopride和标准品混合物进样,测量产品的相对保留时间,并计算产品的比活度和放化纯度。
3 结果和讨论
3.1 不同条件下的11C-Raclopride的合成及优化
将11C-CH3-Triflate通入到含有0.2 mL丙酮溶解的0.4 mg 去甲基Raclopride(游离碱)/3 μL 5 mol/L NaOH的反应瓶中,常温下反应,经半制备HPLC分离,结果示于图3,有3个主要的放射性峰。
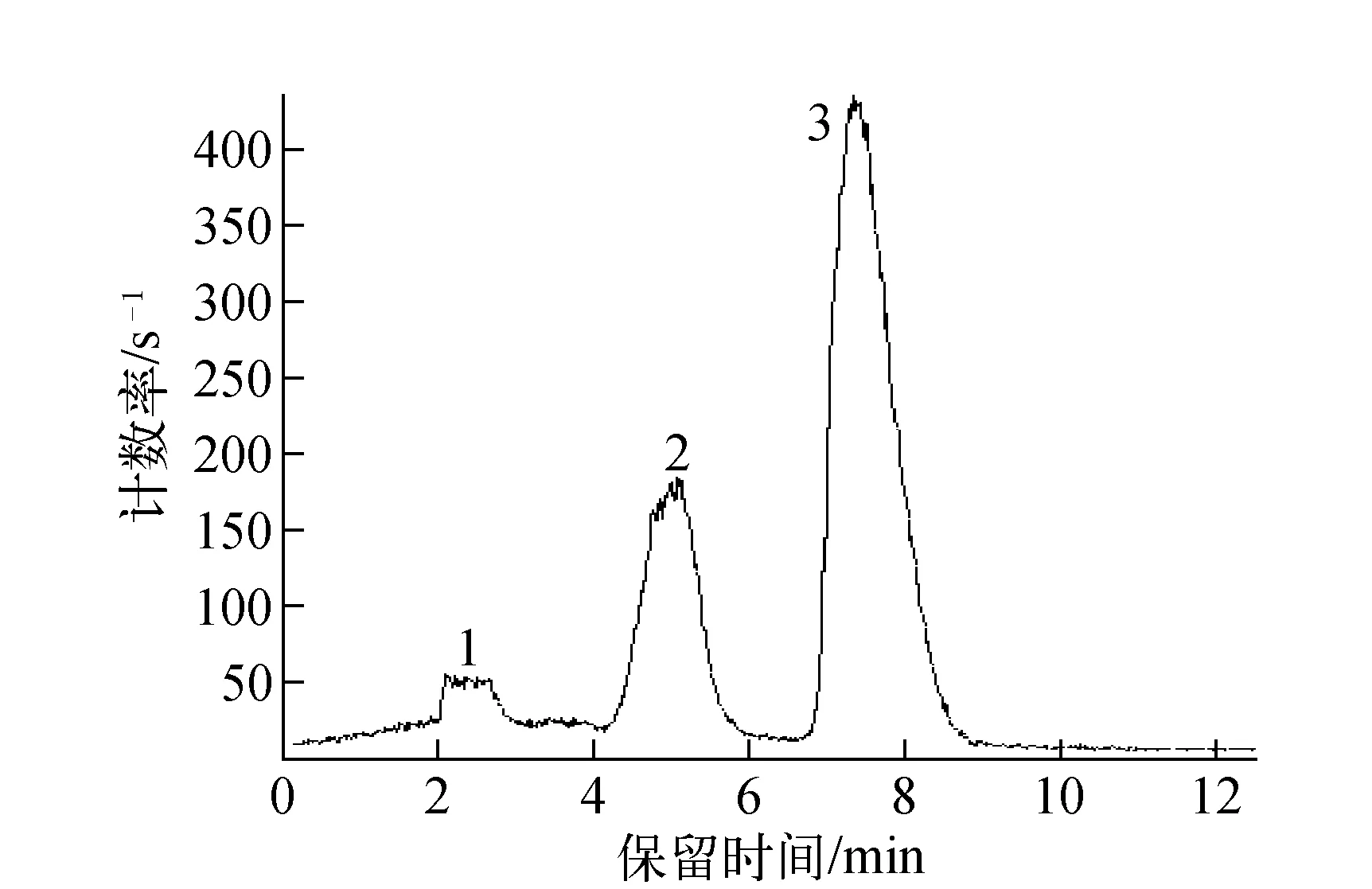
图3 半制备HPLC纯化11C-Raclopride放射性图谱Fig.3 The radioactivity trace of 11C-Raclopride from Semi-HPLC
采用单独进11C-CH3-Triflate样品,确认放射性峰1为未反应的11C-CH3-Triflate峰,收集放射性峰3样品与标准的Raclopride在分析HPLC上紫外对照,放射性峰3为11C-Raclopride峰,而放射性峰2为副反应峰。
结果表明,游离碱前体的稳定性不高,常温贮存会造成前体分解,合成效率下降,同时出现了多个杂峰(图4)。因此,建议低温存贮游离碱前体。
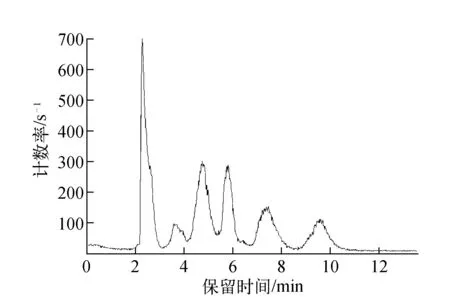
图4 常温贮存的游离碱前体合成 11C-Raclopride的产品HPLC图谱Fig.4 The radioactivity trace of 11C-Raclopride with RT stored precursor at Semi-HPLC
反应体系中NaOH的量从1 μmol到50 μmol,产品的合成效率基本不变(见图5),低量碱时,放射性峰1量变大,而峰2变小(图5b);加大碱量,放射性峰1量变小几乎消失,而峰2变大(图5a)。
由于前体去甲基Raclopride分子上有多个可甲基化的基团,副反应可能有两个,一是五元环上的仲胺可甲基化为季胺,用40%乙腈水溶液作流动相,单独收集放射性峰2分析,放射性峰2不能被阳离子交换树脂吸附,说明峰2为无电荷,不是季胺盐;另一是酰胺上的氮原子甲基化,该甲基化需要强碱下进行[16],而合成体系中碱的量主要影响了副反应的效率。从图5b发现,增加碱量,放射性峰2含量增加,副反应可能为酰胺上C-N甲基化。
a—10 μL 5 moL/L NaOH;b—2 μL 0.5 moL/L NaOH; 图5 不同的碱量对11C-Raclopride合成及副反应的影响 a—10 μL 5 moL/L NaOH;b—2 μL 0.5 moL/L NaOHFig.5 Synthesis of 11C-Raclopride and by-production at different base
本研究也尝试采用LOOP法合成,采用100 μL的2-丁酮溶解1 mg的游离碱去甲基Raclopride前体,体系中加入10 μL 1 mol/L四丁基铵水溶液,将该溶液装载于HPLC的 LOOP环中,但未能得到产品。可能的原因是未合成四丁基铵的去甲基Raclopride前体,体系中含有水,可能影响了产品的合成。
3.2 11C-Raclopride的自动化合成
采用碳-11自动化合成模块,以40 μA的束流轰击气体靶15 min,可收集到含(7.4±0.6) GBq的HPLC淋洗液,再经固相萃取,可得到3.7~5.6 GBq的11C-Raclopride。放射性损失主要是产品在C-18柱上的漏穿和残留,共约20%。总合成时间从11CO2开始为28 min,校正合成效率为(55.1+8.4)%(以11CH3I计,n=40)。与文献[17]相比,本方法模块内置的固相萃取提高了合成速度。而文献中采用BioScan公司的ReForm-Plus system,不但转移速度慢,而且需要独立的热室。
3.3 11C-Raclopride的质量控制
最终产品为含10%乙醇的无色透明液体,pH为6.0~7.0。 产品无菌、无热源。
将11C-Raclopride产品与标准品混和后在HPLC上共进样,标准品的紫外保留时间为4.4 min,而样品的放射性保留时间也为4.4 min,产品的相对保留时间为 1.0。鉴定产品为11C-Raclopride。
单独将11C-Raclopride产品进样,测放化纯度和比活度,结果表明,11C-Raclopride放化纯度大于99%,比活度为1.73×1014Bq/g。产品的放射性浓度在370~550 MBq/mL,乙醇浓度低于10%。
4 小结
本研究采用液相法合成11CH3I,其优点是合成效率高,约为60%,高于气相法的20%,因此可提高终产品的总活度,降低产品中乙醇的含量。最新文献[19]研究表明,11CH3I的比活度与合成方法无关,主要是加速器靶轰击时高温、高压产生了非放射性的二氧化碳,如果通过多次预处理靶及传输管线和释放系统,可以将液相法合成11C标记化合物的比活度提高到5 700 TBq/moL[20],远高气相法的550 TBq/moL。 本研究未采用氦气等饱和传输管线,因此比活度低于文献值,但高于美国药典规定的不低于18.5 TBq/moL标准,满足临床受体显像的要求。
参考文献:
[1] Kim J Y, Chung E J, Lee W Y, et al. Therapeutic effect of repetitive transcranial magnetic stimulation in Parkinson’s disease: analysis of11C- raclopride PET study[J]. Mov Disord, 2008, 23(2): 207-211.
[2] Politis M, Piccini P, Pavese N,et al. Evidence of dopamine dysfunction in the hypothalamus of patients with Parkinson's disease: an in vivo11C-raclopride PET study[J]. Exp Neurol, 2008, 214(1): 112-116.
[3] Langer O, Nagren K, Dolle F, et al. Precursor synthesis and radiolabelling of the dopamine D-2 receptor ligand C-11 raclopride from C-11 methyl triate[J]. J Labelled Compd Radiopharm,1999, 42: 1 183-1 193.
[4] Zheng Q H, Mock B H. Puricfication of carbon-11 PET radiotracers from unlabeled precursors by preparative HPLC and SPE[J]. Biomed Chromatogr, 2005, 19, 671-676.
[5] 张锦明,田嘉禾,姚树林,等.11C-Raclopride的快速制备及生物学分布[J]. 中华核医学杂志,2008,28(4):227-230.
Zhang Jinming, Tian Jiahe, Yao Shulin, et al. Fast synthesis of11C-Raclopride and its initial PET study on animal model[J].Chin J Nucl Med, 2008, 28(4):227-230(in Chinese).
[6] 李军,侯宁,李广义. 多巴胺D2受体正电子示踪剂-11C-雷氯必利的自动化合成及质量控制[J]. 中国药学杂志,2007,42:706-708.
Li Jun, Hou Ning, Li Guangyi. Automatic Synthesis and Quality control of11C-Raclopride Dopamine D2 receptor PET Radiotracer[J]. Chinese Pharm J, 2007, 42: 706-708(in Chinese).
[7] Paulis T. The discovery of epidepride and its analogs as high-affinity radioligands for imaging extrastriatal dopamine D(2) receptors in human brain[J].Cur Pharma Des, 2003, 9: 673-696
[8] Kersemans K , Meestere D D, Goethals I ,et al. Improved HPLC puri cation strategy for11C-raclopride and11C-DASB leading to high radiochemical yields and more practical high quality radiopharmaceutical formulations[J]. Appl Radiat Isot, 2013, 78: 62-67.
[9] 张锦明,田嘉禾,王武尚,等. 在线制备11C-Triflate-CH3[J]. 同位素,2006,(02):124-128.
Zhang Jinming, Tian Jiahe, Wang Wushang, et al. Preparation of11C-Triflate-CH3on-line[J]. Journal of Isotopes, 2006, (2): 124-128(in Chinese).
[10] Ishiwata K, Ishii S-I, Senda M. An alternative synthesis of11C-raclopride for routine use[J]. Ann Nuc Med,1999, 13: 195-197.
[11] Wilson A A, Garcia A, Houle S, et al. Utility of commercial radiosynthestic modules in captive solvent11C-methylation reactions[J]. J Label Compd Radiopharm, 2009, 52: 490-492.
[12] Iwata R, Pascalic A, Bognic A, et al. A simple loop method for the automated preparation of11C-raclopride from11C-methyl triflate[J]. Appl Radiat Isot, 2001, 55: 17-22.
[13] Shao X ,Kilbourn MP.A simple modication of GE tracerlab FX C Pro for rapid sequential preparation of11C -carfentanil and11C -raclopride[J].Appl Radiat Isot, 2009, 67: 602-605.
[14] Shao X, Schnau PL, Fawaz MV, et al. Enhanced radiosyntheses of11C-raclopride and11C-DASB using ethanolic loop chemistry[J]. Nucl Med Biol, 2013, 40: 109-116.
[15] 闫卫红,程焱,高硕,等. 轻型帕金森病D2受体的PET显像[J]. 中华神经外科杂志,2006,39:374-377.
Yan Weihong, Cheng Yan, Gao Shuo, et al. PET image of D2receptor in Parkinson. s disease[J].Chinese J Neurology, 2006, 39: 374-377(in Chinese).
[16] 王明芳,张锦明,唐刚华,等.11C-CH3-Triflate甲基化法合成11C-PK11195[J]. 同位素,2010,23(4):230-234.
Wang Mingfang, Zhang Jinming, Tang Guanghua et al. Radiosynthesis of11C-PK11195 by Using [11C]Methyl Triflate[J]. Journal Of Isotopes, 2010, 23(4): 230-234(in Chinese).
[17] Gomez-Vallejo V, Llop J. Fully automated and reproducible radiosynthesis of high specific activity11C-raclopride and11C-Pittsburgh compound-B using the combination of two commercial synthesizers[J]. Nucl Med Commun, 2011, 32: 1 011-1 017.
[18] Iwata R, Ido T, Ujiie A , et al. Sugahara M. Comparative study of specic activity of [11C ] methyl iodide: a search for the source of carrier carbon Int.[J]. J Radiat Appl Instrum(A), 1988, 39 (1): 1-7.
[19] Vanessa Go′mez-Vallejo, Jordi Llop. Specic activity of [11C]CH3I synthesized by the “wet” method: Main sources of non-radioactive carbon[J]. Appl Radiat Isot, 2009, 67: 111-114.
[20 ] Ermert J, Stusgen S, Lang M, et al. High molar activity of [11C ] TCH346 via [11C ]methyl tri .ate using the “wet” [11C ]CO2reduction method[J]. Appl Radiat Isot, 2008, 66: 619-624.

