18F标记的新型鏻正阳离子PET心肌灌注显像剂的制备及生物性能评价
彭 程,赵祚全,陈淑婷,马云川,张现忠,陆 洁
(1.首都医科大学宣武医院,北京 100053;2.放射性药物教育部重点实验室 北京师范大学化学学院,北京 100875; 3.分子影像暨转化医学研究中心 厦门大学公共卫生学院,厦门 361005; 4.中国医学科学院 北京协和医学院 国家心血管病中心 阜外心血管病医院 心血管疾病国家重点实验室,北京 100037 )
心肌灌注核素显像作为一种无创诊断技术,在冠心病的早期诊断及预后评价中起着重要的作用,相较于目前临床广泛使用的单光子计算机断层扫描(SPECT)心肌灌注显像技术,正电子发射断层扫描(PET)具有时间空间分辨率高、灵敏度高和心肌灌注定量等优点[1]。但目前可用于临床使用的PET心肌灌注显像剂普遍核素半衰期过短,例如:13N-NH3·H2O(T1/2=10 min),82Rb(T1/2=75 s),H215O(T1/2=2 min),极大地限制了在临床上的广泛推广[2-3]。因此,具有适宜核素半衰期的18F(T1/2=110 min)标记新型PET心肌灌注显像剂的研究成为近年来放射性药物研究领域的一个新的热点。
线粒体在细胞能量产生过程中起着非常重要的作用,线粒体的数量与细胞的能量需求有关,新陈代谢活跃的器官,如心脏,其细胞内线粒体的重量约占30%。因而,许多新型PET心肌灌注显像剂,例如18F标记的MC-I抑制剂[4]、鏻正阳离子化合物[5]、季铵类阳离子化合物[2]等都以线粒体为靶标,实现其在心肌中的聚集。其中,以三苯基膦为母体的18F标记的亲脂性鏻正阳离子可通过被动扩散进入细胞,并利用跨膜电位可以富集于线粒体中[5-6]。但目前已报道的18F标记的亲脂性鏻正阳离子化合物的制备时间都比较长、且产率低,并普遍存在肝摄取高、非靶组织清除慢的缺点[6-8]。为研制生物性能优良,适于临床使用的新型18F标记的亲脂性鏻正阳离子心肌灌注显像剂,本工作采用有甲氧基修饰的三-(2,6-二甲氧基苯基)膦为母体,以1,3-二(溴甲基苯)为标记前体,一锅标记法制备得到3-氟-18F-甲基苄基-三-(2,6-二甲氧基苯基)鏻正阳离子(18F-2),并对其进行了生物性能的初步评价研究。
1 实验部分
1.1 试剂与仪器
1,3-二溴甲基苯:纯度>97%,Alfa Aesar;二水合氟化钾:纯度99%,天津化学试剂厂;Kryptofix2.2.2.(K2.2.2):Sigma-Aldrich;无水碳酸钾:纯度99%,北京化工厂;18-Crown-6:纯度99%,安耐吉化学有限公司;三(2,6-二甲氧基苯基)膦:纯度>97%,Alfa Aesar;其余化学试剂为分析纯,购自北京化工厂。
Avance 400型核磁共振谱仪:瑞士Bruker公司;高压液相色谱仪:LC-20AT,日本岛津公司;WALLAC/WIZARD 1470γ自动计数仪:美国 PerkinElmer公司;RM-905a放射性活度计:中国计量科学研究院;反向C18制备柱:20 mm×250 mm,5 μm,SHIMADZU C18,日本岛津;反向C18分析柱:4.6 mm×250 mm,5 μm,Venusil MP-C18,美国Agela Technologies Inc.。
1.2 3-氟甲基苄基-三-(2,6-二甲氧基苯基)鏻盐(19F-2)的合成
对照品3-氟甲基苄基-三-(2,6-二甲氧基苯基)鏻盐(19F-2)的合成路线示于图1。
在100 mL的三颈瓶中,无水,氮气保护下,依次加入KF·2H2O (0.336 g,3.6 mmol),无水乙腈10 mL,并在110 ℃下氮气吹干,反复加入无水乙腈(10 mL×2)并用氮气流吹干,残余物冷却到60 ℃,依次加入无水乙腈30 mL,18-Crown-6的无水乙腈溶液(0.966 g,3.66 mmol) 5 mL和1,3-二溴甲基苯(0.792 g,3 mmol),并在100 ℃反应过夜。反应完成后,减压除去乙腈,得到粗产物,粗产物经过正相硅胶柱色谱分离纯化(流动相:石油醚),得到无色1-氟甲基-3-溴甲基苯(19F-1) 0.25 g。产品无需纯化直接投入下步反应。
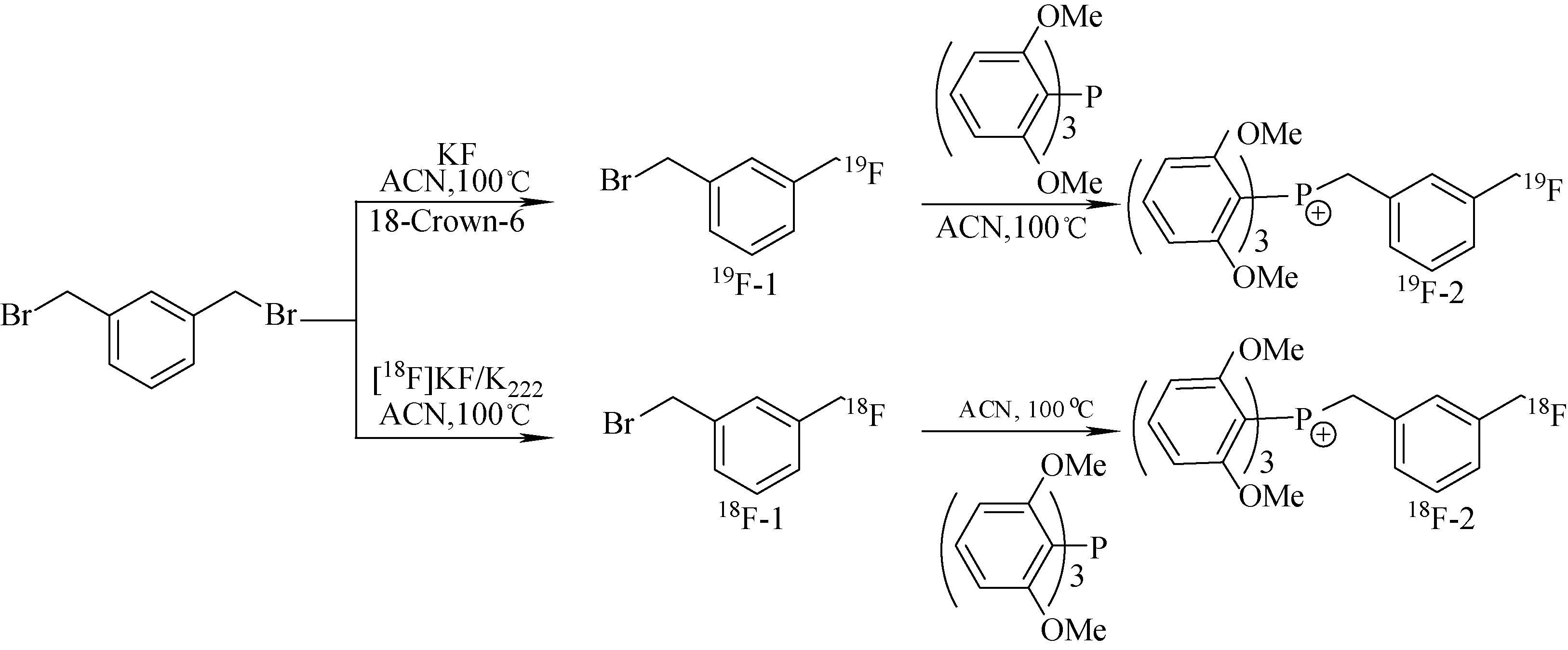
图1 18F/19F-2的合成路线图Fig.1 Synthesis routes of 18F/19F-2
另取100 mL的三颈瓶,氮气保护下,加入无水乙腈20 mL,19F-1(0.061g,0.29 mmol),溶解后缓慢滴加(2,6-二甲氧基苯基)三苯基膦(0.102 g,0.23 mmol)的无水乙腈溶液20 mL,氮气保护下 100 ℃反应10 h。反应完成后,冷却到室温,减压浓缩母液,粗产物经过硅胶柱色谱分离纯化(淋洗液:V(二氯甲烷)∶V(甲醇)=20∶1),得到白色固体化合物3-氟甲基苄基-三-(2,6-二甲氧基苯基)鏻盐(19F-2)0.06 g,其产率为37%,产品经过氢谱和氟谱的鉴定:1H NMR(400 MHz, DMSO)δ:3.57(s,18H),4.79~4.84(d,2H,J=20 Hz),5.12(s,1H),5.24(s,1H),6.66~6.69(m,6H,J=12 Hz),7.07~7.13(m,4H,J=28 Hz),7.48~7.53(d,3H,J=20 Hz);19F NMR (400 MHz,DMSO)δ:-205.18。
1.3 3-氟-18F-甲基苄基-三-(2,6-二甲氧基苯基)鏻盐(18F-2)的制备
18F-2采用一锅法制备,其制备路线如图1所示。将1.3 mL含有1.5 mg K2CO3和1 mg K2.2.2的18F-F-溶液加至10 mL反应瓶中,110 ℃氮气吹干,然后加入0.5 mL无水乙腈后再次110 ℃氮气吹干,并重复该步骤三次。将3 mg 1,3-二溴甲基苯的无水乙腈溶液0.5 mL加入上述反应瓶中,100 ℃密闭条件下反应6 min,得到18F-1。冷却至室温再加入8 mg(2,5-二甲氧基苯基)三苯基膦的无水乙腈溶液0.5 mL,密闭条件下100 ℃反应15 min,得到示踪剂18F-2的粗产物。冷却至室温,过0.22 μm的滤膜,用乙腈稀释至1 mL,充分混合后注入C-18 反相半制备柱(20 mm×250 mm)。收集保留时间为20~22 min的组分,氮气吹干后,溶解于1 mL灭菌注射用水中,即为示踪剂18F-2。HPLC淋洗梯度为等浓度淋洗,V(0.02 mol/L PBS)∶V(乙腈)=60∶40,流速:8 mL/min。
经分离纯化后标记物的放化纯度可通过C-18 反相分析柱 (4.6 mm×250 mm)鉴定。HPLC淋洗梯度为等浓度淋洗,V( 0.02 mol/L PBS)∶V(乙腈)=60∶40,流速:1 mL/min。
1.4 标记化合物18F-2的体外稳定性
1.4.1标记化合物18F-2在水溶液中的稳定性 将上述HPLC分离纯化后的18F-2标记物溶液于室温放置3 h,依上述方法通过HPLC测定其放化纯度,观察标记物18F-2在室温水溶液条件下的体外稳定性。
1.4.2标记化合物18F-2在血清中的稳定性 取上述HPLC分离纯化后的18F-2标记物溶液1~2 MBq/0.1 mL于0.5 mL 新鲜制备的小鼠血清中,37 ℃孵育3 h,加入0.5 mL乙腈,充分混匀后14 000 r/min离心5 min。上清液通过0.22 μm滤膜过滤后,依上述方法通过HPLC测定其放化纯度,观察标记物18F-2在37 ℃条件下小鼠血清中的稳定性。
1.5 标记化合物18F-2的脂水分配系数和电荷的测定
1.5.1脂水分配系数的测定 参考文献[9],将0.1 mL(约1.11 MBq,放化纯度>95%)的18F-2标记溶液加入含2 mL正辛醇和1.9 mL 磷酸缓冲溶液(pH7.4,0.025 mol/L)的离心试管中,用振荡器振荡5 min后高速离心5 min,分别取有机相和水相各0.2 mL于干净的试管中,在计数器上测其放射性活度,分配系数logPO/W=log(N有/N水)(N有和N水分别为有机相和水相样品的计数率),重复本操作3次,取平均值。
1.5.2电荷性质测定 采用电泳实验方法[9],溶液介质选用磷酸缓冲溶液(PBS,pH=7.4,0.052 5 mol/L),电泳纸条选用新华一号纸(10 cm×1 cm),将电压调节在150 V,通电2 h后测定电泳条的放射性分布,判定标记化合物18F-2的电荷性质。
1.6 小鼠体内的生物分布
取体质量为18~20 g的正常昆明小鼠(由北京维通利华实验动物技术有限公司提供)20只,分为4组,每组5只,每只动物尾静脉注射0.1 mL18F-2标记溶液(1.85 MBq/mL,放化纯度>95%),分别于注射后5、30、60、120 min时断颈处死,取其心、肝、脾、肺、肾、肌肉、骨和血等组织和器官,称重并在计数器上测其放射性活度,计算每克组织的放射性占总注射剂量的百分数(%ID/g),实验结果以平均值±标准偏差表示。
2 结果与讨论
2.1 标记配合物的制备及稳定性研究
标记化合物18F-2的制备通过两步法得到,首先是18F-通过亲核取代与1,3-二溴甲基苯反应得到标记中间体18F-1。18F-1并未进行HPLC纯化分离,而是直接采用一锅法与三(2,6-二甲氧基苯基)膦反应得到标记产物18F-2,最后进行HPLC分离纯化。其总的标记时间小于60 min,校正后的产率为(31±3)%,放化纯度98%,比活度为30 GBq/μmoL。
标记产物18F-2的HPLC分析结果如图2所示。由图2可见,18F-2的保留时间为11.71 min,与其对照品19F-2 HPLC的UV检测器保留时间基本一致(tR=11.69 min)。18F-2在室温水溶液中和37 ℃条件下小鼠血清中孵育3 h后,HPLC分析未见其他放射性分解产物的生成,其放化纯度仍大于95%,表明这18F-2具有良好的体外稳定性。

a—对照品19F-2的UV检测器HPLC谱图;b—18F-2的放射性检测器HPLC谱图; c— 18F-2在室温水溶液中孵育3 h后的HPLC分析谱图;d—18F-2在37 ℃条件下小鼠血清中孵育3 h后的HPLC分析谱图 图2 HPLC分析谱图Fig.2 The analysis trace by HPLC
2.2 标记配合物的理化性质
电泳实验结果显示,标记化合物18F-2的放射性集中在负极,说明与预期设计一致,为带正电荷的阳离子化合物,脂水分配系数logPO/W=1.82±0.01,表明其为脂溶性化合物。
2.3 生物分布
标记化合物18F-2在正常昆明小鼠的体内分布实验结果列于表1。从表1中数据可以看出,标记化合物18F-2在心肌的初始摄取很高且滞留较好,注射后5 min的心肌摄取为(53.88±7.45)%ID/g,给药后120 min,心肌摄取仍然达到(25.36±1.44)%ID/g。其他非靶器官,例如肝脏中5 min时的摄取为(166.74±8.87)%ID/g,60 min时只有(5.99±0.94)%ID/g,清除率为96%;肺中5 min时的摄取为(40.73±7.59)%ID/g,60 min时只有(6.29±1.35)%ID/g,清除率为85%;血液中5 min时的摄取为(23.25±3.74)%ID/g,60 min时只有(2.61±0.69)%ID/g,清除率为87%。在肝、肺、血中的快速清除使得标记化合物18F-2在注射后60 min的心与肝、心与肺和心与血放射性摄取比达到3.99、3.80和9.17。

表1 标记化合物18F-2在正常小鼠中的生物分布Table 1 The biodistribution of 18F-2 in mice at 5, 30, 60, and 120 min after injection n=5)
另外,18F-2在小鼠肾脏中有很高的摄取和滞留,给药后120 min时仍然达到(121.01±24.43)%ID/g,这说明18F-2在可能是经过肾脏进行代谢的。此外,19F-2在5 min之后骨的摄取明显增加,说明这个放射性示踪剂在体内不稳定,有明显的脱氟现象。
目前已报道的18F标记的且被广泛研究的PET心肌灌注显像剂主要分为两大类,一类是18F标记的哒嗪酮类衍生物,这类化合物具有代表性的是BMS747158-02以及18F-FP2OP。BMS747158-02是一个脂溶性的化合物, 与心脏内的 MC-I 靶向结合,同时在体内和体外都有很好的稳定性,在多种物种体内表现出良好的生物性能,目前BMS-747158-02 PET心肌灌注示踪剂已经进入临床Ⅲ期实验[4]。18F-FP2OP为电中性脂溶性的化合物,具有成为PET心肌灌注显像剂的潜力。该示踪剂在小鼠中有很高的心肌摄取,注射后2 min,初始心肌摄取为(41.90±4.52)%ID/g,靶与非靶比较高,在初始 2 min 时,18F-FP2OP的心与肝、心与肺和心与血放射性摄取比分别为6.83、9.49和35.74。中华小型猪的PET显像表明,心肌轮廓在注射后 5 min、 15 min、30 min和60 min时都很清晰。尽管[18F]FP2OP的心肌灌注显像效果很好,但体内外的稳定性较差,因此还需要进一步的研究[4]。另一类是18F标记的亲脂性阳离子类化合物,具有代表性的是18F标记的三苯基鏻正阳离子心肌灌注显像剂。由于线粒体具有高达180 mV的跨膜电位,该类示踪剂亲脂性可以使其以被动扩散的方式穿过膦脂双分子层进入细胞,然后通过线粒体的跨膜电位富集于线粒体而在心肌浓集[9]。其中以18F-FTPP和18F-FBnTP研究的最为深入,但存在制备步骤多、合成时间长、标记产率低、肝本底偏高、清除缓慢的缺点。例如,18F-FTPP的合成时间大约2 h,衰变校正后产率约为10%[7];18F-FBnTP的制备需要4步反应且操作复杂,总的合成时间大约为82 min,衰变校正后产率约仅有6%[8]。对于18F-FTPP来说,其大鼠生物分布和大鼠显像表明,该化合物心脏摄取很快,且有很稳定的滞留,可以持续至少1 h。因此大鼠注射18F-FTPP后1 h的心脏摄取可以达到1.57%ID/g,而心与血、心与肺和心与肝放射性摄取比分别为75、4和8,未进行更深入的研究。18F-FBnTP在显像方面其表现出了更好的生物性能,属于代谢稳定的示踪剂,其在体内仅有很小的脱氟现象。18F-FBnTP因其快速的无创伤检测和灌注缺损评价的灵敏度将会成为最有潜力的心肌灌注显像剂。但是二者繁琐的合成步骤和较低的放化产率导致临床推广受到极大的限制[6,9]。而本研究所采用的一锅法标记策略,使得标记过程得以简化,缩短了反应时间,同时标记率也大幅提高,成功制备了18F-FMBTP以及18F-mFMBTP[9],本研究成功制备了示踪剂18F-2,有利于进行进一步深入研究。
与不含取代基的三苯基鏻正阳离子心肌灌注显像剂、如18F-FBnTP相比,甲氧基的引入使得示踪剂在肝中的摄取显著降低。给药后60 min,18F-FBnTP在肝中的摄取为(8.09±3.9)%ID/g,心与肝摄取比1.50[10];而18F-2给药后60 min的肝摄取值为(5.99±0.94)%ID/g,心与肝摄取比可到达3.99,为18F-FBnTP的两倍,有利于得到清晰的显像效果。与18F-FMBTP以及18F-mFMBTP相比,在三苯基膦部分采用甲氧基进行修饰可以增加该类示踪剂的初始心肌摄取,如在小鼠体内注射后2 min,18F-2的心肌摄取为(53.88±7.45)%ID/g,远高于18F-FMBTP的(25.24 ± 2.97)%ID/g以及18F-mFMBTP的(31.02 ± 0.33)%ID/g。在经甲氧基修饰之后18F-2的肝清除速率也高于18F-FMBTP以及18F-mFMBTP,在30 min,60 min和120 min,18F-2的肝清除率分别为 91%, 96%, 98%,优于18F-FMBTP的57%,84%,94%以及18F-mFMBTP的57%,84%,93%[9]。尽管18F-2具有较高的心肌摄取,以及较快的非靶组织清除性能,但同时也存在体内稳定性差,严重的脱氟现象导致骨摄取高的缺点。这可能是由于18F-2分子中在苯环邻位为甲氧基,与不经修饰的18F-FBnTP、18F-FTPP、18F-FMBTP和18F-mFMBTP相比,甲氧基的推电子作用,以及整个分子的共轭效应导致C-F键不稳定[9],18F-2小鼠体内的骨摄取随着注射后时间的增加逐渐增加。这说明三苯基膦苯环取代基的数量、位置和性能对三苯基鏻正阳离子类心肌灌注显像剂的生物性能有较大影响。但是18F-FMBTP和18F-mFMBTP在大鼠以及比格犬中并没有观察到明显的骨摄取,因此18F-2小鼠体内骨摄取的异常情况还需要在后续工作中进行更深入的研究。
3 结论
通过一锅法制备得到了一种含甲氧基的新型18F标记的鏻正阳离子心肌灌注显像剂18F-2。该标记化合物为脂溶性配合物,具有很高的放化纯度(>95%)和较好的体外稳定性。 初步的生物性能研究结果显示,18F-2具有较高的心肌初始摄取和良好的滞留,且在肝、肺、血等非靶组织中清除较快。这说明苯环取代基甲氧基的引入三苯基鏻正阳离子类心肌灌注显像剂的生物性能有较大影响,利于肝、肺等非靶组织的清除,得到清晰的心肌灌注显像。上述研究结果为进一步研制得到新的、性能优良的三苯基鏻正阳离子类心肌灌注显像剂奠定了一定的理论和实验基础。
参考文献:
[1] Bengel F M, Higuchi T, Javadi MS, et al. Cardiacpositron emission tomography[J]. Journal of the American College of Cardiology, 2009, 54(1): 1-15.
[2] Siegrist P T, Husmann L, Knabenhans M, et al.13N-ammonia myocardial perfusion imaging with a PET/CT scanner: impact on clinical decision making and cost-effectiveness[J]. European Journal of Nuclear Medicine Molecular Imaging, 2008, 35: 889-895.
[3] Sampson U K, Dorbala S, Limaye A, et al. Diagnostic accuracy of rubidium-82 myocardial perfusion imaging with hybrid positron emission tomography/computed tomography in the detection of coronary artery disease[J]. Journal of American College of Cardiology, 2007, 49: 1 052-1 058.
[4] Mou T, Jing H, Yang W, et al. Preparation and biodistribution of [18F] FP2OP as myocardial perfusion imaging agent for positron emission tomography[J]. Bioorganic &Medicine Chemistry, 2010, 18: 1 312-1 320.
[5] Kim D Y, Kim H J, Yu K H, et al. Synthesis of [18F]-labeled (6-fluorohexyl) triphenylphosphonium cation as a potential agent for myocardial imaging using positron emission tomography[J]. Bioconjugate Chemistry, 2012, 23: 431-437.
[6] Cheng Z, Subbarayan M, Chen X, et al. Synthesis of (4-[18F] fluorophenyl) triphenylphosphonium as a potential imaging agent for mitochondrial dysfunction[J]. Journal of Labelled Compounds and Radiopharmaceuticals, 2005, 48: 131-137.
[7] Shoup T M, Elmaleh D R, Brownell AL, et al. Evaluation of (4-[18F] Fluorophenyl) triphenylphosphonium ion. A potential myocardial blood flow agent for PET[J]. Molecular Imaging and Biology, 2011, 13: 511-517.
[8] Ravert H T, Madar I, Dannals R F, Radiosynthesis of 3-[18F] fluoropropyl and 4-[18F] fluorobenzyl triarylphosphonium ions[J]. Journal of Labelled Compounds and Radiopharmaceuticals, 2004, 47: 469-476.
[9] Zhao Z, Yu Q, Mou T, et al. Highly Efficient One-Pot Labeling of New Phosphonium Cations with Fluorine-18 as Potential PET Agents for Myocardial Perfusion Imaging[J]. Molecular Pharmaceutics, 2014, [s. n.].
[10] Madar I, Ravert H, Nelkin B, et al.Characterization of membrane potential-dependent uptake of the novel PET tracer18F-fluorobenzyl triphenylphosphonium cation[J]. European Journal of Nuclear Medicine Molecular Imaging, 2007, 34: 2 057-2 065.

