新生儿前掩蔽听性脑干反应的特征分析
薛俊芳 王素环 李明 李星 陈丽 刘玉和
自然界的声音都不是单独存在的,为了更好地评估听觉过程,研究掩蔽条件下的听觉过程更有意义[1]。间隔时间很短的两个声音相继作用时,前一个声音对后一个声音的反应会产生前掩蔽。前掩蔽可以更好的评估新生儿听觉系统的发育[2]。本研究拟通过分析听力正常新生儿不同时间间隔前掩蔽条件下听性脑干反应(ABR)的特征,为新生儿前掩蔽ABR提供正常参考值。
1 资料与方法
1.1研究对象 研究对象为2011年2~6月在北京大学第一医院耳鼻咽喉-头颈外科听力中心进行检查的听力正常新生儿30例60耳,男19例(38耳),女11例(22耳),出生0~5天。所有受试者气导ABR阈值≤30 dB nHL。
1.2前掩蔽ABR测试方法 测试在标准隔声电屏蔽室内进行,室内噪声小于20 dB A,采用丹麦MCU-90型诱发电位仪进行测试,纽扣式电极,耳机为3A插入式气导耳机。所有受试儿均为睡眠时测试,记录电极置于前额正中发际处,参考电极置于同侧乳突,电极阻抗均≤5 kΩ。刺激信号为交替极性短声,分析时间均为10 ms,刺激重复率11.1次/秒,叠加次数1 024次,刺激强度80 dB nHL。掩蔽声为同侧耳机给声,性质与刺激声一致,为80 dB nHL的click声,掩蔽声与刺激声的时间间隔分别是4、8、16、32 ms,分别记录不同时间间隔前掩蔽的ABR波形。以无掩蔽的常规ABR作为对照。
1.3统计学方法 应用SPSS 13.0软件包进行统计分析,采用重复测量方差分析法比较波潜伏期及波间期的差异;两两比较采用LSD检验。
2 结果
本研究30例60耳常规无掩蔽、4、8、16、32 ms间隔前掩蔽的ABR各波潜伏期及波间期见表1、图1。可见,除掩蔽间隔4 ms的波Ⅲ潜伏期及Ⅰ-Ⅲ波间期外(P>0.05),其余不同间隔时间(4、8、16、32 ms)前掩蔽条件下的波潜伏期及波间期均较常规ABR延长(P<0.01),其中掩蔽间隔8 ms时波Ⅲ潜伏期(P<0.001)、波Ⅴ潜伏期(P<0.01)及Ⅰ-Ⅲ波间期(P<0.001)、Ⅰ-Ⅴ(P<0.05)波间期延长最明显。
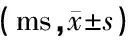
表1 不同间隔时间前掩蔽下的ABR波潜伏期及波间期
注:与常规无掩蔽ABR相应波潜伏期及波间期比较,P>0.05
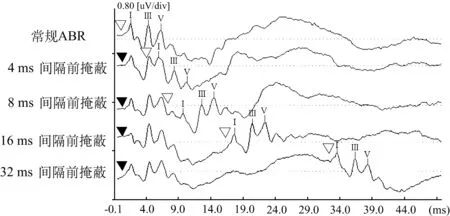
图1 不同时间间隔前掩蔽下的ABR波形
3 讨论
早在1972年Jewett[3]用重复刺激声分别刺激不成熟和成熟动物的听觉器官,记录到了不同的ABR。Lasky等[4]研究了新生儿及成人的ABR掩蔽效应,发现新生儿的前掩蔽ABR波潜伏期较成人明显延长,而后掩蔽对ABR的波潜伏期无明显影响。Lasky[1]进一步研究了前掩蔽及10次/秒和50次/秒刺激速率click声对新生儿及成人ABR的影响,发现前掩蔽比速率效应更明显地使ABR阈值升高、波Ⅴ潜伏期延长,并且新生儿较成人更加明显。因此,前掩蔽ABR可以用于研究脑干听觉通路的成熟差异性,更好地评估新生儿的听力发育情况[1,2]。
本研究结果显示前掩蔽时间间隔4、8、16、32 ms条件下的ABR各波潜伏期及波间期延长,其中间隔时间为8 ms时最为明显,且波形重叠影响较小,与以往的研究一致。Lasky[2]研究了无掩蔽及前掩蔽时间间隔分别为10、20、30 ms的ABR波Ⅴ潜伏期变化(刺激率为10次/秒),结果发现掩蔽间隔为10 ms时其ABR波Ⅴ潜伏期延长最明显,30 ms时差异最小。这与本研究结果一致。Lasky[4]研究表明掩蔽刺激时间间隔大于100 ms时 ABR的速率效应不明显,他对多序列的刺激多用10 ms间隔,是为了消除波形的重叠[5]。本研究也观察到前掩蔽间隔为4 ms时ABR波形较难辨认。当然,前掩蔽ABR的波形除了与掩蔽刺激时间间隔有关外,还与刺激强度、掩蔽声/刺激声强度比及掩蔽持续时间相关[1,6,7]。
前掩蔽ABR的波形变异机制至今不十分清楚。Lasky[2]认为前掩蔽之所以引起ABR的变化,是因为听觉传导通路上细胞的不适应造成。从不适应到适应的过程分为快速阶段和慢速阶段,慢速阶段取决于是否有足够的时间从掩蔽刺激中恢复,在快速阶段成人与新生儿无明显差别,但在慢速阶段成人比新生儿恢复较快。Shore等[8]认为前掩蔽是掩蔽声对耳蜗神经及耳蜗核产生了短暂的反应抑制,这不仅仅是神经适应及时间整合的外周机制,还有耳蜗核及上橄榄核的抑制通路的参与。Backoff等[9]的动物实验证实抑制性神经递质甘氨酸及γ-氨基丁酸参与了耳蜗核抑制反应。Polyakov[10]总结认为前掩蔽及高刺激率的ABR波形变异,可能是由于突触同步化的减少,或是传入信息的短暂分散、初级传入神经纤维兴奋的数量改变造成。
总之,前掩蔽ABR可以更好地评估新生儿听觉发育状况,其波潜伏期及波间期延长与掩蔽刺激间隔时间相关,掩蔽刺激间隔时间8 ms(强度80 dB nHL)更适宜新生儿前掩蔽ABR的记录。
4 参考文献
1 Lasky RE. The effects of rate and forward masking on human adult and newborn auditory evoked brainstem response thresholds[J]. Developmental Psychobiology,1991,24:051.
2 Lasky RE. Rate and adaptation effects on the auditory evoked brainstem response in human newborns and adults[J]. Hear Res,1997 ,111:165.
3 Jewett D, Romano J. Neonatal development of auditory system potentials averaged from the scalp of rat and cat[J]. Brain Res,1972,36:89.
4 Lasky RE, Rupert A. Temporal masking of auditory evoked brainstem responses in human newborns and adults[J]. Hear Res,1982,6:315.
5 Lasky RE, Shi Y, Hecox KE. Temporal masking of human auditory evoked brain stem responses using two simultaneously presented maximum length sequences[J]. Ear Hear,1993,14:183.
6 Supin AY, Nachtigall PE, Breese M. Evoked-potential recovery during double click stimulation in a whale: a possibility of biosonar automatic gain control[J]. J Acoust Soc Am,2007,121:618.
7 Walton J, Orlando M, Burkard R. Auditory brainstem response forward-masking recovery functions in older humans with normal hearing[J]. Hear Res,1999, 127: 86.
8 Shore SE. Recovery of forward-masked responses in ventralcochlear nucleus neurons[J]. Hear Res, 1995,82:31.
9 Backoff PM,Shadduck Palombi P,Caspary DM. Glycinergic and GAB Aergic inputs affect short-term suppression in the cochlear nucleus[J]. Hear Res,1997,110:155.
10 Polyakov A, Pratt H. The cumulative effect of high click rate on monaural and binaural processing in the human auditory brainstem[J]. Clin Neurophysiol, 2003,114:366.

