中药七叶灵颗粒逆转肺腺癌细胞耐药机制研究*
董 昀,张 铭△,沙慧芳,杨晓华,金长娟
(1.上海交通大学附属胸科医院中西医结合科,上海 200030;2.上海交通大学附属胸科医院肿瘤研究所,上海 200030)
肺癌已经成为全球范围内发病率和死亡率最高的恶性肿瘤,严重威胁人类生命健康,确诊后5年生存率仅15%左右。化疗是治疗肺癌的主要手段之一,而肺癌细胞多药耐药(multidrug resistance,MDR)的出现大大降低了其疗效[1],能否有效地逆转肺癌细胞的MDR已成为影响治疗成功的关键因素之一。越来越多的研究表明,中药逆转肿瘤细胞MDR具有潜在的优势。中药七叶灵颗粒是在中医辨证论治基础上研制的抗肿瘤药物。前期研究表明,中药七叶灵颗粒组方不仅有抑瘤作用,同时还能减轻化疗副作用,促进肿瘤细胞凋亡,升高白细胞[2~4]。我们将MDR-1基因导入小鼠Lewis肺癌细胞株(3LL),建立了能稳定表达P-gP并对泰素、长春生物碱类、鬼臼毒素类药物具有显著耐药性的细胞株(3LL-MDR-1)[5]。在体外实验中观察到,中药七叶灵颗粒对Lewis肺癌耐药细胞株3LL-MDR-1具有逆转作用[6~9]。本研究通过体内实验,利用Lewis肺腺癌细胞(3LL)和Lewis肺癌耐药细胞(3LLMDR-1)构建裸小鼠皮下移植瘤模型,探讨中药七叶灵颗粒逆转肺癌细胞耐药的相关机制。
1 材料与方法
1.1 材料
1.1.1 实验药物 中药七叶灵颗粒组成:生黄芪30 g,黄精30 g,天花粉30 g,女贞子15 g,灵芝15 g,石见穿30 g,七叶一枝花 20 g,山慈菇 15 g,骨碎补30 g,陈皮9g,由上海交通大学附属胸科医院生产(沪卫药剂)。蒸馏水溶解,每毫升含生药2 g,4℃保存。泰素(Taxol)由施贵宝公司生产,临时配置为1 mg/ml水溶液。
1.1.2 源细胞株 Lewis肺癌细胞(3LL)、Lewis肺癌耐药细胞(3LL-MDR-1)为上海市胸科医院肿瘤实验室提供。
1.1.3 实验动物 BALB/C-nu/nu雄性裸鼠80只,6周龄(16±2)g,饲养于上海市胸科医院肿瘤实验室实验中心SPF级动物房,室温25℃,湿度70%,自由进食与饮水。
1.2 方法
1.2.1 细胞培养 复苏后的Lewis肺癌细胞(3LL)和Lewis肺癌耐药细胞(3LL-MDR-1)用含10%FBS的RPMI-1640培养基,在37℃ 5%CO2饱和湿度条件下传代培养。传代时,用0.25%的胰蛋白酶消化细胞按1∶3比例传代。
1.2.2 建立裸小鼠皮下移植瘤模型 将3LL和3LL-MDR-1细胞株扩大培养后,胰酶消化收集细胞。PBS洗涤,调整细胞浓度为10×106/0.1ml,注射于裸鼠右腋部皮下。
1.2.3 动物分组及给药 造模后的动物按随机数字表法分为模型组、七叶灵组、化疗组和七叶灵+化疗组,每类细胞株4组,每组10只。2周后观察到裸鼠皮下有结节长出后即开始给药,给药剂量根据人数体表面积折合法计算。再将每组裸鼠随机分为A组和B组。A组给药时间为14 d,B组给药时间为28 d。
①模型组:生理盐水0.3 ml每日灌胃1次;A组14 d,B组28 d;②七叶灵颗粒组:七叶灵颗粒0.3 ml(含生药0.6 g)每日灌胃1次;A组14 d,B组28 d;③化疗组:第 1、3、5 天 Taxel溶液 0.5 ml(含Taxel 0.5 mg)腹腔注射,生理盐水0.3 ml每日灌胃1次;A组14 d,B组28 d;④七叶灵颗粒+化疗组:第1、3、5 天 Taxel溶液 0.5 ml(含 Taxel 0.5 mg)腹腔注射,七叶灵颗粒0.3 ml(含生药0.6 g)每日灌胃1次;A组14 d,B组28 d。
1.2.4 标本制备 实验各组停药后第2天,即第15天、第29天脱颈椎处死荷瘤裸鼠,剥离瘤块、剔除筋膜,置于冻存管内,迅速放入液氮中保存。
1.2.5 各组瘤重和肿瘤抑制率 各组瘤重用电子天平称重;抑瘤率按下列公式计算:抑瘤率(%)=(模型组平均瘤重-实验组平均瘤重)/模型组平均瘤重×100%。
1.2.6 Real-time Quantitative PCR检测肿瘤细胞中耐药相关基因MDR-1、MRP、LRP的mRNA表达 根据试剂盒的操作顺序,Total RNA提取和鉴定后合成cDNA。PCR反应各个基因的引物序列及分析条件见下表。混匀后分成3份,每个样品做3个重复对照。上机扩增检测。在PCR任意循环中,当荧光强度值大于由仪器自带软件计算出的阈值(threshold value,CT)时,样本被认为阳性,mRNA 表达量用2-△CT表示(2-△CT即比值,△CT由CT值减去GAPDH的CT值),实验重复测量3次,取比率的平均值作为最后表达水平。引物序列如下:MDR-1:sense:5'-CTTCACCCAGGCCATGATGT-3',anti-sense:5'-GGCACCA AA GA CA ACAGCAG-3';MRP:sense:5'-GCGCTGTCTATCGTAAGGCT-3',anti-sense:5'-AGAGGGGCTGACCAGATCAT-3';LRP:sense:5'-GTATCCCC ATGAGC TGGACG-3',anti-sense:5'-GCAGAACTTGTTGCAGTGGG-3';GAPDH:sense:5'-GGCAAATTCAACGGCACAGT-3',anti-sense:5'-GTCTCG CTCCTGG AAG ATGG-3'。
表1 3LL模型各组裸鼠皮下移植瘤瘤重及抑瘤率(s)

表1 3LL模型各组裸鼠皮下移植瘤瘤重及抑瘤率(s)
注:与模型组比较:*P<0.05;与七叶灵颗粒组比较:△P<0.05
组别A组(14 d)B组(28 d)例数 瘤重(g)抑瘤率(%)例数 瘤重(g)抑瘤率(%)模型组53.3
1.2.7 Western-blot检测瘤细胞中耐药相关基因MDR-1、MRP、LRP的蛋白表达 蛋白质抽提和浓度测定A562,根据标准曲线计算出蛋白浓度。将准备好的样品和蛋白质marker分别上样、电泳。取出凝胶,去除所有浓缩胶,将凝胶浸入转移缓冲液中5 min。准备好膜后,将膜置于反应盒中(印迹蛋白的一面朝上),加0.5 ml丽春红染色30 s,观察转印效果。去除染液,双蒸水洗膜3次,每次5 min。在TBST中加入脱脂奶粉至终浓度为5%(w/v),封闭时,将膜浸入到封闭液中,室温下振荡1 h。加入稀释好的一抗抗体(1∶500),4℃过夜。TBST洗膜3次(每次5 min)。加入稀释好的二抗抗体(1∶5000),室温1 h振荡孵育。TBST洗膜3次(每次5 min)。洗好膜以后,取出ECL发光试剂,取A液和B液各1ml混合。将膜放入曝光仪器中,滴加发光液,曝光3次,每次5 min,选择3次曝光的重叠值。同时以各个细胞蛋白中GAPDH作为内参照,通过与内参照的比较确定MDR-1、MRP、LRP相对表达水平。
1.3 统计学方法
采用SPSS 16.0统计软件进行统计分析,以方差分析检验各组均数间的差异性,P<0.05为差异有统计学意义。
2 结果
2.1 七叶灵颗粒对裸鼠皮下移植瘤生长影响
3LL皮下移植瘤模型中,A组(14 d后):七叶灵颗粒组、化疗组、七叶灵颗粒+化疗组瘤重均低于模型组,差异有统计学意义(P<0.05),其中七叶灵颗粒+化疗组瘤重最小,抑瘤率为34.5%;B组(28 d后):七叶灵颗粒组、化疗组、七叶灵颗粒+化疗组瘤重也均低于模型组,差异有统计学意义(P<0.05),其中七叶灵颗粒+化疗组瘤重最小,抑瘤率为53.3%。
表1、2显示,3LL-MDR-1皮下移植瘤模型中,A组(14 d后):七叶灵颗粒组、化疗组、七叶灵颗粒+化疗组瘤重均低于模型组,差异有统计学意义(P<0.05),其中七叶灵颗粒+化疗组瘤重最小,抑瘤率为34.8%;B组(28 d后):七叶灵颗粒组、化疗组、七叶灵颗粒+化疗组瘤重也均低于模型组,差异有统计学意义(P<0.05),其中七叶灵颗粒+化疗组瘤重最小,抑瘤率为23.7%。
表2 3LL-MDR-1模型各组裸鼠皮下移植瘤瘤重及抑瘤率(s)

表2 3LL-MDR-1模型各组裸鼠皮下移植瘤瘤重及抑瘤率(s)
注:与模型组比较:*P<0.05;与七叶灵颗粒组比较:△P<0.05
组别A组(14 d)B组(28 d)例数 瘤重(g)抑瘤率(%)例数 瘤重(g)抑瘤率(%)模型组23.7
2.2 七叶灵颗粒对3LL模型中耐药相关基因MDR-1、MRP和LRP表达的影响
A组(14 d后):七叶灵颗粒组的MDR-1、MRP、LRP基因mRNA表达水平均低于模型组,差异有统计学意义(P值分别为P<0.01、P<0.001和P<0.001);化疗组的MDR-1、MRP、LRP基因 mRNA表达水平均低于模型组,差异有统计学意义(P值均为P<0.001);七叶灵颗粒 +化疗组的 MDR-1、MRP、LRP基因mRNA表达水平均低于模型组,差异有统计学意义(P值均为P<0.001);七叶灵颗粒组、化疗组、七叶灵颗粒+化疗组的MDR-1、MRP、LRP蛋白表达与模型组比较均下调。
B组(28 d后):七叶灵颗粒组的MDR-1、MRP、LRP基因mRNA表达水平均低于模型组,差异有统计学意义(P值均为P<0.001);化疗组的MDR-1、MRP、LRP基因mRNA表达水平均低于模型组,差异有统计学意义(P<0.001、P<0.01和P<0.05);七叶灵颗粒 +化疗组的 MDR-1、MRP、LRP基因mRNA表达水平均低于模型组,差异有统计学意义(P值均为P<0.001);七叶灵颗粒组、化疗组、七叶灵颗粒+化疗组的MDR-1、MRP、LRP蛋白表达与模型组比较均下调(图1、图2)。

图1 不同干预对3LL模型MDR-1、MRP、LRP基因mRNA表达的影响
2.3 七叶灵颗粒对3LL-MDR-1模型中耐药相关基因MDR-1、MRP和LRP表达的影响

图2 不同干预对3LL模型MDR-1、MRP和LRP基因蛋白表达的影响
A组(14 d后):七叶灵颗粒组和七叶灵颗粒+化疗组的MDR-1基因mRNA表达水平明显低于模型组,差异有统计学意义(P<0.05);化疗组的MDR-1基因mRNA表达水平与模型组比较,差异无统计学意义。七叶灵颗粒+化疗组的MRP基因mRNA表达水平低于模型组,差异有统计学意义(P<0.01);化疗组的MRP基因mRNA表达高于生理盐水,差异有统计学意义(P<0.05),七叶灵颗粒组的MRP基因mRNA表达水平与模型组比较,差异无统计学意义。七叶灵颗粒+化疗组的LRP基因mRNA表达水平低于模型组,差异有统计学意义(P<0.01);七叶灵颗粒组和化疗组的 LRP基因mRNA表达水平与模型组比较,差异无统计学意义,各组蛋白表达水平的变化与mRNA表达水平变化相一致。
B组(28 d后):七叶灵颗粒组和七叶灵颗粒+化疗组的MDR-1基因mRNA表达水平低于模型组,差异有统计学意义(P<0.01和P<0.001);化疗组的MDR-1基因mRNA表达水平高于模型组,差异有统计学意义(P<0.01);七叶灵颗粒组和七叶灵颗粒+化疗组的MRP基因mRNA表达水平低于模型组,差异有统计学意义(P<0.05和P<0.001);化疗组的MRP基因mRNA表达水平高于模型组,差异有统计学意义(P<0.05);七叶灵颗粒+化疗组的LRP基因mRNA表达水平低于模型组,差异有统计学意义(P<0.05);七叶灵颗粒组和化疗组的LRP基因mRNA表达水平与模型组比较,差异无统计学意义,各组蛋白表达水平的变化与mRNA表达水平变化相一致(图3、图4)。
3 讨论
肿瘤的多药耐药(MDR)已成为影响肿瘤化疗成功与否的关键因素[10]。MDR的形成机制非常复杂。目前研究报道显示,MDR可能与P糖蛋白(P-gp)、多药耐药相关蛋白(MRP)的表达及活性改变有关[11~14]。同一肿瘤细胞 MDR可能由其中几种机制共同介导,而化学逆转剂往往只能针对其中一种机制进行逆转,因而逆转效率不高[15];而中药复方制剂作为耐药性肿瘤逆转剂,具备成本低、毒性小、安全范围大、广谱性强、作用靶点多等诸多优势,还可减轻放化疗的不良反应[16],耐药性肿瘤逆转剂的研究正越来越受到国内外学者的广泛关注。

图3 不同干预对3LL-MDR-1模型MDR-1、MRP、LRP基因mRNA表达的影响
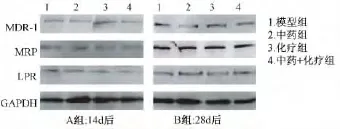
图4 不同干预对3LL-MDR-1模型MDR-1、MRP、LRP基因蛋白表达的影响
中药七叶灵颗粒是在中医辨证论治基础上研制的抗肿瘤药物,其组方不仅有抑瘤作用,同时还能减轻化疗副作用,增加肿瘤细胞凋亡,升高白细胞[2]。七叶灵颗粒由生黄芪、黄精、天花粉、女贞子、灵芝、石见穿、七叶一枝花、山慈菇、骨碎补、陈皮组成。方中黄芪性味甘温,善补肾气。“黄芪……补诸虚不足……益元气(为肾所藏)”;黄精性味平和,擅长填精,补诸虚……填精髓,“两者共为君药;女贞子滋阴养血,天花粉养阴生津,骨碎补强髓坚骨,三药并用增强生黄芪、黄精之力,同为臣药;石见穿、七叶一枝花、山慈菇清热消肿、软坚散结、驱邪扶正为佐药;陈皮理气、健脾、燥湿化痰、调和诸药为使药。诸药共奏补肾填精生髓之功。该药已在临床使用10余年,疗效可靠,已开展和完成了多项研究,临床研究显示其具有良好的抗肿瘤效果,可提高晚期肺癌的生存率、中位生存期、近期疗效及生活质量[3,4]。
前期体外研究发现,中药七叶灵颗粒对Lewis肺癌耐药细胞株 3LL-MDR-1 具有逆转作用[6~9]。本研究利用3LL和3LL-MDR-1细胞株制备裸小鼠皮下移植瘤模型,通过体内实验,进一步研究中药七叶灵颗粒逆转3LL-MDR-1细胞的多药耐药机制。
随着实验的进展我们观察到,裸鼠皮下出现结节,逐渐增大,甚者出现坏死,并可观察到裸鼠出现进食减少、消瘦、行动迟缓、喜扎堆、活动减少等,符合恶性肿瘤晚期的临床表现,尤以模型组更甚。本研究结果显示,在3LL模型中,药物干预各组皮下移植瘤的质量、大小明显小于模型组,抑瘤率尤以七叶灵颗粒+化疗组最大,并随着时间的增加,抑瘤率随之增加。在3LL-MDR-1模型中,药物干预各组的皮下移植瘤质量、大小明显小于模型组,抑瘤率尤以七叶灵颗粒+化疗组最大。由此说明,七叶灵颗粒可以有效地抑制肿瘤生长,并可有效地配合化疗药物,对抑制肿瘤生长有协同作用;在肿瘤耐药的情况下,同样能够协同化疗药物起到抑制肿瘤生长的作用。
肿瘤的多药耐药(multidrug resistance,MDR)是指肿瘤细胞对分子结构不同、作用机制各异的抗肿瘤药物产生交叉耐药,是目前所知肿瘤化疗失败的最重要原因[17]。目前研究证实,多数肿瘤多药耐药的发生是通过多药耐药基因(multidrug resistance 1,MDR1)和多药耐药相关蛋白基因(multidrug resistance-associated protein,MRP)以及肺耐药蛋白基因(lung resistance protein,LRP)编码的相应蛋白,利用药泵作用将药物排出肿瘤细胞外或者改变药物在细胞内分布而导致耐药[18]。这3个耐药基因的过度表达是肿瘤细胞产生多药耐药的主要原因,而MDR1的过度表达则被认为是肿瘤多药耐药的最重要机制[19,20]。MDR1是具有能量依赖性药泵功能的跨膜糖蛋白,可主动将进入细胞内的抗癌药物泵出细胞外,降低细胞内药物的浓度并产生耐药[21]。MRP基因编码表达ATP能量依赖性跨膜糖蛋白泵分子Pgp-190,该蛋白能将疏水性化疗药物逆浓度差泵出细胞外,减少细胞内药物蓄积,导致耐药发生。LRP为人的弯隆体主蛋白(MVP),通过调节囊泡和核质的药物转运,将化疗药物储存于囊泡并减少其在核与胞质间的比例而致耐药。
在本实验研究的3LL模型中,药物干预各组的MDR-1、MRP、LRP呈明显下调,并与模型组比较差异有统计学意义。且随着药物干预时间的增加,七叶灵颗粒组和七叶灵颗粒 +化疗组的 MDR-1、MRP、LRP基因表达水平表现出降低趋势,说明七叶灵颗粒组和七叶灵颗粒+化疗组能有效降低多药耐药相关基因的表达,防止肿瘤细胞多药耐药的产生。而化疗组的MDR-1、MRP、LRP基因表达水平呈逐渐升高趋势,说明随着时间的增长,肿瘤细胞逐渐对化疗产生耐药性,这也是3LL-MDR-1细胞株产生的基本原理[8,10]。
在3LL-MDR-1模型中,化疗组 MDR-1、MRP、LRP基因mRNA及蛋白呈高表达状态,并随着治疗时间的增加呈逐渐升高趋势,说明3LL-MDR-1耐药细胞株存在明显的耐药性,并随着化疗时间的增加耐药性更加明显,这也与临床上化疗时间越长,肿瘤细胞越易出现耐药现象相符。治疗28 d后,七叶灵颗粒组和七叶灵颗粒+化疗组中MDR-1基因和MRP基因的表达明显较模型组下降,且相较于14 d出现明显下调,尤以七叶灵颗粒+化疗组最为明显。LRP基因较模型组也出现下调,但未见其随着时间出现明显的变化,说明七叶灵颗粒能下调耐药相关基因表达,并随着用药时间的增长,其作用愈加明显。配合化疗药使用后,其抑制肿瘤及下调耐药相关基因表达的作用更加明显,进一步说明七叶灵颗粒具有逆转化疗耐药、对化疗药物有增敏协同的作用。
本研究结果表明,中药七叶灵颗粒可逆转3LLMDR-1细胞的多药耐药,其作用机制可能与下调多药耐药相关基因MDR-1、MRP和LRP的表达有关。临床上应用中药七叶灵颗粒结合化疗治疗可能抑制化疗药物的多药耐药,从而提高化疗疗效。
[1]Collateral sensitivity as a strategy against cancer multidrug resistance.Pluchino KM,Hall MD,Goldsborough AS,Callaghan R,Gottesman MM[J].Drug Resist Updat,2012,15(1-2):98-105.
[2]崔清,王少墨,郭毅峻,等.“七叶灵”颗粒配合化疗治疗晚期肺癌临床研究[J].上海中医药杂志,2007,41:14-16.
[3]崔清,金长娟.“七叶灵”颗粒抑制H460细胞生长和转移作用靶点的实验研究[J].中国中医药现代远程教育,2009,76:157-160.
[4]金长娟,沙慧芳,赵兰香,等.七叶灵方诱导裸鼠人肺腺癌A549移植瘤细胞凋亡的实验研究[J].中西医结合学报,2004,2:285-288.
[5]沙慧芳,董强刚,苏建中,等.外源MDR-1基因对小鼠肺腺癌细胞耐药性产生的影响及机理研究[J].中国肺癌杂志,2000,3:34-38.
[6]沙慧芳,金长娟,苏建中.中药七叶灵对耐药细胞株的逆转研究[J].肿瘤防治杂志,2002,9:104-106.
[7]杨晓华,沙慧芳,冯久贤,等.人肺腺癌紫杉醇耐药细胞株的建立及特性研究[J].现代医学,2009,37:34-37.
[8]孙强玲,杨晓华,鲁静,等.紫杉醇耐药与敏感细胞的差异表达蛋白分析[J].中国肺癌杂志,2009,12:735-738.
[9]沙慧芳,孙强玲,杨晓华.紫杉醇肺癌细胞BNX动物耐药模型的建立[J].第二军医大学学报,2011,32:1296-1299.
[10]Huang C,Cao P,Xie Z.Relation of promoter methylation of mdr-1 gene and histone acetylation statuswith multidrug resistance in MCF-7/Adr cells[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2009,34:369-374.
[11]LuqmaniYA. Mechanisms ofdrug resistance in cancer chemotherapy[J].Med Princ Pract,2005,14:35-48.
[12]Amiri-Kordestani L,Basseville A,Kurdziel K,et al.Targeting MDR in breast and lung cancer:discriminating its potential importance from the failure of drug resistance reversal studies[J].Drug Resist Updat,2012,15(1-2):50-61.
[13]Lee SK,Shehzad A,Jung JC,et al.Protein kinase Cα protects against multidrug resistance in human colon cancer cells[J].Mol Cells,2012,34(1):61-69.
[14]Zhu WY,Hunag YY,Liu XG,et al.Prognostic evaluation of CapG,gelsolin,P-gp,GSTP1,and Topo-II proteins in nonsmall cell lung cancer[J].Anat Rec(Hoboken),2012,295(2):208-214.
[15]La Porta CA.Mechanism of drug sensitivity and resistance in melanoma[J].Curr Cancer Drug Targets,2009,9:391-397.
[16]韩硕,敖嫩,林昭静,等.肿瘤的中药治疗[J].中国实用医药,2010,5:158-159.
[17]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECISTguideline(version 1.1)[J].Eur J Cancer,2009,45:228-247.
[18]Li DQ,Wang ZB,Bai J,et al.Reversal of multidrug resistance in drug resistant human gastric cancer cell line SGC7901/VCR byantiprogestin drug mifepristone[J].World J Gastroenterol,2004,10:1722-1725.
[19]Soranzo N, CavalleriGL, WealeME, etal. Identifying candidate causal variants responsible for altered activity of the ABCB1 multidrugresistance gene[J].Genome Res,2004,14:1333-1344.
[20]Ponte-Sucre A.Availability and applications of ATP-binding cassette(ABC)transporter blockers[J].Appl Microbiol Biotechnol,2007,76:279-286.
[21]Baird NJ,Fang XW,Srividya N,et al,Sosnick TR.Folding of a universal ribozyme:theribonucleasePRNA[J].Q Rev Biophys,2007,40:113-161.

