对“化学平衡常数”教学的反思与探索
马夏君+张文华

摘要:讨论了高中化学安排“化学平衡常数”内容的多重意义。在反思基础上尝试调整“化学平衡常数”和“平衡移动理论”的教学顺序,引导学生由浓度商Q发现常数K的存在和特点,形成化学平衡常数概念;通过练习和应用丰富、发展学生对K的认识,为学生后续学习勒夏特列原理和转化率问题做准备,并由化学平衡常数引申到化学反应限度。
关键词:化学平衡常数;反思;探索;数据分析;教学设计
文章编号:1005–6629(2014)3–0037–04 中图分类号:G633.8 文献标识码:B
“化学平衡常数”位于人教版《化学反应原理》第二章第三节的第三板块[1]。第二章“化学反应速率和化学平衡”共4节内容,前两节是化学反应速率的相关内容,属于化学动力学范畴;后两节是化学平衡的相关内容,属于化学热力学范畴。化学平衡常数是热力学常数,用于定量表征化学反应限度,是新课程中的新增内容,课标明确提出的教学要求是“知道化学平衡常数的含义,能利用化学平衡常数计算反应的转化率”[2]。“化学平衡常数”的安排具有多重意义:其一,弄清其概念,能揭示平衡本质,利于学生深入地认识化学平衡及其移动的客观规律,增进对化学反应限度和化学平衡移动规律的理解;其二,掌握其计算,比较其与浓度商Q的关系,能帮助学生掌握判断平衡移动方向的方法与思路,而这二者是“化学反应限度”的学习难点,也是后续溶液中的离子平衡等内容学习的基础;其三,化学平衡常数是基于实验数据分析形成的概念,由浓度商Q到化学平衡常数K的过程,不但能为学生提供理性分析的思维“支架”,降低学习难度,还能反映化学研究的一种基本方法与思想,有助于实现新课程提升学生科学素养的宗旨。
对于“化学平衡常数”的教学,教师通常有不同的处理方式:多数教师继续以勒夏特列原理作为判断和解释平衡移动的核心原理,将化学平衡常数蜻蜓点水地带过,没有重视挖掘其功能和价值,以至于这个重要内容沦落为应对考试中相关计算的工具。不久前,笔者在湖北省武昌实验中学听了一位老师别具一格的授课:这位老师调整教材顺序,将“化学平衡常数”提前,作为理解平衡移动原理的基础。结果,在有关这部分内容的测评中这个班级成绩更优,在后续课程中,学生明显更易抓住平衡本质进行分析。这个情况的启示是:对“化学平衡常数”教学内容的安排和过程设计需要认真反思。
之后,笔者进一步发现,不少学者对化学平衡常数的促进学生认识发展功能及其教学实践做了深入研究,鲁科版以及国外AP课程[3][4]中均将“化学平衡常数”作为分析化学平衡的基础性工具,这些都对笔者本节课的教学探索提供了更为有力的支撑。基于此,笔者尝试按照新的思路来处理和设计这节课的教学,初步取得了令人满意的结果。现将有关做法简介如下:
1 学情分析
通过对化学平衡状态的学习,学生已经知道化学平衡具有“逆、等、动、定、变”5个基本特征,对于达到平衡状态的化学反应而言,各组分浓度不再变化。但是经过测量发现,学生容易形成“各组分浓度相等”等相异构想[5],表面上是学生对化学平衡认识不够深刻,实则是缺乏对化学平衡本质的认识。在科学探寻过程中,人们致力于发现各种现象的本质和规律。为此,需要通过对化学反应中各组分浓度变化的分析,引导学生归纳、总结出反映化学平衡本质的化学平衡常数K。
进入选修阶段的学生,其思维方式从具体发展至抽象,从重简单描述发展至重逻辑分析。经过必修阶段的学习,他们初步学会了科学探究的程序和方法,能够对大量数据所揭示的规律作出预测,并设计实验进行验证。这些科学素养奠定了本课学习的能力基础。
第三节“化学平衡”中共3个板块:可逆反应、化学平衡状态、化学平衡常数。必修阶段学生已经初步建立“可逆反应”、“化学平衡状态”和“化学平衡移动”3个概念;发展至选修4“化学反应原理”阶段,通过本章学习,进一步引导学生建立利用K、Q关系分析平衡移动的思路,进而以K为工具对第三章中的各类平衡进行分析,并使学生对化学反应限度的认识由定性认识上升到定量认识,由孤立地认识化学反应限度发展到关注环境的影响,由静态认识化学平衡上升到动态认识化学平衡[6]。
2 教学思路
笔者在调整“化学平衡常数”和“平衡移动理论”教学顺序的基础上形成下列思路:
第一步,引导学生通过量的研究来探究化学平衡时反应物和生成物的浓度是怎样相互影响的?这里有没有规律?
第二步,通过举例讨论,由最简单的例子到稍复杂的例子,引导学生由Q到K,发现K的存在和特点,概括形成平衡常数的数学定义式。
第三步,通过练习丰富、发展学生对K的发现和认识。
第四步,引导学生通过分析影响K的因素来发现勒夏特列原理。
第五步,通过练习、应用,由化学平衡常数引申到化学反应限度,为后续学习转化率问题做好准备。
3 教学目标
3.1 知识与技能目标
(1)理解化学平衡常数K的概念,并弄清化学平衡常数的影响因素;
(2)能正确书写给定反应的平衡常数的表达式;
(3)通过K、Q比较,了解化学平衡常数的特点、移动的原因及规律;
(4)初步了解许多化学反应是有限度的。
3.2 过程与方法目标
(1)通过分析数据,养成获取和处理数量信息的能力,以及分析推理能力;
(2)通过定量计算,判断平衡移动的方向,强化变量控制的思想,并逐步形成利用数学工具解决问题的能力;
(3)进一步了解、体会化学研究的方法与思想。
3.3 情感、态度与价值观目标
(1)通过学习,激发对事物发展本质和规律的探索精神;
(2)通过数据分析和实验验证,初步形成实事求是的科学研究精神和关注数量的习惯;
(3)通过解决实际生活问题,体会调控化学平衡在生活、生产和科学研究领域中的作用,树立运用科学改善生活、服务社会的信念。
4 教学过程设计
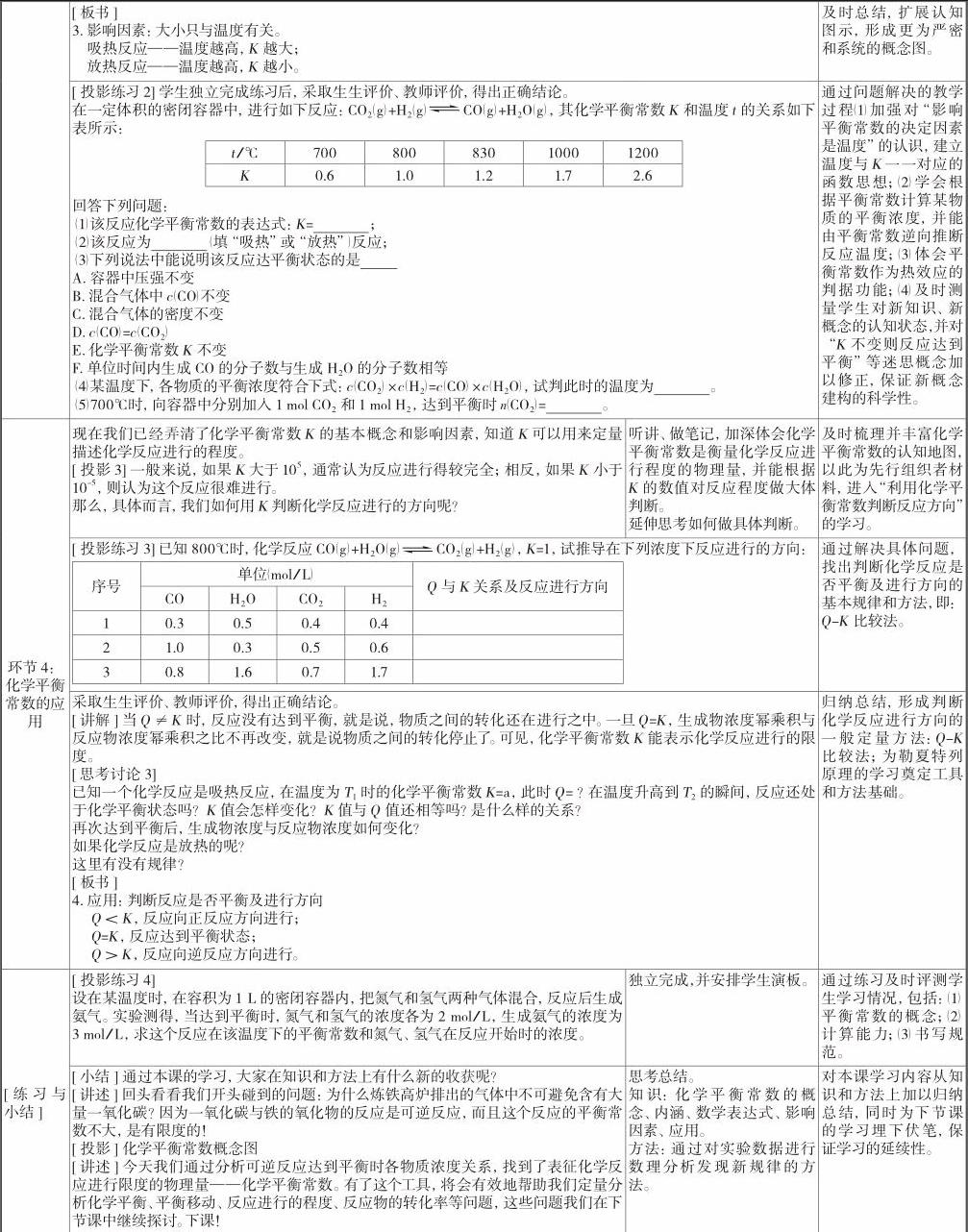
见表1。
5 设计反思

《纽约时报》2012年2月的一篇专栏中称:“大数据”时代已经降临,在商业、经济及其他领域中,决策将日益基于数据和分析而作出,而并非基于经验和直觉[7]。在这样的时代背景下,我们的科学教育培养的应该是适应“大数据”时代,具有整理、分析数据能力的21世纪公民。在本课的教学中,笔者以培养这样的公民素质为导向,基于真实有效的实验数据,通过一定的数理分析,让学生能够发现化学反应动态进程中对应的数据信息所蕴含的本质规律,由此建立化学平衡常数的概念雏形,在此基础上,通过问题教学层层深入探讨概念的本质及其应用。另外,化学平衡教学中“化学平衡常数”的提出符合学科知识发展线索,能有效避免用化学动力学知识来解释化学热力学问题繁杂的思维过程,但同时会让学生对平衡常数的实用产生依赖,削弱可逆反应达到动态平衡过程的抽象思维。因此,如何能够让学生定量与定性分析能力同步提升、具体与抽象思维发展双管齐下也有待继续挖掘。
参考文献:
[1]宋心琦主编.普通高中课程标准实验教科书·化学反应原理[M].北京:人民教育出版社,2007:33~37.
[2]中华人民共和国教育部制订.普通高中化学课程标准(实验)[S].北京:人民教育出版社,2003:24.
[3]王祖浩主编.普通高中课程标准实验教科书·化学反应原理[M].南京:江苏教育出版社,2007:41~43.
[4] The McGraw-Hill Companies. Chemistry: Concepts and Applications [Z]. Columbus: Glencoe/McGraw-Hill, 2005.
[5]李世峰,李田英.高中学生应用勒夏特列原理判断非均匀相系化学平衡的迷思概念探讨[J].科学教育月刊,2007,(301):1~16.
[6]支瑶,王磊等.化学平衡常数对促进学生认识发展的功能价值分析及其教学实现[J].化学教育,2010,(6):29~34.
[7] Steve Lohr. The Age of Big Data [N]. News Analysis, February 11, 2012,(82):Comments.

