经皮射频消融术治疗椎体肿瘤合适消融时间的实验研究
陈珑,倪才方,王艳伟,杨超,王刚刚,张帅,肖剑
·实验研究Experimental research·
经皮射频消融术治疗椎体肿瘤合适消融时间的实验研究
陈珑,倪才方,王艳伟,杨超,王刚刚,张帅,肖剑
目的探索经皮射频消融术(RFA)治疗兔椎体肿瘤模型不同消融时间的疗效及安全性。方法采用CT引导经皮穿刺法将VX2瘤块接种入新西兰大白兔的腰椎内,成功建立20只兔椎体肿瘤模型。将其随机分为A、B两组,每组10只。测量肿瘤椎体的核素标准化摄取值(stand uptake value,SUV),然后对实验动物行消融治疗。A组消融持续时间3m in,B组为5m in,观察治疗后24 h动物急性瘫痪发生情况。治疗后第1天和第7天,实验动物再次接受PET-CT检查,测定椎体肿瘤的SUV值,然后取肿瘤标本行病理检查。比较两组动物RFA术后的瘫痪率以及治疗前后不同时间点的肿瘤SUV值有无差异。结果A、B两组动物射频后的瘫痪发生率差异有统计学意义(1/10比6/10、P<0.05)。两组肿瘤模型消融前的SUV值分别为4.60±0.47、4.48±0.45,治疗后第1天分别为0.94±0.08、0.92±0.07,治疗后第7天分别为0.93±0.04、0.95±0.06。两组椎体肿瘤的SUV值在治疗前、后差异有统计学意义(F=3 257.87、P<0.05),两组之间则差异无统计学意义。病理结果显示两组肿瘤模型的肿瘤细胞明显坏死,均未见明显残存肿瘤细胞。结论应用RFA治疗兔椎体肿瘤,消融时间持续3min已能有效杀伤椎体肿瘤细胞,且严重并发症的概率小。延长消融时间疗效无显著增加,但可能增加神经损伤的风险。
椎体肿瘤;射频消融术;抗肿瘤作用;瘫痪
射频消融术(radiofrequency ablation,RFA)属肿瘤热疗的一种,已广泛应用于肝、肾等实体脏器肿瘤的治疗[1]。近年也有文献报道将其用于治疗椎体肿瘤,以起到局部杀伤肿瘤及缓解疼痛的目的[2-4]。但消融治疗时产生的热量可能对椎管内神经产生不可逆的热损伤,从而引起包括瘫痪在内的严重并发症[4-8]。近期,有实验探索了RFA治疗椎体肿瘤持续时间与椎管内温度变化的关系,结果表明,随着RFA治疗时间的延长,椎管内温度随之上升,当治疗时间超过3 min,椎管内温度就可能造成神经组织损伤[8]。但是消融治疗的持续时间与其治疗椎体肿瘤的疗效和安全性之间的关系,尚未见有关实验研究报道。本研究以兔椎体肿瘤模型为研究对象,寻找合适消融治疗时间下,RFA治疗椎体肿瘤的疗效和安全性。
1 材料与方法
1.1 材料
1.1.1 实验动物新西兰大白兔22只(3.0~3.5 kg)以及VX2荷瘤兔由苏州大学动物实验中心提供。
1.1.2 主要实验仪器及药械四排螺旋CT(Marconi Mx8000);PET-CT(DSSTE 16,GE);17 G穿刺套针(Angiotech);14 G穿刺套针(Angiotech);RFA仪(Cool-tip);RFA针(有效射频范围1 cm);地西泮(上海旭东海普药业有限公司);速眠新Ⅱ(军事医学科学院军事兽医研究所)。
1.2 方法
1.2.1 椎体肿瘤模型建立及分组实验动物在接受相关手术操作及影像学检查前皆禁食8 h,均采用地西泮1mg耳缘静脉注射联合速眠新(0.2m l/kg)肌内注射镇静麻醉。按文献报道制备兔VX2瘤块并建立兔椎体肿瘤模型[8-9]。实验动物俯卧位,四肢固定置于CT检查床上,腰背部备皮。腰椎CT平扫后,选取L4或L5椎体最大层面作为穿刺平面。穿刺区域局部消毒,用17 G穿刺套针穿刺腰椎椎体,当CT扫描显示针尖位于椎体中部区域后,停止穿刺。采用穿刺套针的内芯,将制备好的VX2瘤块经穿刺外套针送入椎体内,最后再将长约0.5 cm的明胶海绵条,沿外套针送入椎体内以栓塞封闭穿刺针道。接种后3周行PET-CT扫描,见接种椎体骨质破坏,并有明显核素浓聚征象者,确认为椎体肿瘤建模成功,PET-CT下测定椎体肿瘤的核素标准化摄取值(standard uptake value,SUV)。22只实验动物20只建模成功,将建模成功动物分成A,B两组,每组各10只。A组为消融时间3min,B组消融时间5 min。
1.2.2 经皮穿刺椎体肿瘤RFA治疗过程实验动物麻醉后,俯卧位四肢固定于CT诊断床上。CT定位下左侧入路,以14 G穿刺套针经皮穿刺到病变椎体内。再次CT扫描明确穿刺针尖位于病变椎体中央后,拔出套针内芯。将射频针经穿刺外套针引入到病变椎体内,再后退外套针于椎体外,即将射频针顶端1 cm有效工作范围置于椎体肿瘤内,再次行CT扫描,明确射频针尖位于病变椎体中(图1)。用100W的功率进行消融治疗,按预先实验分组,对实验动物分别行3 min或5 min的消融治疗,治疗结束后,预热针道30 s,退出射频针。术中和术后观察实验动物的一般反应情况,观察实验动物消融24 h内有无急性后肢瘫痪事件发生,记录两组动物消融后的急性瘫痪发生率。
1.2.3 PET-CT及病理检查RFA术后1、7 d分别再次对实验动物行PET-CT检查,测定肿瘤椎体的SUV值,后处死实验动物,取病变椎体标本行HE染色,行病理学检查。PET-CT检查前18F-FDG按放射剂量0.75 mCi/Kg经兔耳缘静脉注射。注射药物后45min将实验兔俯卧位固定于PET-CT诊断床上,行图像采集。PET采集图像时间为每段8 min,CT扫描为16排螺旋CT,参数为140 kV、120 mAs,进床速度为17.5 mm/圈,螺距1.75。将PET的代谢图像和CT的解剖图像在PET-CT的后处理工作站中进行图像融合。使用Xeleris工作站依据FEOR-IT算法重建PET图像。
1.3 统计学方法
所有的统计学分析均使用SPSS13.0统计数据软件包,数值变量采用(±s)进行统计描述,P<0.05为差异有统计学意义。采用Fisher精确检验比较两组动物RFA后急性瘫痪发生率是否存在统计学差异。采用可重复检验的方差分析比较两组动物在RFA治疗前后的不同时间点,椎体肿瘤SUV值变化有无差异。
2 结果
2.1 实验动物一般情况
A组中有1只实验动物在RFA治疗的最后30 s出现了躁动情况;B组在射频治疗开始3 min后,先后有7只动物出现了不同程度的躁动。除B组1只动物外,两组在消融过程中出现躁动的7只动物,术后24 h内都发生了急性瘫痪。其中A组有1只动物出现了左后肢不全性瘫痪,B组有4只动物出现了左后肢不全性瘫痪,2只动物出现了双侧后肢瘫痪,难以行动。在随后的观察中,实验动物无新发瘫痪情况发生。A组实验动物术后24 h内的急性瘫痪率为10%(1/10),B组为60%(6/10),采用Fisher单侧精确检验法P=0.029,P<0.05,差异有统计学意义。
2.2 PET-CT及病理检查结果
消融后即刻的CT扫描提示,消融区域椎体呈现相对低密度,病灶周围可见低密度气体显示(图1)。发生瘫痪的实验动物,其消融治疗侧的椎旁软组织肿胀明显。消融治疗前两组实验动物的肿瘤椎体核素浓聚征象明显,SUV值升高显著。消融治疗后的PET-CT检查,两组实验动物均可见消融椎体呈明显低密度的核素显影缺失区(图2),瘫痪动物还可见RFA侧的椎旁软组织亦呈低密度的核素显影缺失暗区。A、B两组实验动物RFA前椎体肿瘤的SUV值分别为4.60±0.47、4.48±0.45;术后1 d的SUV值分别为0.94±0.08、0.92±0.07;术后7 d的SUV值分别为0.93±0.04、0.95±0.06;经可重复检验的方差分析,两组实验动物RFA治疗后的SUV值较术前明显降低,差异有统计学意义(F=3 257.87、P=0.000)但是术后7 d与术后1 d组比差异无统计学意义。两组动物各时间点的SUV值比较差异无统计学意义(F=0.218、P=0.646、P<0.05)。
大体病理显示,接受消融治疗的椎体组织炭化、坏死,瘫痪动物椎旁软组织亦可见明显充血肿胀。两组实验动物的椎体肿瘤标本切片,镜下皆可见明显的大片红染无结构的坏死区,未见明显肿瘤细胞存活。
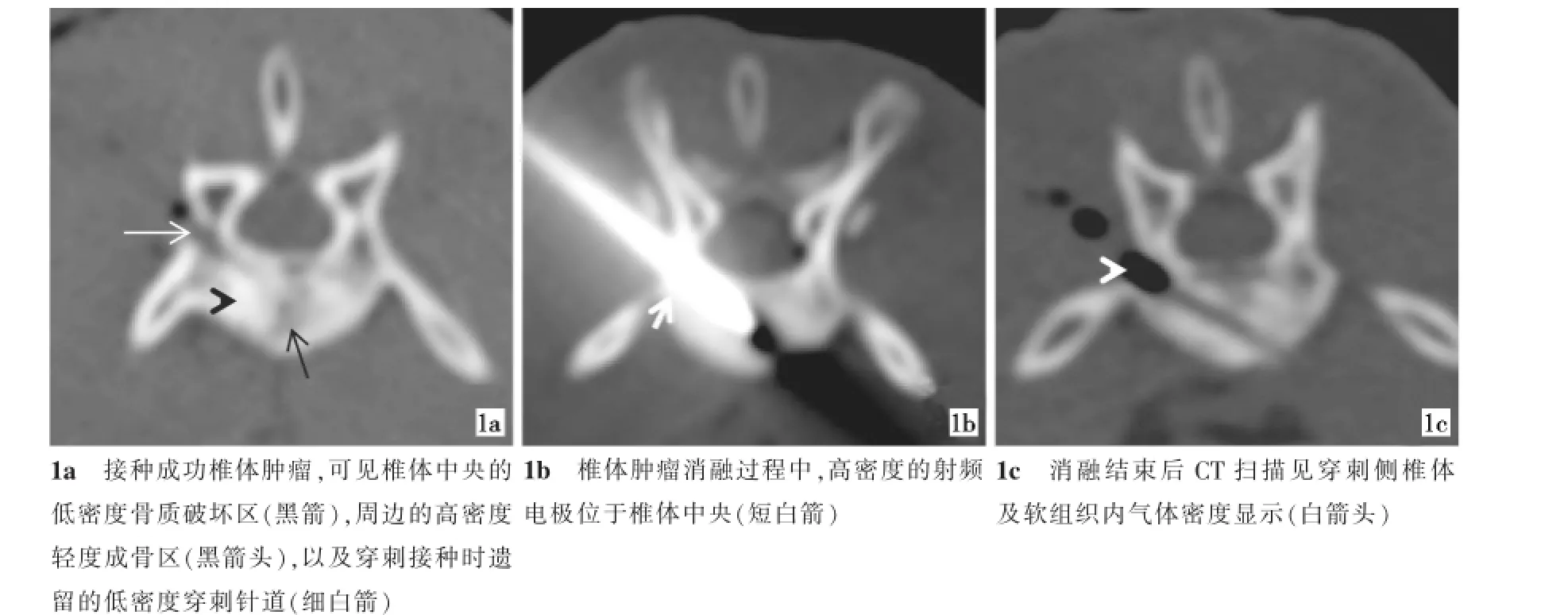
图1 CT引导下兔椎体RFA过程图
3 讨论
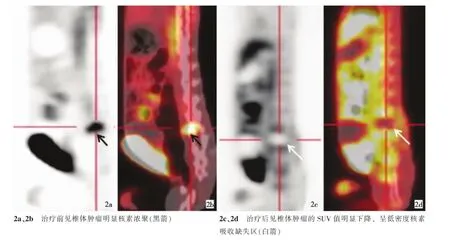
图2 椎体肿瘤RFA前后PET-CT图,a与c为PET图像,b与d为PET-CT融合后图像
RFA是已广泛用于治疗实体肿瘤的微创技术,其产生的高温可使肿瘤组织发生不可逆的凝固坏死,同时,肿瘤周围组织凝固坏死形成一个反应带以切断肿瘤血供,并能防止肿瘤转移[1-5]。RFA治疗椎体病变时,最常见的并发症之一就是射频产生的高温对神经组织的热损伤。文献报道RFA治疗椎体肿瘤时,神经损伤的并发症可高达24%[4-5]。以往关于神经组织热损伤的实验研究表明,当环境温度持续超过42℃,就可能对脊神经或周围神经产生损害[10-11]。而最近针对椎体肿瘤模型展开的实验研究结果表明当RFA治疗椎体肿瘤的时间超过3 min时,实验侧椎管内温度就已经超过42℃,因此从理论上讲,此时若继续RFA治疗,则可能会对周围神经产生热损伤[8]。但是有关RFA治疗椎体肿瘤的治疗时间与疗效和安全性之间的关系尚缺乏相关的活体实验研究报道。
以往针对RFA治疗椎体肿瘤的热损伤研究,主要集中于正常动物及尸体标本的研究[6-7]。其无法模拟肿瘤内丰富的血流和椎管内循环脑脊液可能会带走射频所产生热量的病理生理变化,从而可能影响到最终的研究结果。本实验采用经皮穿刺的方法建立了活体椎体肿瘤模型,以更好地模拟椎体肿瘤接受RFA治疗时的相关病理生理变化。由于之前的研究已经表明,针对椎体肿瘤RFA治疗超过3min,椎管内的温度就可能已经会对神经组织产生损伤[8],因此本研究选定了治疗时间3min和5 min 2个时间点,对RFA治疗椎体肿瘤的有效性和安全性进行观察。
PET-CT现在已被广泛用作临床或亚临床水平判定恶性肿瘤和判断疗效的影像方法。其中SUV值降低,即肿瘤的核素摄取明显减少或消失,已被作为恶性肿瘤临床治疗有效的主要标准,并以此证据作为修正恶性肿瘤的相应治疗方案[12-13]。本研究结果显示,无论RFA治疗持续3 min或是延长至5 min,椎体肿瘤治疗后的SUV值都较治疗前明显降低,且两组之间差异无统计学意义,随着术后观察时间的延长,SUV值并无明显升高。同时,两组实验动物术后7 d肿瘤椎体病理检查也显示,除可见治疗椎体内大面积的凝固坏死区外,皆未见明显肿瘤细胞存活。现有的影像证据结合病理结果显示,针对直径约1 cm左右的椎体肿瘤模型,射频治疗3 min,已足以杀伤肿瘤细胞,且疗效稳定,延长治疗时间并不增加疗效。
本研究中,B组RFA治疗后的急性瘫痪率远高于A组;而治疗术中亦可观察到实验动物在麻醉状态下发生躁动的现象,绝大部分发生在RFA治疗3min以后。这表明随着消融时间的延长,神经受损的概率也逐步提高。而瘫痪动物的PET-CT结果显示,不仅肿瘤椎体,就连穿刺侧的椎旁软组织也表现为核素吸收缺失的负性区域,同时这些动物的大体病理也提示,其接受RFA治疗穿刺侧的椎旁软组织明显充血水肿。本研究结果表明,随着RFA时间的延长,不仅椎体肿瘤,侧椎管及椎旁软组织内的温度也可能不断升高,RFA在有效杀伤肿瘤细胞的同时,也对周围正常组织,尤其是神经组织产生了热损伤。这与之前的研究报道提示的RFA时间超过3min,椎管内的温度便已超过42℃相一致[8]。
尽管本研究建立了兔椎体肿瘤模型以进一步模拟临床RFA治疗中的病理生理变化过程,但是动物模型毕竟无法完全模拟临床。本研究的主要目的是为临床工作中RFA治疗参数的选择提供一定的参考标准和理论基础,具体临床应用时还应参照实际情况制订相应治疗策略。同时由于本研究主要致力于射频治疗时间与疗效和安全性之间关系的探讨;而兔椎体体积相对较小,同时获取椎体及相应的神经组织标本在解剖技术上存在一定难度,因此未行病变标本椎管内神经组织的特殊病理染色以进一步探究其神经受损机制,这或许是今后研究中应该关注的内容之一。
综上所述,本研究结果表明针对直径1 cm左右的兔椎体肿瘤,消融治疗3min就能有效杀伤肿瘤细胞,延长治疗时间对提高疗效意义不大,反而会明显增加并发症的发生率;而当肿瘤体积较大时,应慎重选择单纯通过延长消融时间来提高疗效的方法;或者,在延长RFA治疗时间的同时,联合采取其他实体肿瘤射频治疗类似的,在接受射频组织的周围注射生理盐水或气体以降低热损伤并发症的方法[14],也是今后RFA治疗椎体肿瘤的研究方向之一。
[1]LencioniR,Crocetti L.Local-regional treatmentofhepatocellular carcinoma[J].Radiology,2012,262:43-58.
[2]王卫国,吴春根,程永德,等.射频消融术联合经皮椎体成形术治疗脊柱转移性肿瘤[J].介入放射学杂志,2009,18:362-366.
[3]胡继红,王会,赵卫,等.射频消融联合椎体成形术治疗脊柱转移性肿瘤12例[J].介入放射学杂志,2013,22:563-566.
[4]Nakatsuka A,Yamakado K,Maeda M,et al.Radiofrequency ablation combined with bone cement injection for the treatment of bonemalignancies[J].JVasc Interv Radiol,2004,15:707-712.
[5]Munk PL,Murphy KJ,Gangi A,et al.Fire and ice: percutaneous ablative therapies and cement injection in management of metastatic disease of the spine[J].Semin Musculoskelet Radiol,2011,15:125-134.
[6]Nakatsuka A,Yamakado K,Takaki H,et al.Percutaneous radiofrequency ablation of painful spinal tumors adjacent to the spinal cord with real-time monitoring of spinal canal temperature:a prospective study[J].Cardiovasc Intervent Radiol,2009,32:70-75.
[7]Dupuy DE,Hong R,Oliver B,et al.Radiofrequency ablation of spinal tumors:temperature distribution in the spinal canal[J]. AJR,2000,175:1263-1266.
[8]陈珑,倪才方,王艳伟,等.经皮射频消融术治疗椎体肿瘤术中温度变化的活体实验研究[J].介入放射学杂志,2014,23:427-430.
[9]Takahashi M,Ogawa J,Kinoshita Y,et al.Experimental study of paraplegia caused by spinal tumors:an animalmodel of spinal tumors created by transplantation of VX2 carcinoma[J].Spine J,2004,4:675-680.
[10]Yamada T,Tateishi A,Cho S,et al.The effects of hyperthermia on the spinal cord[J].Spine(Phila Pa 1976),1992,17:1386-1391.
[11]Froese G,Das RM,Dunscombe PB.The sensitivity of the thoracolumbar spinal cord of the mouse to hyperthermia[J]. Radiat Res,1991,125:173-180.
[12]Kostakoglu L,Goldsmith SJ.18F-FDG PET evaluation of the response to therapy for lymphoma and for breast,lung,and colorectal carcinoma[J].JNucl Med,2003,44:224-239.
[13]Schmitz A,Risse JH,Textor J,et al.FDG-PET findings of vertebral compression fractures in osteoporosis:preliminary results[J].Osteoporos Int,2002,13:755-761.
[14]Toyoda H,Kumada T,Tada T,et al.Placement of a Sodium hyaluronate solution onto the liver surface as a supportive procedure for radiofrequency ablation of hepatocellular carcinomas located on the liver surface:a preliminary report[J]. JVasc Interv Radiol,2012,23:1639-1645.e1.
Optimal ablation time of percutaneous radiofrequency ablation for the treatment of vertebral tumors: an experimental study
CHEN Long,NICai-fang,WANG Yan-wei,YANG Chao,WANG Gang-gang, ZHANG Shuai,XIAO Jian.Department of Interventional Radiology,A ffiliated First Hospital of Soochow University,Suzhou,Jiangsu Province 215006,China.
XIAO Jian,E-mail:shhxiaoj@163.com
ObjectiveTo explore the efficacy and safety of percutaneous radiofrequency ablation(RFA)by using different ablation time in treating vertebral tumors in experimental rabbitmodels in order to optimize the ablation time.M ethods Vertebral tumor models were successfully established in 20 New Zealand white rabbits by transplanting VX2 carcinoma into the lumbar vertebral body with percutaneous puncture inoculation technique under CT guidance.Twenty vertebral tumor rabbitmodels were random ly and equally divided into two groupswith 10 experimental rabbits in each group.The tumormodels in group A and group B were treated by RFA with the ablation time lasting for 3 minutes and 5 m inutes respectively.The stand uptake value(SUV)of each vertebral tumorwas determined on PET-CT before RFA treatmentaswell as at one day and 7 days after RFA treatment.Then the rabbits were executed for pathological examinations.The incidences of acute paralysis after RFA were compared between the two groups by Fisher’s exact text. The SUV of each vertebral tumor in different group and different time point was analyzed by repeated measures analysis of variance.Resu lts Statistically significant difference in the incidence of acute paralysis after RFA existed between group A and group B(10%vs.60%,P<0.05).The preoperative SUV of vertebral tumor of group A and group B was 4.60±0.47 and 4.48±0.45respectively.One day and 7 days after RFA the SUV of vertebral tumor in group A was 0.94±0.08 and 0.92±0.07 respectively,which was 0.92±0.07 and 0.95±0.06 respectively in group B.In both groups statistically significant difference in SVU existed between the preoperative data and the postoperative ones(F=3 257.87,P<0.05),although no statistically significant difference in SVU existed between the two groups.Pathologically,typical tumor cell necrosiswas demonstrated in both groups,and no obvious residual active tumor cells were seen.Conclusion Employing RFA to treat vertebral tumor in rabbitmodels,the ablation time of threeminutes is enough to effectively kill the tumor cells,moreover,the probability of the occurrence of serious complications is small.Prolonging RFA therapeutic time can not enhance the treatment effect.Instead,RFA with the ablation time lasting for longer timemay increase the risk of nerve injury.(J Intervent Radiol,2014,23:1059-1063)
vertebral tumor;radiofrequency ablation;anti-tumor effect;paralysis
R736.2
A
1008-794X(2014)-12-1059-05
2014-01-11)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2014.12.010
国家自然科学基金(81101136),上海市自然科学基金基础研究项目(11ZR1448300),江苏省卫生厅国际交流支撑项目(2012020)
215006江苏苏州苏州大学附属第一医院介入放射科(陈珑、倪才方、王艳伟、杨超、王刚刚、张帅);复旦大学附属中山医院骨科(肖剑)
肖剑E-mail:shhxiaoj@163.com

