高强度聚焦超声补救治疗TACE失败肝癌的临床应用
洪立立,郭志,司同国,于海鹏,李保国,刘长富
·肿瘤介入Tumor intervention·
高强度聚焦超声补救治疗TACE失败肝癌的临床应用
洪立立,郭志,司同国,于海鹏,李保国,刘长富
目的评价高强度聚焦超声(HIFU)补救性治疗经选择性肝动脉化疗栓塞(TACE)失败的晚期肝细胞肝癌(HCC)患者的有效性和安全性。方法回顾性分析44例应用HIFU治疗的经TACE治疗失败的晚期HCC患者临床资料。结果患者总生存时间为12.8个月(95%CI:10.4~15.0),1年生存率为46.7%,2年生存率为11.4%。单因素分析显示,肿瘤分期(P=0.001)、肿瘤大小(P<0.001)、门静脉癌栓(P=0.030)、AFP水平(P=0.001)和消融效果(P<0.001)为预后的影响因素。多因素分析显示肿瘤大小(P=0.002)及临床分期(P=0.010)是影响患者总生存时间的独立预测因素。3/4级不良反应包括发热(4.5%)贫血(4.5%)、腹部不适(4.5%)、皮肤烧伤(9.1%)、乏力(4.5%)、出血(2.3%)等,未出现严重并发症。结论对于TACE治疗失败的HCC患者,应用HIFU可有效降低肿瘤负荷,延长生存时间。
高强度聚焦超声;肝细胞肝癌;选择性肝动脉化疗栓塞术
原发性肝细胞癌(HCC)的首选治疗方式是外科手术切除,但85%患者就诊时已失去手术切除机会[1]。对于不可手术切除的晚期肝癌患者,选择性肝动脉化疗栓塞术(TACE)是主要治疗方法[2-3]。单纯TACE治疗3 cm以上的病灶,肿瘤坏死率不足44%[4]。对于TACE失败的患者如何制定补救治疗方案越来越受到关注。随着高强度聚焦超声(HIFU)在临床应用,其疗效得到广泛认可。本研究回顾性分析HIFU补救治疗TACE治疗失败的晚期肝癌患者,评价其有效性和安全性。
1 材料与方法
1.1 病例收集
收集我院2007年10月—2012年10月住院原发性肝癌患者共44例,TACE治疗失败按参考文献[5]定义为:①血管造影或CT显示碘油分布欠佳;②于TACE治疗期间病情进展。本组患者符合以下纳入标准:①有病理学或细胞学确诊的原发性肝癌患者,或者符合2001年我国原发性肝癌临床诊断标准患者;②无手术机会或拒绝手术治疗;③既往经过1次或多次TACE治疗;④腹部超声检查显示可见病灶最大径2~15 cm,数目不超过3个;⑤预计生存期≥3个月;⑥除外以往抗癌治疗的影响。排除标准为:①孕妇及哺乳期妇女;②有神经系统病变、不能清楚诉说治疗反应者(如脑转移等);③有严重心、肺、肝、肾等功能异常、凝血功能异常者或严重糖尿病患者,预计不能完成治疗者;④Child-Pugh C级;⑤腹部严重瘢痕影响入射通道,或腹壁厚度>5 cm;⑥发生肝外转移者。本研究经医院伦理委员会批准,患者知情同意。
1.2 方法
1.2.1 治疗方法仪器采用北京源德医疗设备有限公司研制的高强度聚焦超声治疗系统(FEPBY02型),常用的治疗数据包括以下几个主要参数:①输入电功率水平,控制范围400~1 000W,每点平均700~900 J;②单元发射时间(t1):1~2 s;③占空时间(t2):t1∶t2=1∶1;④每点次数(T):5~10次。
1.2.2 疗效判定采用增强CT、MRI为主的影像学检查手段,6~8周后按RECIST标准评价近期疗效,治疗前1周及治疗后每2个月测量目标肿瘤。HIFU消融效果按HIFU肿瘤治疗系统临床应用指南评定分为完全消融(增强CT或MRI显示病灶内完全坏死)、部分消融(病灶内可见坏死区,残余肿瘤)、未消融(病灶内未见凝固性坏死);总生存时间(overall survival time,OS)定义为治疗开始至任何原因导致死亡或失访的时间。
1.2.3 不良反应观察所有指标均按不良事件评价标准(NCICTC 4.0标准)和国际介入放射学协会并发症分级标准(SIR标准)进行记录并随访。
1.3 统计方法
所得全部资料建立数据库,数据采用SPSS17.0版软件进行计算,患者资料及不良反应比较采用χ2检验或Fisher精确检验法,OS的分析采用Kaplan-Meier方法计算,显著性分析采用Log Rank检验;对影响总生存期的临床病理特征进行单因素分析,对单因素分析有明显差别的变量进行Cox回归多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 患者的基线资料
44例患者的平均年龄为60(37~81)岁。既往行根治术4例。Ⅲ期患者21例(47.7%),Ⅳ期患者23例(52.4%);病灶长径中位数为9.3 cm(5.3~18.0),合并肝硬化者23例,合并门静脉癌栓者23例,患者基线情况见表1。
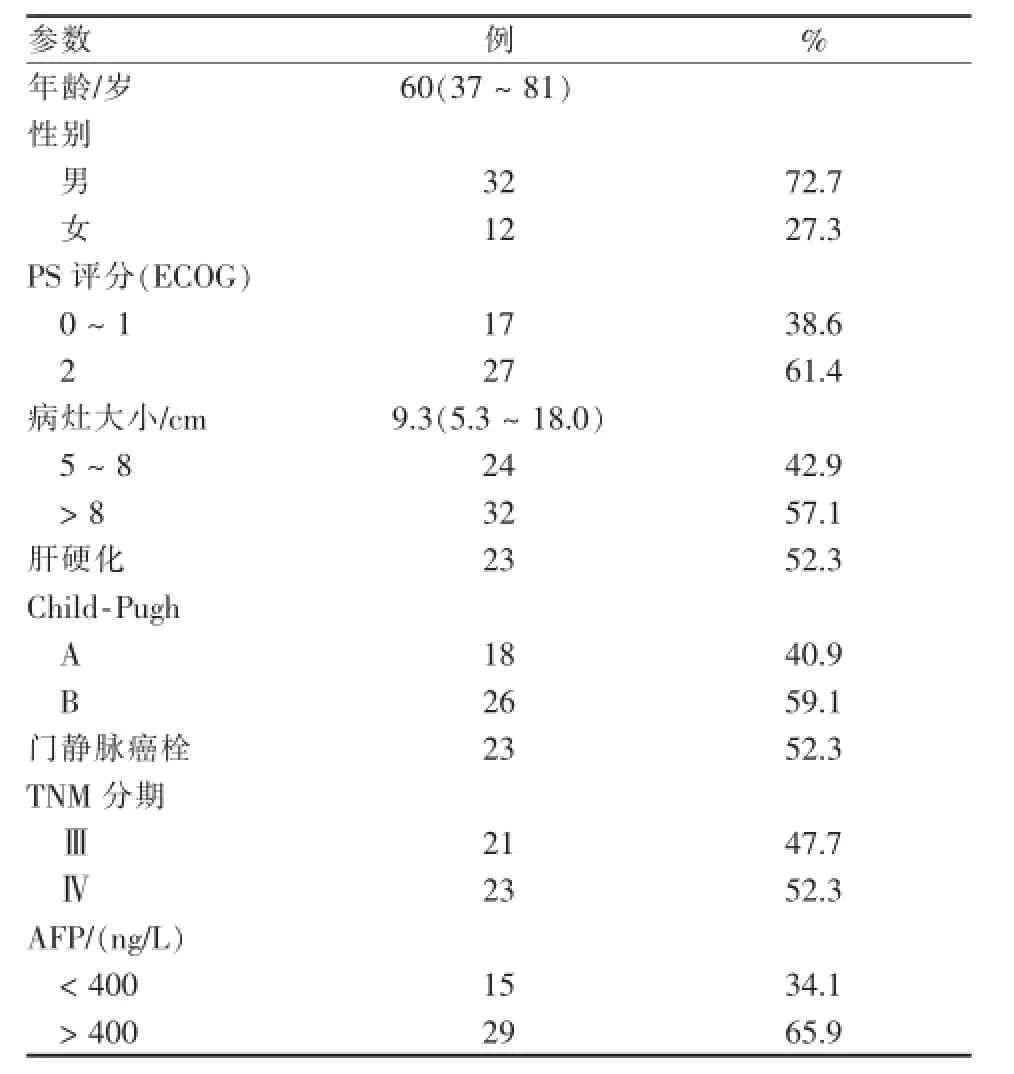
表1 患者基线情况
2.2 临床消融效果
44例患者的56个病灶进行了HIFU治疗,通过超声实时监测提示,49个病灶(87.5%)于治疗中或(和)治疗后发生灰度改变,具体表现为病灶内点、片状回声增强及病灶内部血流信号减少等。经CT或MRI复查,完全消融病灶为14个(26.8%),部分消融37个(66.1%),5个病灶(7.1%)未见消融表现。
2.3 近期疗效
全部44例患者均获随访,中位随访时间为15.5个月(95%CI:12.3~19.0)。按照RECIST标准,CR为0例,PR 10例(22.7%),SD 21例(47.7%),PD 13例(29.6%),疾病控制率(DCR)为70.4%。
2.4 不良反应
1例(2.3%)患者出现发热外,其他3级不良反应包括贫血(2例,4.5%)、腹部不适(2例,4.5%)、皮肤烧伤(4例,9.1%)、乏力(2例,4.5%)、出血(1例,2.3%)等,经临床对症治疗后可逆。未出现与治疗相关的死亡。
2.5 生存分析
全组患者的总生存时间为12.8个月(95%CI: 10.4~15.0),1年生存率为46.7%,2年生存率为11.4%。通过单因素分析显示,肿瘤分期(P=0.001)、肿瘤大小(P<0.001)、门静脉癌栓(P=0.030)、AFP水平(P=0.001)和消融效果(P<0.001)为影响预后的主要因素。不同分期的患者,患者的OS分别为Ⅲ期16.2个月(95%CI:13.1~19.3)和Ⅳ期8.7个月(95%CI:6.8~10.6);不同大小肿瘤(<8 cm及≥8 cm)的患者,OS分别为19.4个月(95%CI: 16.4~22.4)和8.5个月(95%CI:6.5~10.1)。采用Cox回归进行多因素分析,显示肿瘤大小(P= 0.002)及临床分期(P=0.010)是影响患者总生存时间的独立预后因素(表2,图1)。
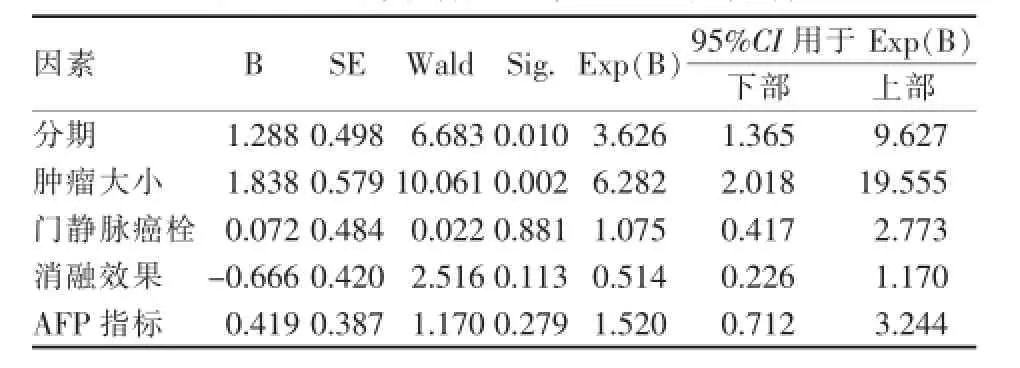
表2 44例患者多因素Cox回归分析
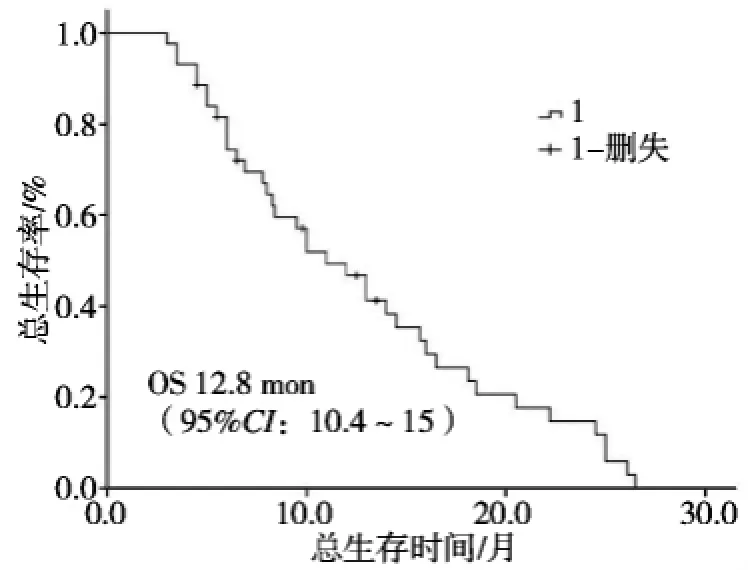
图1 44例患者的总生存时间
3 讨论
对于不可切除的晚期HCC TACE治疗为首选,利用肝脏的双重血供特点,TACE治疗肝癌的主要机制是栓塞肿瘤供血动脉,造成局部肿瘤细胞、内皮细胞缺血缺氧达到抑制肿瘤生长,促使肿瘤细胞坏死、凋亡。但TACE有其不足,由于肝动脉解剖变异多、肝脏多源血供、门静脉供血以及肿瘤侧支循环形成等原因,单纯应用TACE复发率高,对于较大的肿瘤,需要多次治疗,患者往往在治疗过程中疾病进展,远期疗效不佳。已有文献表明,无论单纯HIFU治疗或联合TACE治疗HCC均安全有效[6-8]。
本研究结果显示,44例患者的56个病灶中,49个病灶(87.5%)于治疗中或(和)治疗后发生超声灰度改变,具体表现为病灶内点片状回声增强及病灶内部血流信号减少等。经CT或MRI复查,完全消融病灶14个(26.8%),部分消融37个(66.1%),病灶内可见典型凝固性坏死区(图2),说明TACE失败后,HIFU仍可对病灶起确切的局部治疗作用。我们推测其机制在于:①利用HIFU的热效应及机械效应促使肿瘤坏死;②病灶中残余碘油利于改变局部声环境,通过空化效应提高疗效;③肿瘤缺乏血供为TACE失败的常见原因,而肿瘤的乏血供状态更利于减少HIFU治疗中的热量丢失。研究中有5个病灶影像学未见明显消融表现,原因与病灶较深(焦点距皮肤>14 cm)、瘤体周边残存大血管有关,提示HIFU治疗仍存在一定局限性,病灶距体表过远时,超声的衰减及非线性效应均会明显影响疗效;同时,大血管中较快的血流仍是导致治疗不彻底的重要因素。因而,在治疗前应注意病例的选择。
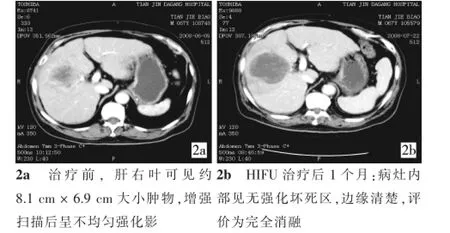
图2 HIFU治疗前后CT影像对比
HIFU作为补救手段治疗TACE失败患者未见文献报道。将HIFU作为单一治疗手段治疗HCC患者,LI等[9]报道1、2年生存率分别为50%和30.9%;本研究中,全组患者平均生存期为12.8个月,1年生存率为46.7%,2年生存率为11.4%,数值低于相关文献,可能与入组患者多数瘤体较大、分期较晚有关,但高于姑息治疗的OS(3~6个月)。单因素分析中,肿瘤分期(P=0.001)、肿瘤大小(P<0.001)、门静脉癌栓(P=0.030)、AFP水平(P=0.001)和消融效果(P<0.001)为影响预后的影响因素,与文献报道一致[9-10]。通过多因素分析,肿瘤的大小与分期是影响患者生存时间的独立预测因素,提示对于分期相对较早、肿瘤小于8 cm的患者,在TACE失败后行HIFU补救治疗仍能使患者生存获益。消融率的提高是否有助于延长患者的生存时间目前尚无定论,Jin等[11]研究表明消融效果是患者总生存时间的独立预测因素。而在本研究中,虽然单因素分析显示完全消融或部分消融患者的OS显著优于未消融患者,但多因素分析未能证明消融效果是独立预测因素,原因可能为患者复发和转移的机制较为复杂,其生存时间受多重因素影响,因此在HIFU治疗中,不宜以追求消融率为唯一目标。根据患者的临床特点制订个体化的HIFU治疗方案,才有可能获得良好的预后。
本组患者未出现大出血、肠穿孔、肝功能衰竭、腹腔感染等严重并发症,提示HIFU安全性较好,患者易于耐受。本研究中所有患者均未行肋骨切除术。对于肋骨遮挡声窗的肿瘤,我们采用经肋间低功率、低剂量、间歇治疗的模式,亦获得良好消融效果。治疗过程中,患者仅于入射皮肤处有轻微针刺感,体现了HIFU的非(微)侵袭性优势。所有患者未采用复合全麻配合,降低了医疗风险,减轻了患者医疗费用负担。除1例患者(2.3%)出现高烧外,其它3级不良反应包括贫血(4.5%)、腹部不适(4.5%)、皮肤烧伤(9.1%)、乏力(4.5%)、出血(2.3%)等,未出现治疗相关性死亡。
综上,对于TACE失败的HCC患者,HIFU可作为一种有效的补救治疗手段,延长患者的生存时间。同时患者耐受性好,易于实施,值得临床尝试。本研究尚存在一些不足之处。本组均为Ⅲ期、Ⅳ期患者,这种选择的偏倚可能会影响结果的判定。关于HIFU治疗后的患者,再次出现复发或和转移,其机制如何,需要进一步研究。由于本研究样本量较小,仍缺乏代表性,开展大样本的临床随机对照试验可能会弥补不足。
[1]康振.肝细胞肝癌TACE术后血管改变研究进展[J].国际医学放射学杂志,2013,36:353-356,360.
[2]Lencioni R.Chemoembolization in patients with hepatocellular carcinoma[J].Liver Cancer,2012,1:41-50.
[3]李虎子,郭志,王海涛,等.肝细胞癌患者TACE后外周血调节性T细胞水平对预后的影响[J].介入放射学杂志,2012,21:998-1001.
[4]Higuchi T,Kikuchi M,Okazaki M.Hepatocellular carcinoma after transcatheter hepatic arterial embolization.A histopathologic study of 84 resected cases.Cancer 1994,73:2259-2263.
[5]Seong J,Park HC,Han KH,et al.Local radiotherapy for unresectable hepatocellular carcinoma patients who failed with transcatheter arterial chemoembolization[J].Int JRadiat Oncol Biol Phys,2000,47:1331-1335.
[6]Wu F,Wang ZB,Chen WZ,et al.Extracorporeal high intensity focused ultrasound ablation in the treatment of patients with large hepatocellular carcinoma[J].Ann Surg Oncol,2004,11: 1061-1069.
[7]Ng KK,Poon RT,Chan SC,et al.High-intensity focused ultrasound for hepatocellular carcinoma:a single-center experience[J].Ann Surg,2011,253:981-987.
[8]Wu F,Wang ZB,Chen WZ,et al.Advanced hepatocellular carcinoma:treatment with high-intensity focused ultrasound ablation combined with transcatheter arterial embolization[J]. Radiology,2005,235:659-667.
[9]Li YY,Sha WH,Zhou YJ,et al.Short and long term efficacy of high intensity focused ultrasound therapy for advanced hepatocellular carcinoma[J].J Gastroenterol Hepatol,2007,22:2148-2154.
[10]Li C,Zhang W,Zhang R,et al.Therapeutic effects and prognostic factors in high-intensity focused ultrasound combined with chemoembolisation for larger hepatocellular carcinoma[J]. Eur JCancer,2010,46:2513-2521.
[11]Jin C,Zhu H,Wang Z,et al.High-intensity focused ultrasound combined with transarterial chemoembolization for unresectable hepatocellular carcinoma:long-term follow-up and clinical analysis[J].Eur JRadiol,2011,80:662-669.
High-intensity focused ultrasound used as a salvage therapy for hepatocellular carcinoma that failed to respond to transcather arterial chemoembolization
HONG Li-li,GUO Zhi,SITong-guo,YU Hai- peng,LI Bao-guo,LIU Chang-fu.Department of lnterventional Therapy,A ffiliated Tumor Hospatal,Tianjin Medical Unirersaty,Tianjin 300060,China
GUO Zhi,E-mail:cjr.guozhi@vip.163.com
ObjectiveTo evaluate the efficacy and safety of high-intensity focused ultrasound(HIFU)used as a salvage therapy in treating advanced hepatocellular carcinoma(HCC)that failed to respond to transcatheter arterial chemoembolization(TACE).M ethods A total of 44 patientswith HCCwere enrolled in the study.HIFU was employed in these patients as TACE had failed in them.The clinical data were retrospectively analyzed.Results The overall survival timewas 12.8months(95%CI:10.4-15.0).The 1-year and 2-year survival rate was 46.7%and 11.4%respectively.Single factor analysis showed that TNM stage(P=0.001),tumor size(P<0.001),portal vein tumor thrombus(P=0.030),AFP level(P=0.001)and ablation effect(P<0.001)were themain factors that had certain influence on the prognosis.Multivariate analysis indicated that tumor size(P=0.002)and TNM stage(P=0.01)were the independent predictors that had definite influence on the overall survival time.Themajor adverse effects of HIFU(grade 3 and 4)included fever(4.5%),anemia(4.5%),abdominal discom fort(4.5%),skin burn(9.1%),fatigue(4.5%)and hemorrhage(2.3%).No severe complications occurred.Conclusion For patientswith HCC that failed to respond to TACE,HIFU can effectively reduce the tumor load and prolong the survival time.(J Intervent Radiol,2014,23:1044-1047)
high-intensity focused ultrasound;hepatocellular carcinoma;selective transcatheter arterial chemoembolization
R735.7
A
1008-794X(2014)-12-1044-04
2014-04-10)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2014.12.006
天津市滨海新区卫生局重点支持项目(2011BHKZ009)
300060天津医科大学附属肿瘤医院介入治疗科,国家肿瘤临床医学研究中心;天津市肿瘤防治重点实验室
郭志E-mail:cjr.guozhi@vip.163.com

