电刺激迷走神经对高脂饮食大鼠摄食和体重的影响
(青岛大学医学院病理生理学教研室,山东青岛266021;*青岛市立医院)
电刺激迷走神经对高脂饮食大鼠摄食和体重的影响
李阁,王巧玲,逄明杰*,祝海*,徐珞
(青岛大学医学院病理生理学教研室,山东青岛266021;*青岛市立医院)
目的观察长期高频(10Hz)电刺激迷走神经(VNS)对高脂饮食大鼠摄食、体重及激素分泌的影响,探讨迷走神经调控摄食和体重的作用机制。方法成年雄性Wistar大鼠皮下植入微电极(MS),电极末端包裹膈下迷走神经,每日18:00时到第天6:00时刺激大鼠左侧迷走神经(方波:10ms, 200mV,10Hz),整个实验过程中均给予大鼠高脂饮食(42天);每天早晨测量体重和摄食量;实验末大鼠断头取血,用放射免疫分析法检测血清ghrelin、瘦素和nesfatin-1水平;称量附睾脂肪用来评估脂肪组织含量。采用免疫组化检测孤束核(NTS)c-Fos神经元表达。结果与对照组及假手术组相比,长期电刺激迷走神经,可显著减少大鼠摄食量(P<0.05),抑制体重增加(P<0.05),并降低附睾脂肪重量(P<0.05);长期电刺激迷走神经,血清Ghrelin水平显著升高(P<0.05),但瘦素水平明显降低(P<0.05),nesfatin-1水平升高不明显(P>0.05);刺激左侧迷走神经,两侧NTSc-Fos活性细胞数量均显著增加,左侧增加更明显(P<0.05)。结论迷走传入可增强脑饱感信号传导,从而减少摄食、体重及脂肪含量。VNS可诱发摄食相关激素反应。
体重;ghrelin;瘦素;nesfatin-1;孤束核;迷走神经刺激
摄食、体重和体脂含量常受到多种因素影响[1],其中摄食常有较大波动。摄食和体重受短期和长期双重调控。Mayer提出葡萄糖恒定调节摄食理论[2],低血糖可刺激摄食并兴奋迷走神经[3]。Campfield和Smith首次证实刺激迷走神经可升高血浆胰岛素浓度,导致血糖降低,引起大鼠自发性进食[4]。刺激迷走神经(VNS)患者可出现摄食和体重减少,故VNS作为一种治疗肥胖的新方法受到广泛关注[5]。VNS通过模拟脑肠传输饱感信号减少摄食和体重增加,迷走传入信号至大脑不仅通过兴奋胃肠机械性感受器,也可通过渗透压感受器、十二指肠化学感受器和肝葡糖糖感受器发挥作用[5]。
本研究采用高脂饮食诱导肥胖大鼠模型[6],免疫组化检测孤束核(NTS)c-Fos活性神经元,测量大鼠附睾脂肪垫以反应总脂肪含量[7],并探讨瘦素、ghrelin和nesfatin-1的循环水平变化,探讨高频(10 Hz)长期左侧VNS对高脂饮食肥胖大鼠体重和摄食的长期调控作用。
1 材料与方法
1.1 实验动物24只成年雄性Wistar大鼠,实验过程中给以高脂饮食以诱导肥胖大鼠模型。饮食包括:蛋白质29.5%;脂肪45.6%;碳水化合物24.9%。代谢能量4.34 kcal/g。所有大鼠自由进食和饮水。室温维持在23±2℃,12:12 h循环光照。
适应性高脂饮食喂养2周后,大鼠禁食12 h,腹腔注射0.25mg/kg戊巴比妥钠麻醉大鼠后进行手术。
1.2 实验分组及手术大鼠随机分成三组,每组8只。第一组为微电极刺激组(MS-10Hz组),电刺激左侧迷走神经;第二组为假手术组,与第一组相似,但无电极刺激迷走神经;第三组为对照组,未处理大鼠。
MS组大鼠,将MS外科植入大鼠皮下,MS银电极末端包裹膈下左侧迷走神经,阴极和阳极距离0.5 cm。假手术组中施行开腹手术,植入无刺激性MS。对照组中不做任何操作。
手术后恢复大鼠饮食,一周后至大鼠体重达(475±25)g可开始实验。MS和假手术组大鼠放置在电磁场暴露的单独笼中,鼠笼与可产生30-kHz电磁场的神经刺激器NSE 002正弦波发作器相连,磁场可作为MS的一种外源性电流连接到左侧迷走神经。磁场参数与实验中脉冲振幅、频率和持续时间相符,对照组大鼠放在磁场外单独的笼内。
MS单极矩形脉冲参数如下[8]:持续时间10ms,振幅200mV,频率10Hz。大鼠主要在夜间摄食,白天摄食总量不超过20%,故每天18:00开始刺激,持续12 h直至第二天早晨6:00时。每日观察大鼠行为改变。
1.3 测量指标本实验中,每天早晨测量大鼠摄食量和体重,每日摄食量=24 h之前给予食物总量-剩余食物量。实验末,断头处死大鼠。附睾脂肪垫位于附睾尾和睾丸远端之间,从每只大鼠中取出并称重。计算附睾脂肪垫与体重的比值,以及计算附睾脂肪重量/总体重。
实验终末收集血液样本,放入含抑肽酶的试管中(0.6 TIU/1mL),4℃孵育30min。1 500r 4℃离心20min,收集血清样品,–80℃保存。血清样品等分成3份,放射免疫分析法(RIAs)分别检测ghrelin、瘦素和nesfatin-1水平,所有试剂严格按照厂家使用说明书执行。
大鼠断头取脑,放于4%多聚甲醛0.1M磷酸盐缓冲液(pH值7.4)中24 h。脑片常规处理,嵌入石蜡块中,超显微切片机切片1~2μm,放于载玻片上。三组大鼠脑片常规HE染色,c-Fos免疫组织化学分析。首先用加热方法使抗原决定簇暴露(HIER),行抗原修复,将脑片浸泡于抗原修复液中95℃20 min。过氧化物酶阻断剂(DAKO)消除组织过氧化物酶活性。0.05%Triton X-100(DAKO)封闭蛋白质30min。加入多克隆兔抗c-Fos(Santa Cruz,1:200稀释)。切片4℃孵育48 h后过氧化物酶(HRP)显色、封片。显微镜下观察阳性细胞。
1.4 统计学处理所有数据均用均数±s)表示,结果用单因素方差分析和LSD检验。使用STATISTICA 8.0软件处理。
2 结果
2.1 摄食和体重与假手术组和对照组相比,电刺激左侧迷走神经可减少大鼠摄食量,有显著性差异(MS组与假手术组比较:t=2.36,P<0.05;MS组与对照组比较:t=2.24,P<0.05,),假手术组和对照组之间无显著性差异(t=0.19,P>0.05)。
与假手术组(t=2.46,P<0.05)和对照组(t=3.70,P<均体重增加是术前体重的21.1%,而假手术组为30.5%,对照组为29.8%,见表1。
表1 VNS对大鼠摄食、体重和附睾脂肪含量的影响(±s)
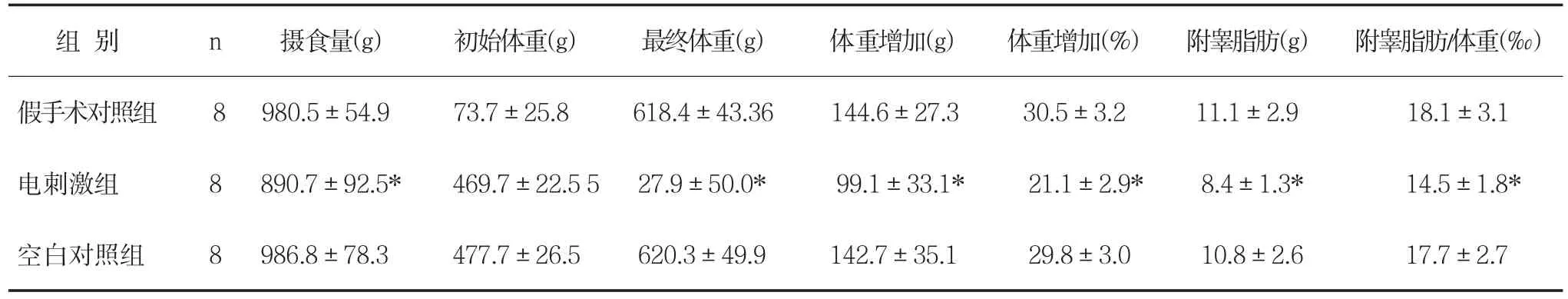
表1 VNS对大鼠摄食、体重和附睾脂肪含量的影响(±s)
*P<0.05
组别n摄食量(g)初始体重(g)最终体重(g)体重增加(g)体重增加(%)附睾脂肪(g)附睾脂肪/体重(‰)假手术对照组8 980.5±54.9 73.7±25.8 618.4±43.36 144.6±27.3 30.5±3.2 11.1±2.9 18.1±3.1电刺激组8 890.7±92.5*469.7±22.5 5 27.9±50.0*99.1±33.1*21.1±2.9*8.4±1.3*14.5±1.8*空白对照组8 986.8±78.3 477.7±26.5 620.3±49.9 142.7±35.1 29.8±3.0 10.8±2.6 17.7±2.7
2.2 附睾脂肪重量附睾脂肪重量可反映总体脂含量,与假手术组(t=2.40,P<0.05)和对照组(t=2.34,P<0.05)相比,MS组脂肪含量明显降低。假手术组和对照组之间无显著性差异(t=0.22,P>0.05),见表1。2.3脑肠肽(Ghrelin)、瘦素和Nesfatin-1与假手术组(t=2.17,P<0.05)和对照组(t=3.22,P<0.05)比较,电刺激迷走神经可显著升高血清ghrelin水平,假手术组和对照组之间无显著性差异(t=0.66,P>0.05);见表2。
与假手术组(t=2.175,P<0.05)和对照组(t=2.343,P<0.05)比较,MS组大鼠血清瘦素水平显著降低。假手术组和对照组之间无差异(t=0.203,P>0.05);见表2。
与假手术组(t=1.323,P>0.05)和对照组(t=1.45,P>0.05)相比,电刺激迷走神经可升高血清nesfatin-1水平,但差异无显著性。假手术组和对照组之间无差异(t=0.133,P>0.05);见表2。
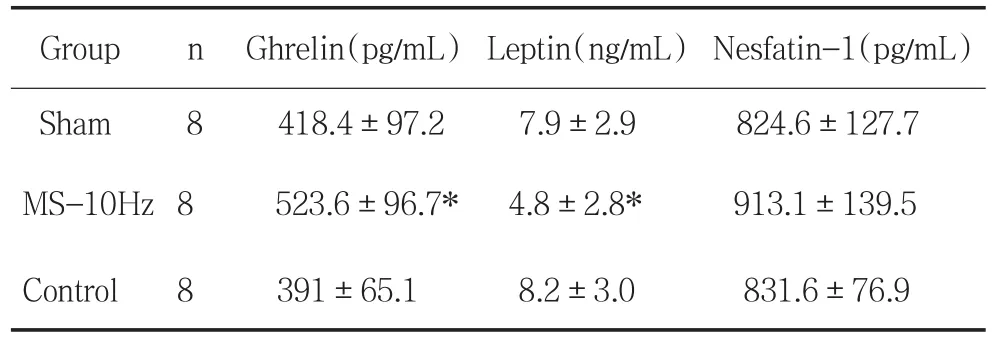
表2 刺激大鼠左侧迷走神经对血清学相关指标水平的变化(x-±s)
2.4 孤束核c-Fos免疫阳性神经元表达大鼠NTS可检测到c-Fos免疫阳性神经元,在假手术组和对照组,两侧NTSc-Fos免疫阳性细胞数量相当,差异无显著性(t=,0.27,P>0.05)。但刺激左侧迷走神经,左侧NTS和右侧NTSc-Fos免疫阳性细胞数量均增加,左侧增加更明显(t=11.83,P<0.05),见图1。
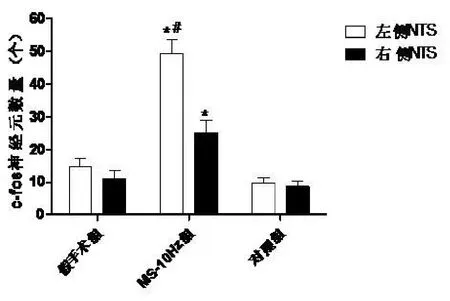
图1 VN S对孤束核c-Fos免疫阳性神经元表达影响
3 讨论
实验大鼠给予高脂饮食,高脂饮食可致肥胖,广泛应用于肥胖模型的建立[9]。此前研究证实低频电流刺激迷走神经可短期调节大鼠摄食和体重。大鼠VNS实验显示体重增加减少[10],Matyja、ValLaillet和Sobocki在猪和兔上也观察到同样的现象。VNS还具有其他作用,包括刺激不同脑区域,降低胰岛素生长因子-1血清浓度,改变肌电活性,增加胃排空和胃收缩幅度。10 Hz电脉冲长期刺激高脂饮食大鼠迷走神经可显著减少摄食,并使体重增加减少。
Bugajski称长期VNS(0.05Hz、102天)刺激高脂饮食肥胖大鼠,摄食减少、体重减轻、体脂减少。尽管VNS刺激频率(0.1~1.0 Hz)和幅度(50~200mV)不同,
Ziomber等报道成年大鼠体重均降低。Val-Laillet等[11]发现迷走神经刺激和食欲之间具有相关性。电流刺激肥胖小型猪双侧VNS(2mA、30 Hz、500ms、开30 s,关5min),与假手术组相比,刺激VNS不增加体重,VNS组小猪食物消耗降低18%,VNS组甜食消耗减少,这种效应可持续超过14周。用电流刺激而不用恒定电压刺激可避免电压降落的可能性,可减少神经层面刺激不足。
c-fos是早期基因家族的一员,在中枢神经系统有明显表达。蛋白c-fos参与神经代谢的调控[12],现在广泛用于神经元激活的标记物。假设外周电刺激迷走神经可模拟肠-CNS饱感信号,导致摄食减少和体重减轻。迷走神经内脏传入纤维细胞体包含在多结节神经节中,主要迷走传入的终端主要存在于孤束核中。NTS c-Fos活性神经元增加可证明VNS有效。此前VNS研究显示,在大鼠多结节神经节中含有多重c-Fos活性神经元。本研究揭示刺激左侧迷走神经对NTS有作用,VNS诱发中枢食欲相关神经元反应。c-Fos活性神经元主要存在于左侧NTS,右侧NTSc-Fos神经元表达也增加。刺激迷走神经可兴奋双侧NS神经元,两侧迷走神经靠胸部和腹部分支相连,20%的传入神经轴突可在胸部交叉[13]。除了解剖学研究,其他食欲调节激素对NTS神经元的影响也不能被忽略。
刺激外周迷走神经引起中枢神经系统反应归因于传入刺激,VNS传出刺激也应考虑到。Pocai研究显示副交感神经环路肝葡萄糖产物减少,但不能表明与VNS相关的任何葡萄糖改变。不同实验模型和电极解剖位置可导致这种差异。结果证实VNS主要通过传入信号来发挥作用。
刺激迷走神经可影响控制食欲、体重和脂肪组织沉积的脑中枢。大鼠脂肪组织分布在不同部位,内脏脂肪主要在附睾脂肪垫沉积,这个部位脂肪容易取出。尽管附睾脂肪垫只代表总体重的一小部分,但研究显示附睾脂肪可用来评估总体重比例,与大鼠和小鼠总体脂量高度相关,附睾尾部脂肪含激素丰富[14]。本研究发现刺激迷走神经可改变身体成分,附睾脂肪块与体重相关,在VNS大鼠显著降低。长期VNS大鼠脂肪重量显著下降。
脂肪含量降低可能与血清瘦素水平降低有关,瘦素表达和释放与体质量和脂肪细胞数相关。脂肪细胞可产生瘦素,血清瘦素浓度主要依赖于机体脂肪组织含量。有文献报道瘦素参与摄食行为、体温、能量消耗和血压的调控。生理条件下瘦素可减少摄食。肥胖的形成与瘦素抵抗相关,瘦素抵抗伴随血清瘦素水平增加,因此肥胖患者瘦素水平升高。Morton等人研究发现催产素可消除这种效应。迷走神经通路在瘦素分泌中也起重要作用。Cigaina报道瘦素水平降低与胃电起搏患者体重减轻高度相关。Wang和Liu在切断迷走神经或胃旁路手术大鼠未发现瘦素水平改变;但是瘦素浓度降低,与体重减轻相关。之前研究报道VNS大鼠可减低血清瘦素浓度,与摄食和体重增加减少有关。若VNS模型通过瘦素释放来减少摄食,那么血清瘦素水平应该升高,但结果相反。因此推测VNS瘦素浓度降低与体重降低和脂肪组织减少有关,而不受迷走神经调控。
本实验中VNS可减少摄食,故推测ghrelin(促食欲分子)分泌可能受抑制,但观察结果相反。Ghrelin主要来源于胃和十二指肠,垂体细胞、下丘脑、肝脏、肾脏和胚胎中也含有ghrelin[15]。Ghrelin有促食欲作用,引起动物和人类摄食增加,其具体机制涉及迷走神经和下丘脑神经元的激活。餐前ghrelin水平升高,餐后迅速降低。Ghrelin水平与体重呈负相关,肥胖个体ghrelin水平降低,可标准化摄食。电刺激VNS血清ghrelin水平显著升高。Cigaina[16]称病态肥胖患者行胃起搏,整个刺激过程中血清ghrelin水平均增加。尽管胃起搏不直接刺激迷走神经,但推测迷走神经参与胃起搏后ghrelin释放。Gallas短暂性电刺激(1 h)大鼠胃研究可证明这一观点,他们发现胃细胞ghrelinmRNA水平升高可能是ghrelin分泌增加及血清ghrelin水平增高的结果。Bansal鼠脑创伤模型研究表明短期(2~6 h)VNS可显著升高血清ghrelin水平,具体机制还不清楚。Roux报道迷走神经切断术患者ghrelin无促进摄食作用,提示ghrelin作用涉及迷走神经等外周机制。Murakami推测ghrelin调控体重和摄食作用有外周和中枢两种不同的机制。Cummings证明ghrelin显著升高伴随体重降低,胃旁路术可显著抑制ghrelin水平。Kamiji报道迷走神经切断术和胃切除术患者ghrelin水平降低。Wang和Liu也报道胃旁路术和迷走神经切断治疗肥胖动物模型ghrelin水平降低伴随体重减轻。
Huang等推测背部或腹侧迷走神经对ghrelin释放作用相反,ghrelin释放依赖VNS频率。研究中血清ghrelin水平升高与VNS引起摄食和体重减少的机体反应相关,且VNS可影响外周环路引起ghrelin释放增加。
Oh等首次发现nesfatin-1,来源于NEFA/NUCB2的含有82个氨基酸的厌食肽[17],侧脑室注射nesfatin-1可显著减少大鼠摄食。禁食24 h可有效降低室旁核(PVN)NUCB2表达,重新摄食可激活PVN nesfatin-1免疫活性神经元,提示nesfatin-1在调节摄食中具有重要作用。Nesfatin/NUCB2免疫活性神经元还存在于弓状核(ARC)中,与阿黑皮素原(POMC)和可卡因-苯丙胺反应性转录神经元(CART)共存。此外,nesfatin-1可双向通透血脑屏障。
只有少数研究在VNS和肥胖条件下检测nesfatin-1。Shimizu报道腹腔内注射nesfatin-1可减少摄食。Stengel研究发现nesfatin-1免疫活性细胞存在于大鼠胃黏膜,大多数nesfatin-1可与ghrelin共表达。且禁食24 h后胃内分泌细胞NUCB2mRNA表达下调,故认为nesfatin/NUCB2基因表达受营养状态调节。为阐明nesfatin-1调节机制,Li[18]观察糖尿病患者口服葡萄糖后nesfatin-1水平波动,发现禁食后nesfatin-1浓度下降,但葡萄糖摄取不影响血浆nesfatin-1水平,提示胃化学感受器不能充分反映nesfatin水平。本研究中给予大鼠高脂饮食,血清nesfatin-1水平未研究。Tan等在对肥胖患者研究中发现nesfatin-1水平升高与体重指数(BMI)、体脂含量和肥胖明显相关。此外,血浆nesfatin-1水平与脑脊液nesfatin-1水平呈负相关,提示肥胖个体可能出现nesfatin-1抵抗。
本研究中刺激迷走神经升高血清nesfatin-1水平,但是没有足够的证据来确定是VNS或高脂饮食作用,还是外周或中枢机制减少了摄食、体重和脂肪含量。血清nesfatin-1水平升高伴随VNS可产生厌食作用,但其具体机制还有待进一步研究。Shimizu研究支持这一观点,腹腔内注射M30(nesfatin-1中间活性片段)可通过迷走神经引起小鼠厌食,辣椒素阻断迷走神经则可消除这一反应。
本实验证明刺激迷走神经可致高脂饮食诱导肥胖大鼠出现摄食和体重增加减少,显微电刺激产生电信号,通过迷走传入纤维传输饱感信号,作用于中枢神经环路以调节体重、摄食和体脂含量。此外VNS升高血清nesfatin-1水平,也可能导致体重和脂肪含量减少。因此,迷走神经刺激有望成为治疗肥胖的新方法。
[1]Morton GJ,Cummings DE,Baskin DG,et al.Central nervous system control of food intake and body weight[J].Nature,2006,443(92): 289-295.
[2]Mayer J.Glucostatic mechanism of regulation of food intake[J].Obes Res,1996,4(9):493-496.
[3]Quadri S,Prathipati P,Jackson DW,etal.Haemodynamic consequences of recurrent insulin-induced hypoglycaemia[J].Clin Exp Pharmacol Physiol,2014,41(1):81-88.
[4]Lemmens SG,Martens EA,Kester AD,et al.Changes in gut hormone and glucose concentrations in relation to hunger and fullness[J].Am J Clin Nutr,2011,94(3):717-725.
[5]CamilleriM,Toouli J,Herrera MF,et al.Intra-abdominal vagal blocking(VBLOC therapy):clinical resultswith a new implantablemedicaldevice[J].Surgery,2008,143(64):723-731.
[6]Ziomber A,Juszczak K,Kaszuba-Zwoinska J,et al.Magnetically induced vagus nerve stimulation and feeding behavior in rats[J].J PhysiolPharmacol,2009,60(34):71-77.
[7]Kozak LP,Newman S,Chao PM,et al.The early nutritional environmentofmice determines the capacity for adipose tissue expansion by modulating genes of caveolae structure[J].PLoS One,2010,5(6): e11015.
[8]Gil K,BugajskiA,Kurnik M,etal.Physiologicalandmorphologicaleffectsof long-term vagalstimulation in diet induced obesity in rats[J]. JPhysiolPharmacol,2009,60(3):61-66.
[9]HaririN,Thibault L.High-fat diet-induced obesity in animalmodels [J].Nutr ResRev,2010,23(6):270-299.
[10]Krolczyk G,Laskiewicz J,Sobocki J,et al.The effects of baclofen on the feeding behaviour and body weightof vagally stimulated rats[J].J PhysiolPharmacol,2005,56(21):121-131.
[11]Val-Laillet D,Biraben A,Randuineau G,et al.Chronic vagus nerve stimulation decreased weightgain,food consumption and sweet craving in adultobeseminipigs[J].Appetite,2010,55(14):245-252.
[12]Stroth N,Liu Y,Aguilera G,et al.Pituitary adenylate cyclase-activating polypeptide controlsstimulus-transcription coupling in thehypothalamic-pituitary-adrenalaxis tomediate sustained hormone secretion during stress[J].JNeuroendocrinol.2011,23(10):944-955.
[13]Richardson J,Cruz MT,Majumdar U,et al.Melanocortin signaling in the brainstem influences vagal outflow to the stomach[J].JNeurosci. 2013,33(33):13286-13299.
[14]Kreier F,Fliers E,Voshol PJ,etal.Selective parasympathetic innervation of subcutaneous and intra-abdominal fatfunctional implications [J].JClin Invest,2002,110(43):1243-1250.
[15]KojimaM,Hosoda H,Date Y,etal.Ghrelin isagrowth hormone releasingacylated peptide from stomach[J].Nature,1999,402(39):656-660.
[16]Cigaina V,Hirschberg AL.Plasma ghrelin and gastric pacing inmorbidly obese patients[J].Metabolism,2007,56(31):1017-1021.
[17]Oh I,Shimizu H,Satoh T,et al.Identification of nesfatin-1 as a satiety molecule in thehypothalamus[J].Nature,2006,443(96):709-712.
[18]LiQC,Wang HY,Chen X,etal.Fasting plasma levels of nesfatin-1 in patientswith type1 and type2 diabetesmellitusand thenutrient-related fluctuation of nesfatin-1 level in normal humans[J].Regul Pept, 2010,159(142):72-77.
The Study of Electrical Vacus Nerve Stim u lation on Food Consum p tion And Weigh t Gain in Rats Feded the H igh-fat Diet
LiGe,W ang Qiaoling,Pang M ingjie⋆,Zhu Hai⋆,Xu Luo⋆
(MedicalCollege ofQingdao University,Qingdao 266021,Shandong;*Qingdao MunicipalHospital,Qingdao)
Ob jectiveTo investigate the effectof high frequency(10 Hz)VNS on feeding behavior,appetite,peptide secretion in rats fed a high-fat diet,and to explore themechanisms of VNSon the regulation of feeding and weight.M eth⁃odsAdultmaleWistar ratswere done laparotomy surgery,each implanted subcutaneously w ith amicrostimulator(MS). The vagus nerves beneath diaphragma were w rapped by MS.The left vagus nerve was stimulated by rectangular electrical pulses(10ms,200mV,10Hz,12 h a day)generated by theMS.Body weightand food intakeweremeasured eachmorning. At theend of the experimentalperiod,animalswereeuthanized and blood sampleswere taken.Serum levelsof ghrelin,leptin and nesfatin-1 were assessed using radioimmunoassays.Adipose tissue contentwas evaluated by weighing epididymal fat pads,which were incised at the time of sacrifice.Using immunohistochemical to detecte the expression of c-Fos neurons in solitary nucleus(NTS).Resu ltsChronic vagus nerve stimulation significantly decreased food intake(P<0.05),body weight gain(P<0.05)and epididymal fatpad weight(P<0.05)in animals that
VNS compared w ith controlanimals.Signifi⁃cantneuronal responses in the NTSwere observed follow ing VNS.Finally,compared w ith control animals and sham group, chronic vagus nerve stimulation group serum concentrations of ghrelin were increased(P<0.05),while serum levels of leptin were decreased(P<0.05).Although not significant,serum nesfatin-1 levelswere also elevated.Conclusions VNS leads to reductions in food intake,body weightgain and adipose tissue by increasing brain satiety signals conducted through the va⁃galafferents.VNSalso evoked a feed-related hormonal response.
Bodyweight;Ghrelin;Leptin;Nesfatin-1;Nucleusof the solitary tract;Vagusnerve stimulation
R542.22
A
1008-4118(2014)02-0001-06
2014-03-11
10.3969/j.issn.1008-4118.2014.02.01

