磷酸亚铁锂中亚铁和三价铁质量分数的测定
朱永明,张 静,胡会利,于元春
(哈尔滨工业大学(威海)海洋科学与技术学院,264209 山东威海)
磷酸亚铁锂中亚铁和三价铁质量分数的测定
朱永明,张 静,胡会利,于元春
(哈尔滨工业大学(威海)海洋科学与技术学院,264209 山东威海)
为解决传统滴定法中由于滤碳造成的亚铁氧化问题,避免由操作者对颜色的敏感度不同造成的误差,采用电位滴定法测定磷酸亚铁锂复合材料中亚铁质量分数,以EDTA络合滴定法、分光光度法测定全铁质量分数.结果表明:试样中亚铁质量分数为32.703%,标准偏差为0.059%,置信度为95%的置信区间为(32.703±0.062)%;三价铁质量分数为1.235%.为磷酸亚铁锂复合材料中二价铁及三价铁的测定提出了一种切实可行的精确测量方法.
磷酸亚铁锂;电位滴定;络合滴定法;分光光度法
铁的测定方法主要有化学滴定法[1-2]、分光光度法[3-6]、伏安极谱法[7-9]、库伦滴定法[10-11]等.传统方法测定磷酸亚铁锂中亚铁的质量分数需要过滤以消除碳对显色及颜色变化的遮蔽,但是亚铁容易氧化,影响测量精度.综合考虑磷酸铁锂的易氧化问题及实验操作成本、简易程度等因素,在惰性气体保护下采用电位滴定法[12-13]测定亚铁质量分数.由于三价铁质量分数少,直接测量误差较大,采用分光光度法测定全铁质量分数减去亚铁质量分数进而计算出三价铁质量分数.此外,由于碳的存在很难直接判断试样是否完全溶解,进行多组测试确定了试样完全溶解所需的盐酸量及溶解时间.
1 实 验
1.1 仪器与试剂
磷酸铁锂样品由欧赛科技有限公司提供.测试时的硫酸亚铁铵、重铬酸钾、盐酸、双氧水、磺基水杨酸、还原铁粉等均为分析纯试剂.
pH为10的氨-氯化铵缓冲溶液(溶解20 g氯化铵于少量蒸馏水中,加入100 mL浓氨水,用蒸馏水稀释至1 L).pH为9.5的氨-氯化铵缓冲溶液(溶解29 g氯化铵于少量蒸馏水中,加入33 mL浓氨水,用蒸馏水稀释至500 mL).
经济型自动电位滴定仪(702SM,瑞士万通中国有限公司),紫外线分光光度计(TU1990,上海棱谱仪器仪表有限公司),恒电位仪(DJS-292,河南鑫鸿泰轻金科技有限公司).
1.2 实验方法
1.2.1 亚铁的测定方法
电位滴定法[13]是依据电极电位的突跃来指示滴定终点.在滴定到达终点前后,待测液中的待测离子浓度往往连续变化n个数量级,引起电位的突跃,被测成分的质量分数仍然通过消耗滴定剂的量来计算.以硫酸亚铁铵为标准试样用电位滴定法测量亚铁质量分数,与理论值比较得出电位滴定法测量结果的误差为-0.14%.说明电位滴定法测定亚铁质量分数非常精确,结果可信.使用电位滴定法测量磷酸铁锂中亚铁质量分数,以标准的重铬酸钾溶液为滴定剂,进行氧化还原滴定,采用铂复合电极测试电位变化,滴定在搅拌条件下进行以保证溶液各处浓度均匀.在滴加待测试样时,由于发生化学反应,Fe2+的浓度不断变化,因而电极电位发生变化,在滴定终点附近,Fe2+的浓度发生突变,引起电极电位的突跃,记录消耗的重铬酸钾溶液体积与电位关系,绘制其一阶导数曲线,根据电位突跃点,即一阶导数折点确定消耗滴定剂的体积,由式(1)计算出结果,即
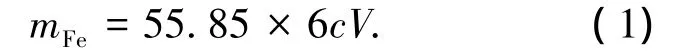
式中:mFe为试样中亚铁的质量,g;c为重铬酸钾标准溶液的浓度,mol/L;V为滴定消耗重铬酸钾的体积,mL.
1.2.2 三价铁的测定方法
1)化学滴定法.在测定全铁时,用 H2O2将亚铁全部氧化为三价铁,以磺基水杨酸为指示剂,用EDTA进行络合滴定.因为在pH=10的条件下磺基水杨酸与 Fe3+络合形成紫红色物质,用EDTA滴定时,Fe3+与EDTA络合形成黄色化合物,所以,当达到滴定终点时溶液由紫红色变为黄色,得出消耗EDTA的体积,按照式(2)计算出全铁的质量,即

式中:c为EDTA准溶液的浓度,mol/L;V为滴定消耗EDTA的体积,mL.
2)分光光度法.根据朗伯(Lambert)-比尔(Beer)定律:A=abc,当固定溶液层厚度和吸光系数时,吸光度A与溶液的浓度成线性关系.先用已知纯度的铁粉做出标准曲线,再测量试样的吸光度,在标准曲线上找到对应的浓度值.
2 结果与分析
2.1 亚铁离子测定结果
2.1.1 试样的溶解
取100 mg的LiFePO4/C试样,分别用10 mL盐酸(体积比为1∶1)在惰性气体保护下溶解1,3,5,8,10 min,用电位滴定法测定其亚铁的质量分数,结果如图1所示.可以看出,用盐酸(体积比为1∶1)溶解LiFePO4/C复合正极材料,溶解时间为5~10 min为宜.
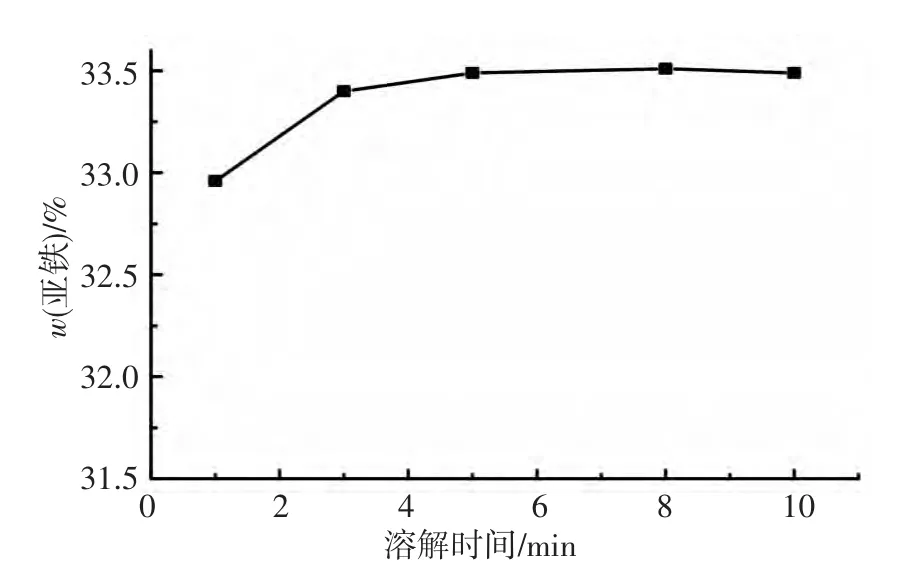
图1 样品溶解时间与测得亚铁质量分数的关系
取300 mg左右的LiFePO4/C试样,分别用2,5,8,10 mL 的盐酸(体积比为1 ∶1)溶解8 min,用电位滴定法分别测定亚铁的质量分数,结果如图2所示.可以看出,每溶解100 mg LiFePO4/C复合正极材料样品所需盐酸量以2 mL为宜.
2.1.2 亚铁的测定结果及误差分析
分别称取不同质量的试样采用电位滴定法进行测量,电位随滴定体积的变化曲线如图3所示.
由图3和式(1)可计算出亚铁的质量,进而求出样品中亚铁的质量分数,结果见表1.
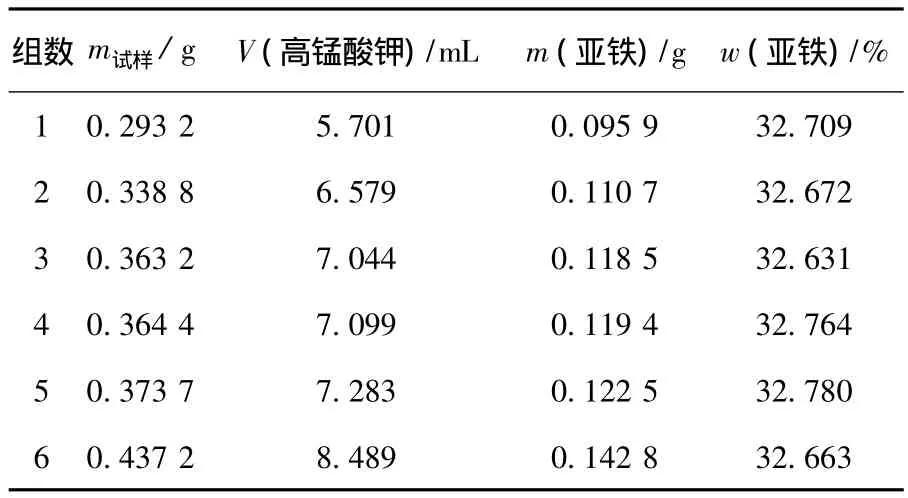
表1 电位滴定法测得的亚铁质量分数
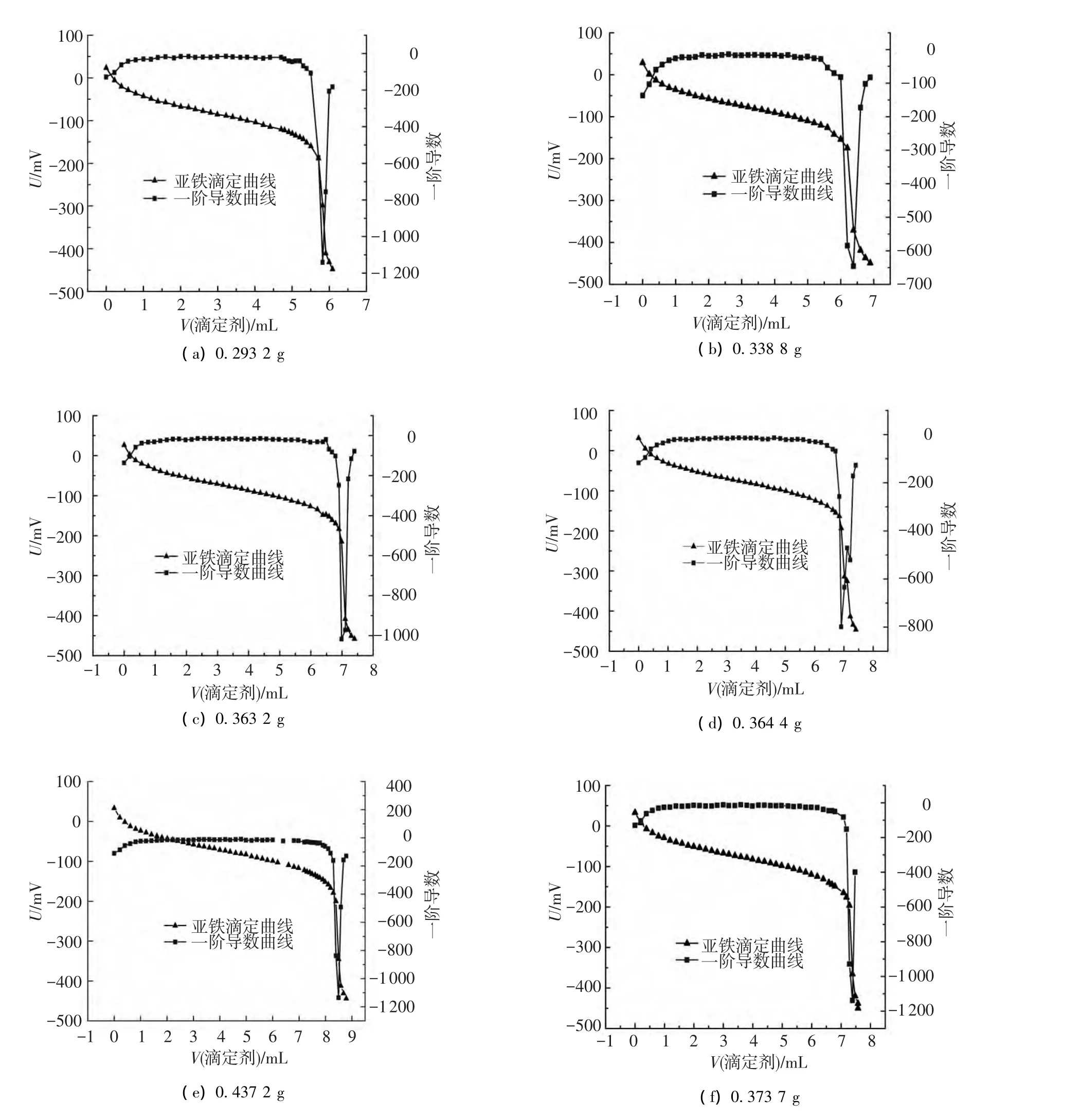
图3 不同试样的亚铁电位滴定曲线及微分曲线
表1中所得亚铁的质量分数平均值为
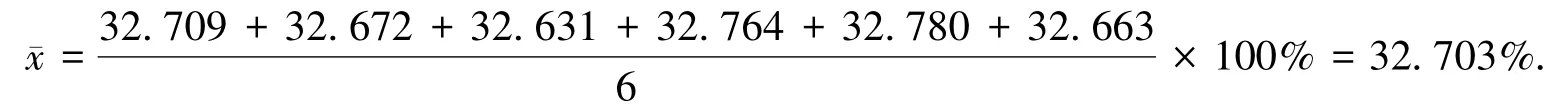
其标准偏差
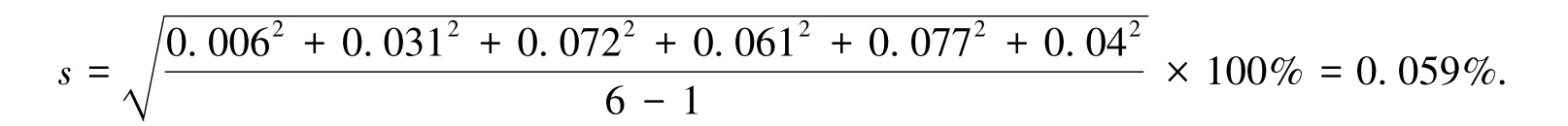
置信度为95%,n=6时,t=2.571,因此
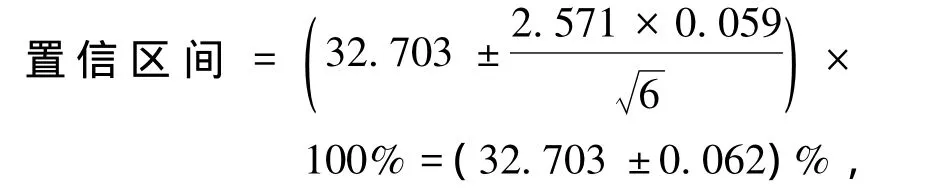
即平均值的置信区间取(32.703±0.062)%,真值在其中出现的概率为95%.
2.2 全铁的测定及三价铁质量分数的计算
因为磷酸铁锂中三价铁质量分数很少,且在溶液中亚铁容易氧化,直接测定三价铁误差较大,本实验采用测出全铁减去亚铁得到三价铁的质量分数.
2.2.1 化学滴定法测定结果
滴定全铁时可以将亚铁全部氧化为三价铁,再进行配位滴定.在进行化学滴定时要注意:进行配位滴定时首先要标定EDTA;要确保亚铁全部氧化.
称取3.819 6 g试样,溶解后定容到250 mL的容量瓶中,移取10 mL分别进行3组实验,结果如表2所示.
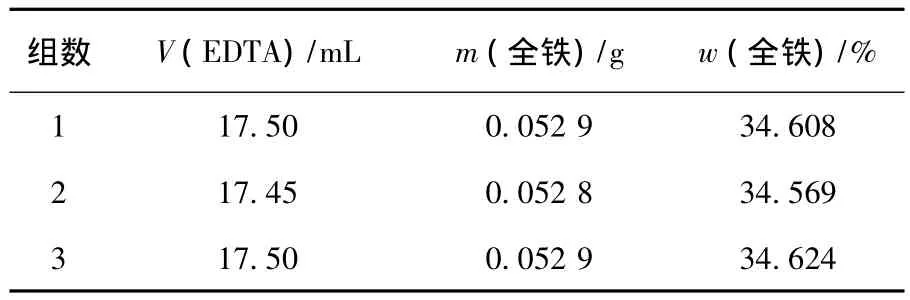
表2 化学滴定法测得的全铁质量分数
样品中全铁质量分数的平均值

即平均值的置信区间取(34.600±0.069)%,真值在其中出现的概率为95%.
试样中三价铁的质量分数等于全铁质量分数减去亚铁的质量分数,即w(三价铁)=34.600%-32.703%=1.897%.
试样中二价铁和三价铁的质量分数比为32.703/1.897=17.239.
2.2.2 分光光度法测定结果
在用分光光度法测定全铁质量分数时应注意:先测定显色时间;绘制标准曲线时应先测定铁粉的纯度.
分光光度法测得的浓度与吸光度的关系见表3.绘制的标准曲线如图4所示.
由图4可知线性回归方程为:y=0.019 74+4.319 080x,线性相关系数 R2=0.976 33.
测得试样的吸光度为0.180,代入标准回归方程:y=0.019 74+4.319 080x,得 c=3.71×10-5mol/L.所以,原试样中铁的质量 m=c×0.05×50×250×55.85=1.296 3 g.
w(铁)=m÷3.819 6×100%=33.938%.
三价铁质量分数等于全铁减去二价铁的质量分数,所以,w(三价铁)=(33.938-32.703)%=1.238%.
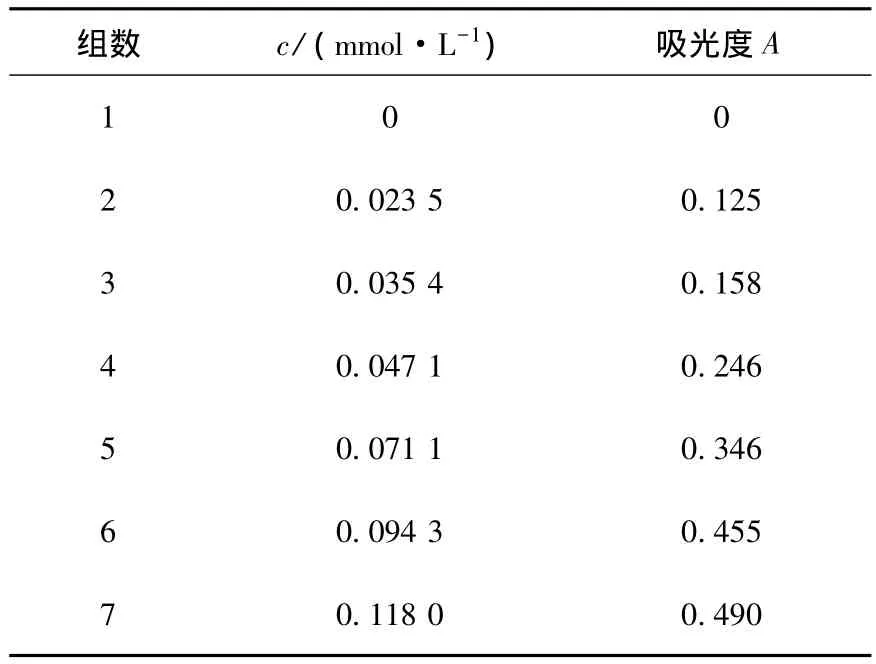
表3 浓度对吸光度的影响
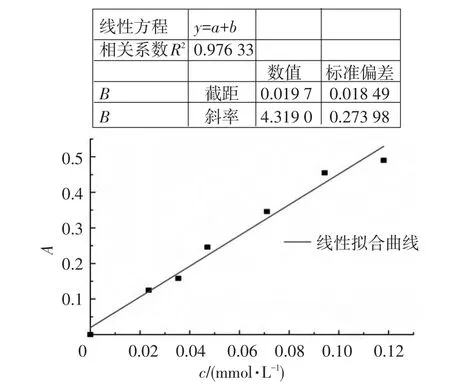
图4 分光光度法测得三价铁的标准曲线
试样中二价铁和三价铁的质量分数比为32.703/1.238=26.416.
在化学滴定法测定全铁质量分数时,溶液由紫红色变为黄色为滴定终点,颜色变化不明显,存在一定的误差,所以,与分光光度法测定全铁质量分数有一定的偏差.
3 结论
1)在惰性气氛下,每100 mg磷酸铁锂试样用2 mL盐酸(1∶1)溶解6 min可完全溶解.
2)电位滴定法测定亚铁质量分数结果准确可靠.用电位滴定法测得亚铁的质量分数为32.703%,标准偏差为0.059%,置信度为95%的置信区间为(32.703±0.062)%.
3)化学滴定法和分光光度法计算得到的三价铁质量分数分别为1.897%、1.238%.化学滴定法滴定终点的判断依据是试剂颜色由紫红色变为黄色,颜色变化不是很明显,可能存在一定误差.
4)电位滴定法测定时无需过滤碳,减少了亚铁的氧化,步骤简单,终点易于判断,结果可靠,可为判断LiFePO4/C复合正极材料的性能提供直接依据.
5)三价铁的质量分数用全铁的质量分数减去亚铁的质量分数,测定全铁时将亚铁全部氧化测定三价铁质量分数,此过程中不存在氧化问题,可以采用电位滴定法、化学滴定法、分光光度法等.
[1]解洪伟,谷海军.补铁剂中铁的测定[J].化学教学,2002(3):8-9.
[2]欧阳曦,万里城,李启,等.磷酸亚铁锂正极材料中二价铁及三价铁质量分数的测定方法:中国,101464413A[P].2007-12-21.
[3]甘晖,黄嘉福,郭婧文,等.环境友好正极材料磷酸亚铁锂中铁、磷的测定[J].福建师范大学学报:自然科学版,2004,20(4):54-57.
[4]苗郁,陈改荣.磷酸亚铁锂复合碳正极材料中锂、铁的测定[J].平原大学学报,2006,23(6):128-129.
[5]张琨,邓小川,宋士涛,等.合成正极材料磷酸亚铁锂中铁和磷质量分数的测定[J].盐湖研究,2008,16(4):37-41.
[6]钟国秀,杨浩义,卢钒.硫氰酸钠光度法测定LiFePO4中的铁[J].化学分析计量,2011,20(4):63-64.
[7]何金兰,杨克让,李小戈.仪器分析原理[M].北京:科学出版社,2002.
[8]周燕.伏安极谱法测定正极材料磷酸亚铁锂中Fe3+、Fe2+[J].广东化工,2009,7(36):316-323.
[9]龙爱民,党爱翠,程元月,等.海水中溶解态铁的伏安极谱法与液芯片波导光纤法测定[J].海洋学报,2009,31(1):152-156.
[10]何跃武,焦继岳.恒电流库仑分析方法测定铁[J].湖南有色金属,2000,16(2):45-46.
[11]梁述忠,陈文辉.恒电流库仑分析法测定硫酸亚铁铵等基准试剂的纯度[J].化学分析计量,2005,14(5):24-26.
[12]VLADIMIROVA L S,KOCHEV V K.Potentiometric assessment of iron release during ferritin reduction by exogenous agents[J].Analytical Biochemistry,2010,404:52-55.
[13]何武强.络合滴定法和电位滴定法测定自来水中Ca2+、Mg2+比较[J].河南化工,2010,27(12):56-57.
The determination of ferrous and ferric ion in LiFePO4
ZHU Yongming,ZHANG Jing,Hu Huili,Yu Yuanchun
(School of Marine Science and Technology,Harbin Institute of Technology at Weihai,264209 Weihai,Shandong,China)
In order to avoid the oxidation of ferrous ions to trivalent iron,as well as the inevitable error caused by the different color sensitivity of researchers,the total content of iron(Ⅱ)ions in the LiFePO4was determined by the potentiometric titration method,while the total iron content was determined by EDTA complexometric titration and spectroscopy method.The results show that the ferrous ion content in the LiFePO4provided by factory is 32.703%,of which RSD is 0.059%(n=6),the 95%confidence interval of iron(Ⅱ)is(32.703±0.062)%,and the content of trivalent iron is 1.235%.The potentiometric titration is a reliable method to measure the content of ferrous ion and trivalent iron in LiFePO4.
LiFePO4;potentiometric titration;complexometric titration;spectrphotometric
O655.2
A
0367-6234(2014)02-0061-05
2013-02-03.
中国博士后基金资助项目(2012M520717).
朱永明(1977—),男,副教授.
朱永明,hitonline@163.com.
(编辑 刘 彤)

