MBR膜污染过程中微生物群落结构与代谢产物分析
高大文,辛晓东
(哈尔滨工业大学城市水资源与水环境国家重点实验室,150090 哈尔滨)
MBR膜污染过程中微生物群落结构与代谢产物分析
高大文,辛晓东
(哈尔滨工业大学城市水资源与水环境国家重点实验室,150090 哈尔滨)
针对MBR运行中膜污染问题,利用T-RFLP手段分析不同运行控制下两套相同的A/O-MBR装置(R1、R2)膜污染过程中微生物群落结构变化规律,检测不同过膜压力pTM下Cake层、混合液微生物代谢产物浓度.结果表明:R1反应器(温度为30℃,SRT为60 d、膜通量(Flux,FM)为9.09 L/(m2·h),DO为4 mg/L)膜污染周期为30 d,Cake层优势种群依次为Oribacterium、Cytophagasp.、Anaeromyxobacter、Paracoccus、bp180 和Comamonadaceae,膜丝表面优势种群依次为Saprospiraceae、Nitrospira、Thiothrixsp.和 bp92;R2 反应器(温度为 20 ℃,SRT 为 30 d,FM为 13.42 L/(m2·h),DO为2 mg/L)膜污染周期为11 d,Cake层优势种群依次为Anaeromyxobacter、Oribacterium、Saprospiraceae和Myxobacterium,膜丝表面优势种群依次为Thiothrix Eikelboomii、γ-Proteobacterium、Nitrospira、Thiothrixsp.和 bp52.控制策略的差异对微生物群落演替具有显著影响.Cake层和膜丝表面微生物多样性增大可能导致膜污染加重.微生物代谢产物(EPS、SMP)浓度升高会导致膜污染进程加剧,Cake层中EPS对膜污染具有主要贡献作用.
缺氧-好氧膜生物反应器;膜污染;微生物群落结构;胞外聚合物;溶解性微生物代谢产物
由微生物因素导致的不可逆膜污染问题限制了膜生物反应器(MBR)大规模推广[1-2].目前,许多研究表明,胞外聚合物(EPS)以及溶解性代谢产物(SMP)对膜污染有重要影响[3-5],膜污染越严重时,微生物代谢产物浓度越高,暗示了其对膜污染具有重要贡献作用.同时,有研究认为微生物群落结构的变化对膜污染也具有贡献作用[6-9],膜污染的发生发展过程中,优势微生物种群不断演替,并且易形成可分泌大量黏性物质的顶级群落.膜组件运行过程中,Proteobacteria和Bacteroidetes容易成为优势种群,此时膜组件易被污染,膜污染周期较短,微生物群落的演替与膜污染进程密切相关[9].但是,目前很少有研究将微生物群落与微生物代谢产物浓度两者结合,综合探讨膜污染的发生发展机理.为此,针对运行条件的变化对膜污染的影响,分析了不同膜污染周期下微生物代谢产物的浓度变化和微生物群落演替规律,获得了微生物代谢产物、微生物群落结构与膜生物污染的潜在相关关系,为探明膜污染机制提供相应理论依据,为今后A/O-MBR工艺在实际应用中的膜污染问题提供理论指导和技术支持.
1 实 验
1.1 实验装置
A/O-MBR装置如图1所示,同时运行两套平行的A/O-MBR系统(分别称为R1和R2).装置材质为有机玻璃,分为缺氧段和好氧段两部分,有效体积均为8 L.缺氧池连续搅拌转速为200~250 r/min,好氧池为微孔曝气,间歇出水的抽吸时间(min)比为12∶3.膜组件为日本三菱公司生产的PE中空纤维膜,膜表面孔径为0.4 μm,有效面积0.11 m2.
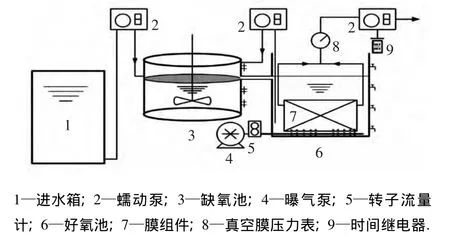
图1 A/O-MBR反应器装置
1.2 进水水质和污泥
进水为人工模拟污水[10],进水水质:CODCr为295~335 mg/L,pH 为 7.1~7.8,NH4+-N 为 37~42 mg/L.
实验污泥取自哈尔滨文昌污水处理厂,污泥经驯化后反应器稳定运行,污泥质量浓度维持在3 000~4 000 mg/L.
1.3 运行条件
R1、R2运行条件见表1.

表1 反应器运行条件
分别记录R1、R2反应器在一个膜污染周期中过膜压力(pTM)的变化.R1、R2反应器的膜污染周期分别约为30和11 d.
1.4 实验方法
1.4.1 常规检测方法
每两天测定R1、R2反应装置的进水、缺氧池、好氧池以及出水中的CODCr、NH4+-N、NO2-N、NO3--N、DO、温度、pH 等.采用国家标准方法测定 CODCr、NH4+-N、NO2--N、NO3--N[11],DO、温度、pH等利用WTW(pH/oxi340i)手提式多参数测定仪测定.
1.4.2 膜污染进程检测方法
自置入未污染膜组件开始,每天记录真空膜压力表中pTM变化情况,当pTM达0.04 MPa时,一个膜污染周期结束.污染的膜组件经物理、化学清洗后再置入好氧池混合液,开始下一周期运行.
1.4.3 EPS、SMP 分析方法
SMP主要存在于液相中,EPS主要存在于污泥相中,压实在膜组件表面形成的凝胶层中[12].有文献报道Cake层中也存在SMP[13].
EPS 的提取分离采取甲醛-NaOH 法[14],SMP的提取采用离心过滤获得[15].采用苯酚-浓硫酸法测定EPS、SMP中的多糖浓度[16],改良型 BCA法(上海生工试剂盒)分别检测 EPS、SMP中的蛋白浓度.
1.4.4 生物样品处理方法
Cake层样品分离和分析方法:挑取已污染膜组件的1~2根膜丝,剪取中间位置约2 cm等长的一段,使用等量的冲洗液冲洗所有样品,Cake层被冲洗下来,将泥水混合物收集于离心管中,进行DNA的提取和 EPS的测定.泥饼层微生物DNA的提取直接按照DNA提取试剂盒(北京天恩泽)进行,泥饼层中EPS的测定参照1.4.3.
膜丝表面样品分离和分析方法:被冲洗后的膜丝放入1.5 mL离心管中,加入1 mL PBS缓冲液.膜丝表面微生物的分离首先经过超声细胞破碎仪的超声探头处理,调节超声强度,将膜丝表面微生物通过震动脱离到离心管内的PBS缓冲液中,按照DNA提取试剂盒进行DNA提取.
1.4.5 微生物群落分析
在前期研究中结合末端标记限制性酶切片段长度多态性分析(T-RFLP)技术、单克隆技术与测序技术等分子生物学手段构建了针对此A/OMBR系统的微生物群落文库,本文库微生物种群核酸序列通过与NCBI中Genbank的库存物种序列比对,相似度均为99%.T-RFLP手段已经广泛应用于环境样品的微生物群落结构分析[17],精确性高[18].
实验采用的PCR引物为带有FAM标记的8F和1492R,限制性内切酶为AfaI.酶切产物交由上海生工测序,操作流程参考文献[19].
2 结果与讨论
2.1 运行效果对比
R1、R2反应器在各自运行条件下分别经过30 d、20 d左右后达到稳定,随机检测在一个膜污染周期中对COD和NH4+-N的处理效果,结果如表2所示.R1、R2在运行条件上存在差异,但对COD的去除率保持在95%以上,对氨氮的去除率保持在90%以上.这说明本研究中运行条件的差异对于反应器的处理效果影响不明显,两运行条件均能够维持A/O-MBR反应器的高效稳定性.

表2 R1、R2反应器处理效果
2.2 膜污染分析
R1反应器中pTM随时间的增长分阶段变化.首先在1~6 dpTM增长较快,大量的无机有机颗粒、生物大分子等在膜表面聚集,形成初步的生物膜结构,平均膜污染速率为2 kPa/d.7~25 dpTM的增长进入缓慢阶段,生物膜开始缓慢生长,逐步加厚[20],平均膜污染速率为 0.89 kPa/d.26 d 以后,pTM增长进入快速阶段,到第30天时,pTM达0.04 MPa,平均膜污染速率为2.5 kPa/d.生物膜表面Cake层的加厚和压实大大减小了膜组件的通透性,滤阻加大,表现为膜通量的降低,甚至出现不出水现象.R2反应器膜污染周期较短,1~4 d为膜的快速污染阶段,平均膜污染速率为4 kPa/d.5~8 d伴随着Cake层的形成和发展,为缓慢污染阶段,平均膜污染速率为2 kPa/d,第9~11天,由于Cake层的稳定和压实,pTM的增长进入快速阶段,平均膜污染速率为3 kPa/d,见图2.
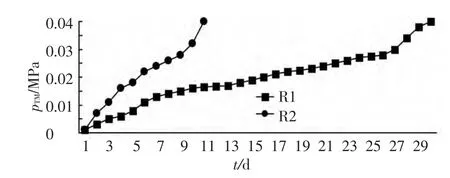
图2 R1、R2反应器pTM随时间变化
由图2可以看出,R1反应器较R2能够显著减缓膜的污染进程,这说明操作条件与MBR内系统的整体功能密不可分,操作条件的变化能够显著改变膜污染进程.
2.3 微生物群落结构分析
2.3.1 Cake层中微生物群落结构分析
在前述的膜污染周期内,不同的显著pTM值下分别对R1、R2反应器的膜组件Cake层取样,利用T-RFLP分子生物学手段进行微生物群落结构分析,结果如图3所示.
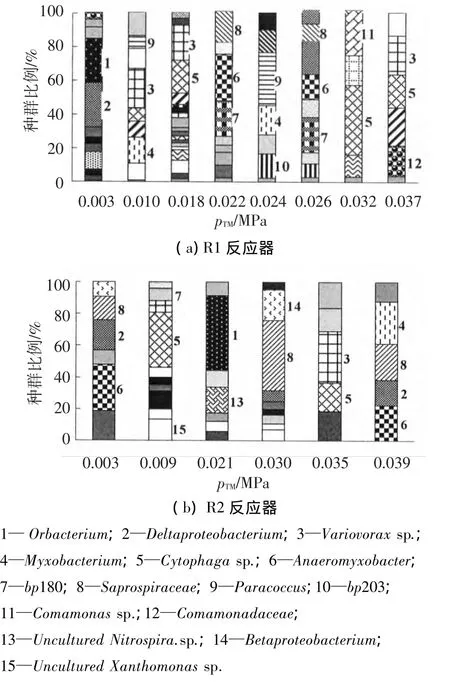
图3 膜污染进程中Cake层T-RFLP群落结构图谱
由图3可以看出,在膜污染初始快速污染阶段(pTM为0.003 MPa时),R1反应器Cake层的优势种群为Oribacterium(毛螺旋菌属)和Deltaproteobacterium(变形菌属),此时Cake层微生物群落的丰度为11;R2反应器Cake层的优势种群为Anaeromyxobacter(厌氧粘细菌),此时R2反应器的丰度为6,低于R1反应器.
在缓慢污染阶段 (pTM为 0.015~0.030 MPa),R1反应器Cake层优势种群分别为Cytophagasp. (噬 纤 维 菌 属)、Anaeromyxobacter(厌氧粘细菌)、Paracoccus(副球菌属).根据伯杰细菌鉴定手册,噬纤维菌属的特性是好氧或兼性厌氧,碳源足够时易分泌胞外聚合物.副球菌属可以积累聚β羟基丁酸盐、能进行反硝化作用,表面产生一层黏液,细胞之间可以黏在一起.这些都是在膜污染中较常见菌属,均分泌大量的代谢产物,对膜污染进程具有重要贡献.此时丰度依次为18,8,6和8;R2 Cake层的优势种群为Oribacterium(毛螺旋菌属)和Saprospiraceae(腐螺旋菌科),腐螺旋菌科的最适温度为30~37℃,pH为7,可代谢葡萄糖、半乳糖、醋酸盐等.此时丰度依次为7和9.从整体看R2反应器Cake层的丰度值低于R1.
在pTM为0.037 MPa时,R1反应器Cake层中的优势种群为Comamonadaceae(丛毛单胞菌科),这与文献[21]膜污染后期Comamonassp.等为优势菌群的结论相符,此时丰度值为5.R2反应器在0.039 MPa时 Cake层中的优势种群为Myxobacterium(粘细菌属),丰度值为5.到膜污染后期,两个反应器的微生物丰度达到一致.
总体来说,R1反应器 Cake层优势种群为Deltaproteobacteriu(变 形 菌 属 )、Anaeromyxobacter(厌氧粘细菌)、Paracoccus(副球菌属)、bp180、Cytophagasp.(噬纤维菌属).根据伯杰细菌鉴定手册,这些菌属可分泌细胞代谢产物,影响膜污染后期微生物代谢产物浓度的变化,从而导致pTM显著上升.R2反应器Cake层优势种群为Anaeromyxobacter(厌氧粘细菌)、Cytophagasp.(噬纤维菌属)、Oribacterium(毛螺旋菌 属) 、Saprospiraceae(腐 螺 旋 菌 科)、Variovoraxsp.(贪噬菌属)和Myxobacterium(粘细菌属).这些菌属均可分泌胞外聚合物和各种代谢产物,有助于Cake层的快速形成和稳定发展.在膜污染发生以及发展过程中,反应器膜组件Cake层中的优势种群随pTM的升高不断变化,并且由于运行条件的差异,R1、R2反应器在相同pTM下膜组件Cake层中的微生物优势种群同样具有较大差异.在膜组件的初始污染和缓慢污染阶段,R1反应器的微生物丰度始终高于R2,直到膜污染进入跃升期时,两者的丰度基本达到一致.通过计算发现微生物丰度与膜污染进程具有线性负相关关系(R1、R2反应器中丰度与pTM线性负相关系数R2分别为0.82和0.81).到膜污染后期,Cake层不断加厚,物质交流不断受到削弱,甚至造成Cake层内部形成厌氧环境,导致微生物丰度降低.
2.3.2 膜丝表面微生物群落结构分析
在相同的膜污染周期,不同的显著pTM值下分别对R1、R2反应器的膜组件膜丝取样,对膜丝表面进行微生物群落结构分析,结果如图4所示.
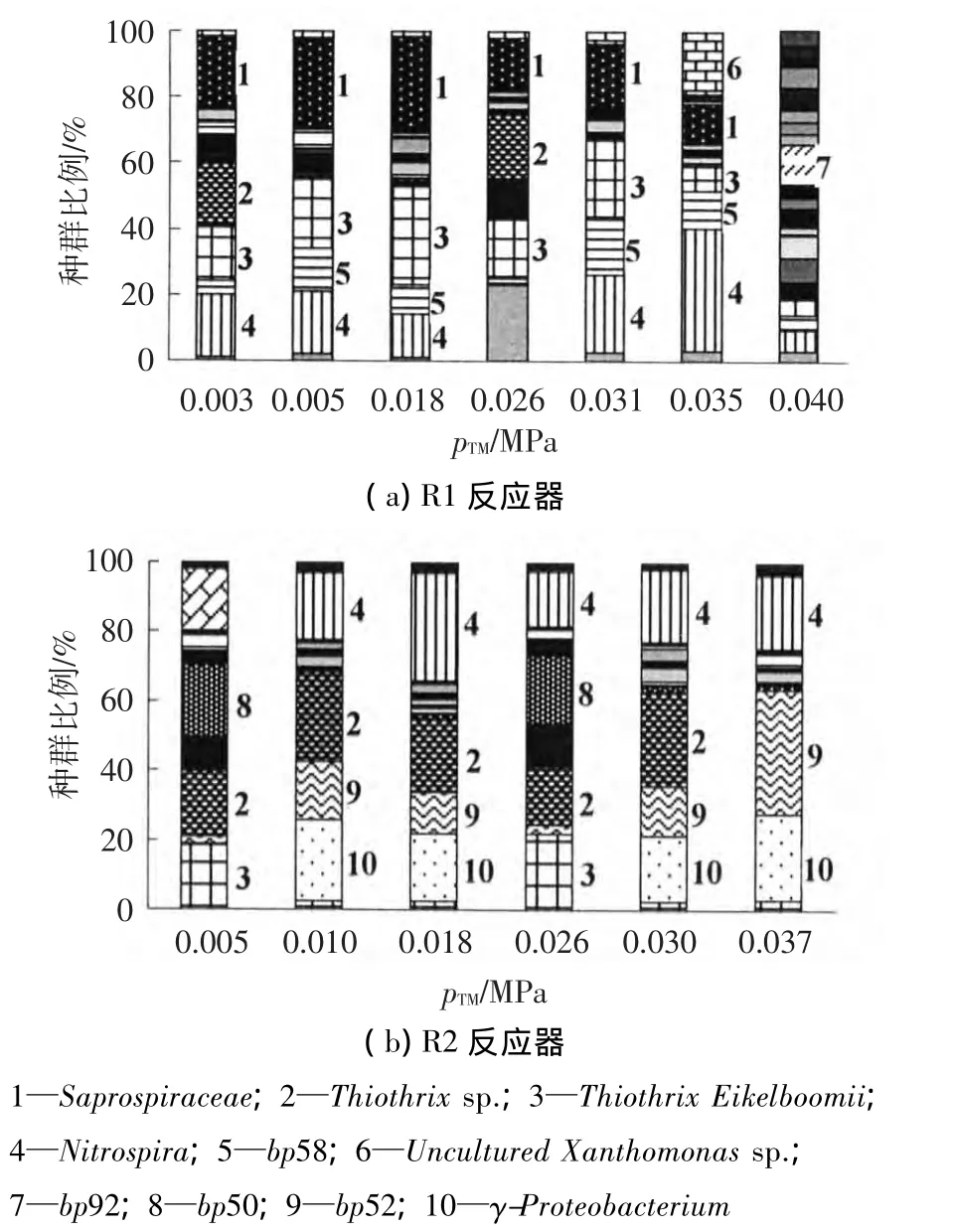
图4 膜污染过程中膜丝表面T-RFLP群落结构图谱
R1反应器在初始快速污染阶段(pTM为0.003~0.010 MPa),膜丝表面主要的优势菌群为Saprospiraceae(腐螺旋菌科)和Nitrospira(亚硝化螺菌属).微生物群落丰度分别为33和32.R2反应器膜丝表面优势菌群为Thiothrix Eikelboomii(一 种 丝 状 菌)和 γ-Proteobacterium(γ变形菌),根据伯杰细菌鉴定手册,γ变形菌可代谢葡萄糖产酸,将硝酸盐还原为亚硝酸盐,利用NH4+作为氮源、葡萄糖作为碳源,10~43℃生长.此时丰度为23和24.R1反应器膜丝表面的丰度值大于R2.
膜缓慢污染时期(pTM为0.01~0.03 MPa),R1反应器膜丝表面的优势种群为Thiothrix Eikelboomii(一种丝状菌)和Thiothrixsp.(发硫细菌),此时微生物种群丰度为36和26;R2反应器膜丝表面的优势种群为Nitrospira(亚硝化螺菌属)和bp50(限制性内切酶AfaI酶切片段长度为50 bp),丰度为23和27.整体上R2反应器膜丝表面的丰度低于R1.
在膜污染跃升期,R1反应器膜丝表面的优势种群为Nitrospira(亚硝化螺菌属)和bp92,此时的微生物种群丰度为14和17;R2反应器膜丝表面的优势种群为Thiothrixsp.(发硫细菌)和bp52,丰度分别为15和16.此时R1和R2反应器膜丝表面的丰度大致达到一致.
与Cake层的群落结构变化相比,膜丝表面的微生物群落演替现象趋于缓和,优势菌群具有一定的连续性.Saprospiraceae(腐螺旋菌科)、Thiothrix Eikelboomii(一种丝状菌)和Nitrospira(亚硝化螺菌属)是R1反应器的常见菌属,并且基本贯穿整个膜污染周期.Thiothrixsp.(发硫细菌)和Nitrospira(亚硝化螺菌属)是R2反应器的常见菌属.膜丝表面微生物种群丰度的变化与Cake层类似,在初始快速污染和缓慢污染阶段,R1反应器的微生物丰度始终高于R2反应器,直到膜污染进入跃升期时,两者的丰度基本达到一致.通过计算发现膜丝表面微生物群落与膜污染进程也具有线性负相关关系(R1、R2反应器中丰度与pTM线性负相关系数R2分别为0.62和0.74).Cake层的稳定压实导致膜组件表面与膜内营养物质传递受阻以及厌氧微环境的形成,从而生态位改变,微生物丰度降低,膜污染加重.
2.3.3 微生物群落多样性与膜污染分析
为探究微生物群落多样性与膜污染的相关关系,引入了滤阻R的概念,根据达西公式
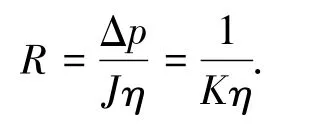
式中:η为黏度(Pa·s),Δp(Pa)为pTM.反应器运行稳定时,认为η为一恒定值,滤阻R(m-1)与透水率K(L·(m2·h)-1·kPa-1)成反比关系,即R与K-1成正比关系.同时R表征pTM大小,因此,K-1与pTM成正比关系.
同时利用Shannon指数H表征微生物群落多样性,即
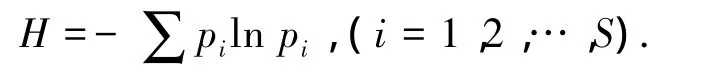
pi为T-RFLP峰值图中第i个峰的面积与图谱中峰的总面积的比值,S为T-RFLP中每个pTM下的丰度.
分别计算Cake层和膜丝表面的Shannon指数H和K-1后,做两者线性分析,结果如图5,6.
Pearson系数 (rp)无量纲,数值在-1.0~1.0,其值大小反映了2个数据集合间的相关程度.0<|rp|≤0.3表示两个数据集合微弱相关,0.3<|rp|≤0.5表示低度相关,0.5<|rp|≤0.8表示显著相关,0.8<|rp|≤1表示高度相关.p值反映Pearson相关显著性.
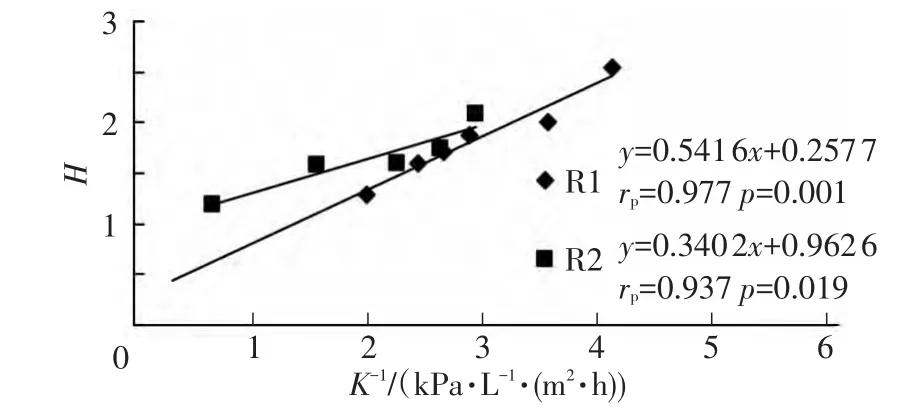
图5 Cake层中Shannon指数与K-1的相关关系
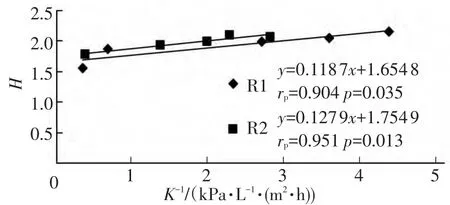
图6 膜丝表面Shannon指数与K-1的相关关系
通过SPSS软件分析发现,Cake层和膜丝表面微生物群落多样性Shannon指数H均与K-1具有相关性.R1反应器Cake层微生物多样性指数H与K-1的Pearson相关性在0.01水平上显著相关 (rp=0.977,p=0.001,置信度为 99%),R2 反应器 Cake层微生物多样性指数H与K-1的Pearson相关性在0.05水平上显著相关 (rp=0.937,p=0.019,置信度为 95%).膜丝表面微生物多样性指数H与K-1的相关性与Cake层类似:R1反应器膜丝表面微生物多样性指数H与K-1的Pearson相关性在0.05水平上显著相关(rp=0.904,p=0.035,置信度为 95%),R2 反应器膜丝表面微生物多样性指数H与K-1的Pearson相关性在0.05水平上显著相关 (rp=0.951,p=0.013,置信度为95%).因此,可以推断:在整体水平上,微生物多样性趋于增大可能导致膜污染加重.
2.4 微生物代谢产物分析
2.4.1 R1、R2反应器中EPS浓度变化
在分析微生物群落结构时,同时研究了R1、R2反应器中微生物的各种代谢产物在该膜污染周期中浓度的变化.图7显示了EPS在膜污染周期中浓度的变化趋势.
在初始快速污染时期,R1、R2反应器好氧池混合液中EPS浓度随膜压力升高显著增加,到膜污染缓慢时期,EPS浓度逐步稳定升高.到膜污染的后期,EPS浓度显著上升,达最大.
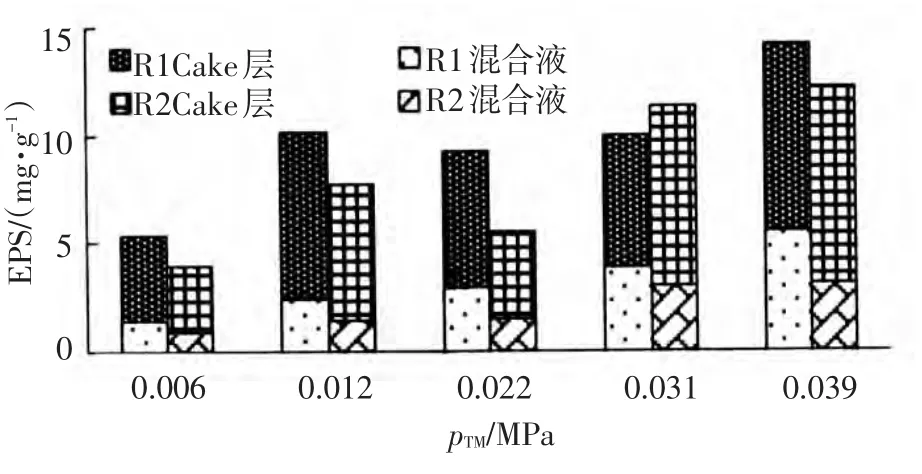
图7 膜污染过程中混合液和Cake层中EPS变化
R1反应器好氧池混合液中EPS浓度始终高于R2,R2反应器中EPS浓度主要集中在Cake层,R2反应器Cake层中EPS高于R1.
正如在2.3部分所述,R1、R2反应器在不同膜污染阶段优势种群的不同,导致EPS浓度的整体差异.
在膜污染周期的不同阶段微生物代谢产物的浓度显著变化,EPS浓度随pTM的增大总体呈明显升高趋势.并且在膜污染周期缩短时,Cake层中EPS浓度所占比例显著升高,且始终大于混合液.这说明EPS在膜污染后期对膜污染贡献作用越发明显,成为主导力量.这与 Wontae Lee等[22]提出的EPS可能对膜污染有重要贡献的观点一致.
2.4.2 R1、R2反应器中SMP浓度变化
R1、R2反应器中好氧池混合液SMP浓度变化如图8所示.
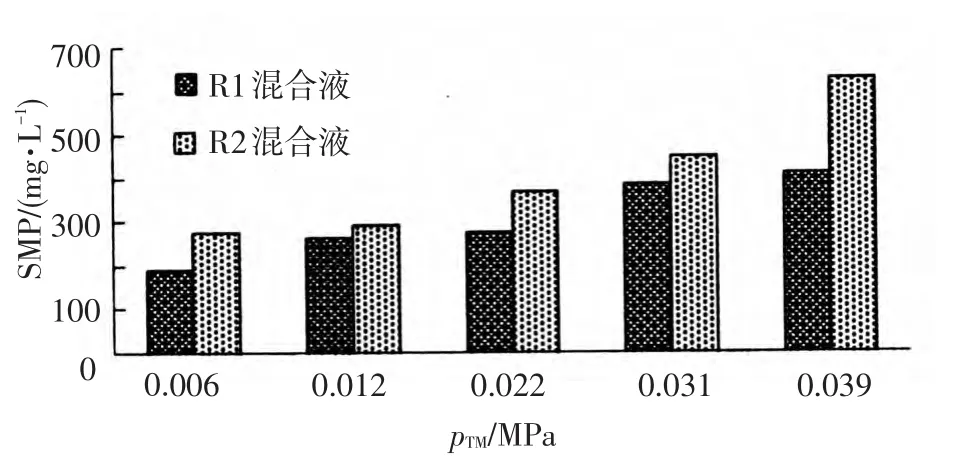
图8 膜污染过程中混合液中SMP变化
在膜的快速污染阶段,R2反应器混合液层中SMP的变化与R1类似.随着pTM的增大呈显著升高的趋势.缓慢污染阶段,混合液中SMP浓度比较稳定,上升趋势趋于平缓.在膜污染末期时,SMP浓度均达最大值,同时R2反应器混合液中SMP浓度高于R1.由此推测,混合液中SMP浓度的上升可能是膜污染的一个重要因素.
各pTM下优势种群的演替导致微生物代谢产物(EPS、SMP)分泌量的差异,而 EPS、SMP 是Cake层的重要组成成分,因此,不同pTM下优势种群的变化能够对膜污染进程产生不同程度的影响.同时,微生物优势种群的变化由其自身所在生态位决定,反应装置运行条件(DO、SRT、Flux、温度)的差异造成混合液、Cake层中微生物种群生态位的不同,影响优势种群的演替过程,改变Cake层的形成和发展速率,影响膜污染进程.
3 结论
1)运行条件(DO、SRT、Flux、温度)的差异能够显著影响膜污染速率,改变膜污染周期.R1反应器的膜污染周期为30 d,R2为11 d.
2)受运行条件不同的影响,Cake层和膜丝表面微生物群落频繁发生演替现象,优势菌群不断变化.R1反应器Cake层中微生物群落优势种群依次为Oribacterium、Cytophagasp.、Anaeromyxobacter、Paracoccus、bp180和Comamonadaceae;R2 反应器Cake层中微生物群落优势种群依次为Anaeromyxobacter、Oribacterium、Saprospiraceae和Myxobacterium.R1反应器膜丝表面微生物群落优势种群依次为Saprospiraceae、Nitrospira、Thiothrixsp.和bp92;R2反应器膜丝表面微生物群落优势种群依次 为ThiothrixEikelboomii、γ-Proteobacterium、Nitrospira、Thiothrixsp.和 bp52,群落演替现象显著.
3)Cake层和膜丝表面的微生物多样性可能与膜污染进程相关.
4)微生物群落演替对EPS、SMP浓度有显著影响.随着膜污染的不断加剧,EPS和SMP浓度总体呈现随pTM上升而升高的趋势.Cake层中EPS对膜污染加重具有主要贡献作用,SMP主要分散于混合液中,其浓度的积累可能导致膜污染周期的缩短.
[1]丁毅,张传义.MBR在污水处理中的应用与研究进展[J].给水排水,2007,33(11):170-172.
[2]罗敏,王占生,侯立安.纳滤膜污染的分析与机理研究[J].水处理技术,1998,24(6).
[3]张海丰,孙宝盛,赵新华,等.溶解性微生物产物对浸没式膜生物反应器运行的影响[J].环境科学,2008,29(1):82-86.
[4]李绍峰,崔崇威,黄君礼.胞外聚合物 EPS对 MBR膜污染的影响[J].哈尔滨工业大学学报,2007,39(2):266-268.
[5]AL-HALBOUNI D,TRABER J,LYKO S,et al.Correlation of EPS content in activated sludge at different sludge retention times with membrane fouling phenomena[J].Water Research,2008,42:1475-1488.
[6]张斌,孙宝盛,刘慧娜,等.处理不同废水MBR系统中微生物群落结构的比较[J].环境科学,2008,29(10):2944-2949.
[7]LIM S Y,KIM S,YEON K M,et al.Correlation between microbial community structure and biofouling in a laboratory scale membrane bioreactor with synthetic wastewater[J].Desalination,2012,287:209-215.
[8]GAO W J,LIN H J,LEUNG K T,et al.Structure of cake layer in a submerged anaerobic membrane bioreactor[J].Journal of Membrane Science,2011,374(1/2):110-120.
[9]HUANG Linan,WEVER H D,DIELS L D.Diverse and distinct bacterial communities induced biofilm fouling in membrane bioreactors operated under different conditions[J].Environmental Science & Technology,2008,42(22):8360-8366.
[10]邢敏,MBR中微生物代谢产物与膜污染的关系研究[D].哈尔滨:哈尔滨工业大学市政环境工程学院,2010.
[11]国家环境保护总局水和废水监测分析方法编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,1989.
[12]TANSEL B,SAGER J,GARLAND J,et al.Deposition ofextracellularpolymericsubstances(EPS)and microtopographical changes on membrane surfaces during intermittent ɦltration conditions[J]. Journal of Membrane Science,2006,285:225-231.
[13]GAO Dawen,FU Yuan,TAO Yu,et al.Linking microbial community structure to membrane biofouling associated with varying dissolved oxygen concentrations [J].Bioresource Technology,2011,102:5626-5633.
[14]ROJAS M H,KAAM R V,SCHETRITE S,et al.Role and variations of supernatant compounds in submerged membrane bioreactor fouling[J].Desalination,2005,179:95-107.
[15]MALAMIS S,ANDREADAKIS A.Fractionation of proteins and carbohydrates of extracellular polymeric substances in amembrane bioreactorsystem [J].Bioresource Technology,2009,100:3350-3357.
[16]DUBOIS M,GILLES K A,HAMILTON J K,et al.Calorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[17]余素林,吴晓磊,钱易.环境微生物群落分析的TRFLP技术及其优化措施[J].应用与环境生物学报,2006,12(6):861-868.
[18]王晓慧,文湘华,Criddle Craig,等.城市污水处理厂活性污泥中氨氧化菌群落结构研究[J].环境科学,2009,30(10):3002-3006.
[19]任南琪,赵阳国,高崇洋,等.TRFLP在微生物群落结构与动态分析中的应用[J].哈尔滨工业大学学报,2007,39(4):552-556.
[20]FLEMMING,H C,SCHAULE G.Biofouling on membranesA microbiological approach [J].Desalination,1988,70(1/2/3):95-119.
[21]张斌,孙宝盛,季民,等.MBR中微生物群落结构的演变与分析[J].环境科学学报,2008,28(11):2192-2199.
[22]LEE W,KANG S,SHIN H.Sludge characteristics and their contribution to microfiltration in submerged membranebioreacters [J].JournalofMembrane Science,2003,216:217-227.
Analysis of microbial community structure and metabolites during the MBR membrane fouling process
GAO Dawen,XIN Xiaodong
(State Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology,150090 Harbin,China)
Aiming at the membrane fouling problem produced during MBR working process,different controlling operations were used on two sets of parallel A/O-MBR systems(R1 and R2).The changing situation of the microbial community structure during the membrane pollution process was analyzed by T-RFLP method,and the microbial metabolites were quantified.The results show that under the different operational conditions,the dominant microbial species of Cake layer in R1 system(controlling method:temperature is 30℃;SRT is 60 days;Flux is 9.09 L/(m2·h);DO is 4 mg/L)isOribacterium,Cytophagasp.,Anaeromyxobacter,Paracoccus,bp180 andComamonadaceae,respectively.The membrane fouling cycle of R1 reactor is 30 days.The dominant microbial species of Cake layer in R2 system(controlling method:temperature is 20℃;SRT is 30 days;Flux is 13.42 L/(m2·h);DO is 2 mg/L)isAnaeromyxobacter,Oribacterium,SaprospiraceaeandMyxobacterium,respectively.The dominant microbial species of membrane wire in R1 isSaprospiraceae,Nitrospira,Thiothrixsp.and bp92,respectively.The dominant microbial species of membrane wire in R2 isThiothrix Eikelboomii,γ-Proteobacterium,Nitrospira,Thiothrixsp.and bp52,respectively.The membrane fouling cycle of R2 reactor is 11 days.The different running methods on A/O-MBR systems have a significant influence on the succession of microbial community.The ascending of microbial diversity Shannon index H of Cake layer and membrane wire may accelerate the membrane fouling process.The obvious increasing trend of microbial metabolites(EPS,SMP)content results in the membrane pollution getting worse.EPS of the Cake layer has a dominant contributive effect on the process of membrane fouling.
A/O-MBR;membrane fouling;microbial community structure;EPS;SMP
X172
A
0367-6234(2014)02-0026-07
2013-02-06.
国家自然科学基金资助项目(21177033).
高大文(1967—),男,教授,博士生导师.
高大文,gaodw@hit.edu.cn.
(编辑 刘 彤)

