新疆柯尔克孜羊布病血清学调查及其诊断方法的研究
多里坤·努尔沙发,阿曼古力·马木提,闫晶华,阿依吐拉·肉孜,马 伟,米吉提·木和塔尔汗,木沙·玉努司,努尔古丽·托胡迪买买提,阿曼吐尔·阿力克,地力夏提·阿布都克孜尔
(1.新疆维吾尔自治区动物卫生监督所,新疆 乌鲁木齐 830063;2.新疆乌恰县畜牧兽医站,新疆 乌恰 845450;3.新疆阿合奇县畜牧兽医站,新疆 阿合奇 843500)
新疆柯尔克孜羊布病血清学调查及其诊断方法的研究
多里坤·努尔沙发1,阿曼古力·马木提1,闫晶华1,阿依吐拉·肉孜1,马 伟1,米吉提·木和塔尔汗1,木沙·玉努司2,努尔古丽·托胡迪买买提3,阿曼吐尔·阿力克3,地力夏提·阿布都克孜尔1
(1.新疆维吾尔自治区动物卫生监督所,新疆 乌鲁木齐 830063;2.新疆乌恰县畜牧兽医站,新疆 乌恰 845450;3.新疆阿合奇县畜牧兽医站,新疆 阿合奇 843500)
用布鲁氏菌虎红平板凝集试验(RBT),试管凝集试验(SAT),牛布鲁氏菌抗体ELISA试验,改进SAT试验及布病细菌学检查方法和AMOS-PCR方法进行检测。结果被检柯尔克孜羊均为阴性。ELISA方法敏感性比SAT高3.4和4.3个百分点,比RBT高8.4个百分点,低0.51个百分点,改进SAT对RBT符合率93.5%。经细菌学方法分离了5株羊3型布鲁氏菌、该菌株对PCR方法的符合率是100%,对噬菌体裂解试验进行了改进和量化、最佳用量为5 μL。ELISA方法不同批号间没有明显的质量差异、敏感性明显高于其它检测方法、该方法特异性需要做进一步研究,改进SAT方法在加样准确率和安全操作等方面有较高的优越性。改进后的噬菌体方法成功裂解了被检分离布鲁氏菌,收集流产胎儿区域主要流行的优势菌是羊3型布鲁氏菌。
柯尔克孜羊;布病血清学检测;细菌学方法
布鲁氏菌病是布鲁氏菌属引起的伴随终身的慢性人畜共患病[1],布鲁氏菌属是革兰氏阴性菌,对人类身体健康及牛、羊、山羊、猪等动物的危害性极大,在牛、羊、猪群中引起流产。人主要通过接触被布鲁氏菌污染的环境和未消毒的奶等饮食的消费而患病,对人的传染而言、羊种布鲁氏菌是首要的、其次是牛种布鲁氏菌[2],布病在世界范围内广泛流行[3],羊种和牛种布鲁氏菌是我国流行的主要菌种[4]。为了解我国新疆畜禽品种资源保护名录的品种柯尔克孜羊布病疫情,对阿合奇县、乌恰县境内的柯尔克孜羊群中的4000只羊、以流行病学调查和血清学监测方法进行了检测,并对布病防制效果进行评估。
1 材料和方法
1.1 主要诊断试剂及试剂盒
布氏菌病虎红平板凝集试验抗原、试管凝集抗原、布氏菌病试管凝集试验阳性、阴性血清由哈药集团生物疫苗有限公司购置;(Bovine Brucella Antibody ELISA AniGen B.Brucella Ab ELISA2.0)牛布鲁氏菌抗体ELISA试剂盒(韩国进口)由天杰仁和生物科技(北京)有限公司购置;胰蛋白月示(TRYPTOSE)(英国进口)、布氏肉汤(BRUCELLA BROTH)、布氏琼脂粉(BRUCELLA AGAR)(美国进口)、琼脂粉、氯化钠、葡萄糖由国内购置;单相特异性A、M血清、粗糙型R血清、Tb、Bk噬菌体由中国疾病预防控制中心传染病预防控制所购置;布鲁氏菌A19、S2、M5苗由新疆畜牧科学院兽医所提供;2×Taq PCR Master Mix由北京庄盟国际生物基因科技有限公司购置。
1.2 仪器耗材
试管、吸管、玻片、平皿、接菌棒、剪刀、镊子、酒精灯、生物培养箱、水浴锅、显微镜、高速离心机、微量加样器、移液枪头、酶标仪、PCR仪、电泳仪、图象分析仪等。
1.3 方法
1.3.1 操作标准
布病虎红平板凝集试验(RBPT),动物布病试管凝集试验(SAT)按照中华人民共和国国家标准〈动物布鲁氏菌病诊断技术>(2002)操作。
1.3.2改进SAT试验的建立及应用
按李璐[8]介绍的方法,有两方面的改进:其一、是用移液器取代吸管,其二、是按比例将原方法中第一管的1 250 μL体系变成1 000 μL体系,按如下操作:第一管中加入920 μL稀释液。第2~4管各加入500 μL稀释液。取被检血清80 μL,加入第1管内。将移液器调至500 μL刻度吹打混合均匀,取500 μL混合液加入第2管混匀。再吸第2管混合液500 μL至第3管,如此倍比稀释至第4管,从第4管弃去混匀液500 μL。鹿、牛等血清的稀释可依本法、按比例变成1 000 μL体系,为960 μL稀释液加40 μL待检血清。
1.3.3 牛布鲁氏菌抗体ELISA试验
由天杰仁和生物科技(北京)有限公司提供说明进行。
1.3.4 动物布鲁氏菌细菌学检查方法及噬菌体裂解试验中接种方式的改进和该体的量化
按上述方法对收集流产胎儿用胰蛋白月示培养基进行分离培养和菌型鉴定,对于噬菌体是用移液器取代吸管接种该体及接种量定位5 μL。
1.3.5 布鲁氏菌AMOS PCR方法
1.3.5.1模板制备及灭能操作 在无菌条件下,从培养菌株中用接种棒勾取少量放进有500 μL无离子水的2.0 mL离心管内,充分混匀后,用封口膜封口,放进100℃水浴锅灭能10 min,迅速放置于冰箱冷却10~15 min备用。
1.3.5.2 布鲁氏菌AMOS 50 μL体系的建立及应用 PCRmix 12.5 μL、引物(P1、P2、P3、P4、P5)2 μL、模板2 μL、双蒸水(厂家提供ddH2O)补充至25.5 μL。
1.3.5.3 AMOS-PCR反应条件 95℃预变性5 min→40循环(94℃变性1 min→60℃退火1.5 min→72℃延伸1.5 min)→72℃延伸10 min。
1.3.5.4电泳制板 1%琼脂糖凝胶板的配方和制备:将1~1.2 g琼脂糖放入100 mL 1%TAE电泳缓冲液装三角瓶中,加热融化1 min(微波炉)。温度降至60℃左右时,加入10 mg/mL溴化乙锭 (EB)或(goodvlew)5 μL均为铺板,厚度为3~5 mm。
1.3.5.5 1%TAE缓冲液制备 用双蒸水1倍稀释厂家提供TAE电泳缓冲原液。
1.4 样本
1.4.1 血清学检测试验用牛血样
2011-2013年收集新疆莫地怀疑感染布病牛血清共821份,数量分别为62份、237份、429份及93 份RBT阳性牛血清。1.4.2 病原学检测病料,冷冻保存了新疆莫地流产羊群收集的部分羊流产胎儿。
2 结 果
2.1 血清学检测结果(见表1)
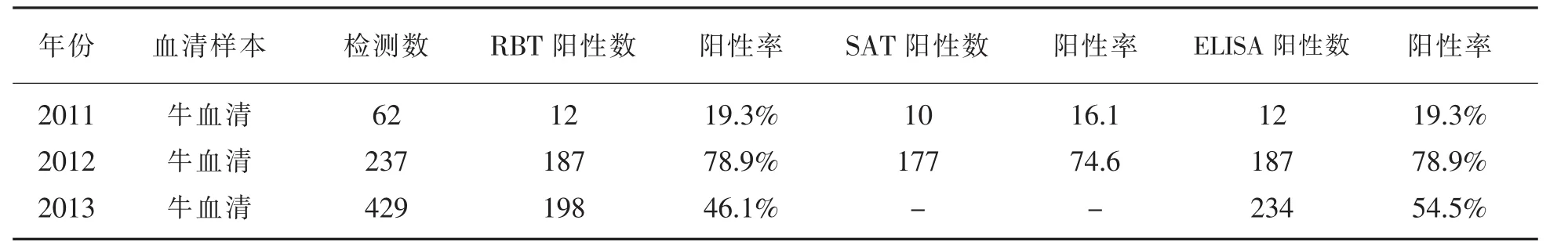
表1 RBT.SAT.ELISA试验检测结果对比
2011年-2012年、ELISA阳性检出率与RBT完全一致,同时ELISA比SAT分别多检出阳性血样2份和10份,前者的敏感性比后者高3.2和4.3个百分点。上述表1中198份RBT阳性牛血清经ELISA检测,结果阳性197份、阴性1份,ELISA阳性率比RBT低0.51%,符合率达到了99.49%,表1中429样本经ELISA检测,结果比RBT多检出阳性样本36份,ELISA敏感性比RBT高8.4百分点及低0.51百分点。93份RBT阳性牛血清经改进SAT试验检测,结果阳性87份、阴性6份,标准阳性、阴性血清对照成立,该方法比RBT阳性率的符合率是93.5%。
2.2 病原学检测结果
上述收集流产胎儿经布鲁氏菌细菌学方法分离了5株可疑布鲁氏菌,该株菌经柯兹罗夫斯基染色法镜检均为被染成桔红色,背景为兰色,绿色球杆菌等形态符合布鲁氏菌的染色特征,标准阳性血清均为凝集,阴性血清均为未凝集,在单项特异性血A、M血清中均为凝集,符合羊3型的特点,R血清均为没有凝集,因此排除了粗糙型布鲁氏菌的可能性,上述被检菌均为在Tb噬菌体不同稀释度上全部不溶解,而且对Bk不同稀释度全部溶解,因此判为羊种布鲁氏菌,排除了其它布鲁氏菌种的可能性,该株菌均为未产生硫化氢,不需要二氧化碳,符合羊种布鲁氏菌的特征。根据上述特征,这5株菌鉴定为羊3型布鲁氏菌。A19、M5苗对照试验成立。
2.3 AMOS-PCR检测结果
对上述5株羊3型布鲁氏菌用AMOS-PCR方法检测结果现预期大小的DNA条带,见图1。
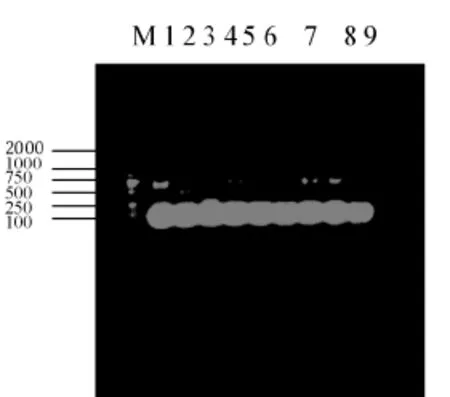
图1 5株分离菌株
AMOS-PCR扩增结果M:Marker,1:M5号苗菌株,2:A19号苗菌株,3:S2号苗菌株,4:羊3型分离株,5:羊3型分离株,6:羊3型分离株,7:羊3型分离株,8:羊3型分离株,9:生理盐水。羊种(M5)、牛种(A19)、猪种(S2)布鲁氏菌扩增片段分别为731bp、498bp、285bp。
3讨论
3.1 关于柯尔克孜羊及检测结果分析
我国柯尔克孜羊,经长期自然选择形成的地方优良品种、以独有的特征被列为新疆畜禽品种资源保护名录的品种[12],在新疆克孜勒苏柯尔克孜自治州境内种群规模为100万只以上,柯尔克孜羊适应高原长途迁移,高效利用当地植被,抗寒,抗病,繁殖率和幼畜成活率高(可能母畜活动有关)[13]、等生命特征适应该地区不同的地理环境[14],除了上述优点、该羊种为我们提供优质肉、乳等食品,并为当地民众现实生活中常用的民族服饰、毡房等生活用品提供粗毛,深受人们的喜爱。为了促进该特有品种健康发展,我们对该羊种部分羊群进行布病流行病学调查的同时,以抽样采血方式实施了布病血清学检测,检测结果均为阴性,根据调查及检测结果,该羊群中没有检出阳性畜的主要原因可能与几种防制措施的实际应用有直接关联,其一、该品种长期施行了自繁自育;其二、对幼畜进行了布病疫苗接种;其三、按期对该区域实施了监测及从外地基本不调入牲畜等。要全面了解该品种布病疫情情况,还需要开展大量的流行病学调查和血清学检测,今后布病防制工作中该区域要继续确保已取得的较好布病防制效果,根据疫情情况、按有关规定、施行综合防制措施的同时进一步加强布病防制宣传工作,在布病防制工作中真正营造群防群控等好的一面,为该品种的长期健康发展创造有利环境。
3.2 血清学检测试验评价
本研究找到一个敏感性高、准确、稳定、快速、便利、安全、先进等优点具备的检测方法、对收集血样,按年份、连续三年、用同一个产品的传统RBT抗原、SAT抗原和相对比较敏感、快速、便捷、安全的间接ELISA试剂盒、不同批号、检测被检样本和对照样本,经检测结果对比发现、ELISA的敏感性比SAT分别高3.2和4.3个百分点、分别检出了2份和10份、SAT方法检测阴性的布鲁氏菌牛血清[7],ELISA敏感性比RBT高8.4个百分点、低0.51个百分点、该方法同样检出了RBT检测阴性的36份牛血清[7]。上述试验数据、在一定程度上、再次证明张芳毓介绍[15]ELISA检测布鲁氏菌抗体的敏感性比SAT高10~100倍的论证及王佳等[16]提出ELISA比RBT敏感性高3~4倍,检出率高5.34%等试验数据,对于本次ELISA试验检出率比RBT底0.51个百分点的试验数据、我们不能排除其他致病菌所引起的疑问、要证明这一点还需要做大量的有关研究。在日常检测中、不同检测方法,具备较高的敏感性和特异性的同时必须具有良好的稳定性[17],经过被检样本和标准样本检测、上述各诊断液及试剂盒的良好稳定性得到了再次验证。对于ELISA试验的特异性而言,今后的工作中需要做进一步研究和评价,通过本试验,ELISA的快速、准确、便捷、比较安全(小产生气溶胶)、用量小等优点再次被证明。改进SAT方法,在样本和诊断试剂的准确加样、减少气溶胶的产生、减少用量、操作便利等方面比传统SAT方法有较高的优越性[8],便于进行大面积检测工作。
3.3 病原学检测
本次试验所用培养基的pH值,自然达到了布鲁氏菌生长所需pH值(6.8)范围的界限,因此没有进行pH值调节。接种病料前对制备好的培养基放入37℃温箱72 h进行了无菌检验,无菌合格后方可使用,要确保培养基各成分准确加入,检菌工作开始前对上述合格培养基先接S2苗,该菌顺利生长后开始正式检菌工作,采取该办法排除了因培养基不合格而影响检菌工作的不利隐患。所用仪器设备、玻璃器材、试剂和消耗品进行了严格灭菌消毒的同时,加强了个人防护措施。本试验对采集流产胎儿外表用3%来苏儿进行消毒,无菌条件下取不同脏器接种分离培养。要防止被检菌变异情况的发生,抓紧时间,减少传代次数,及时地进行了鉴定工作。噬菌体的裂解试验是菌种鉴定工作中一项重要区别指征[11]、试验操作中准确操作和把握该体的用量、对实验的的顺利进行、起关键作用,关于接种和量化噬菌体稀释液的文章却很小见,为提高该体接种量的准确性和操作便于性,本试验、是用移液器取代接菌棒进行接种、该体最佳用量是5 μL,传统方式用接菌棒接该体时,首先准确把握正确用量是比较难;其次,如操作者在接种当中因手颤抖等人为因素有可能污染接种面,造成误判结果的可能性,本试验对上述传统方式进行改进的同时,克服了传统方法中的上述不足。本试验AMOS-PCR羊种的符合率达到了100%[18],并且再次证明了该试验在实验室诊断中敏感、快捷、便利、安全、准确等优点。为今后检菌工作提供了科学依据。
本调查中被检柯尔克孜羊经布病血清学检测没有检出阳性畜,根据调查结果、肯定防制效果和该品种今后的健康发展提出了综合预防措施等建议。本研究应用ELISA方法、对被检及标准对照样本进行了检测,检测结果跟其他血清学检测方法对比的同时该方法的应用价值给予了评价。用改进SAT方法对被检阳性样本及标准对照样本进行了检测,并且该方法的应用价值进行了评价。
利用细菌学方法胰蛋白月示(TRYPTOSE)培养基,从羊流产胎儿不同脏器中直接检测5株羊3型布鲁氏菌,病原检测区域主要流行的优势菌是羊3型布鲁氏菌,该菌株的毒力测定需做进一步研究。对噬菌体接种方式和用量进行改进、最佳用量范围是5 uL。
经AMOS-PCR检测发现被检分离菌株的扩增产物与标准苗株扩增产物完全一致,扩增条带均为731bp。本实验经过柯尔克孜羊血清学调查,为基层培养了掌握布病相关知识的布病防制人员。
[1]Marta A Almirón,Mara S Roset,Norberto Sanjuan.The Aggregation of Brucella abortus Occurs Under Microaerobic Conditions and Promotes Desiccation Tolerance and Biofilm Formation[J].Open Microbiol J. 2013,(7):87–91.
[2]Hyungtae Kim,Wooseog Jing,Hye-young Jeoung.Complete Genome Sequence of Brucella abortus A13334, a New Strain Isolated from the Fetal Gastric Fluid of Dairy Cattle[J].J Bacteriol.2012,194(19):5444.
[3]Hassan M Mai,Peter C Irons,Junaidu Kabir.A large seroprevalence survey of brucellosis in cattle herds under diverse production systems in northern Nigeria[J].BMC Vet Res,2012,(8):144.
[4]周晓艳,陈燕芬,崔步云,等.我国羊种3型布鲁氏菌的多位点序列分型研究[J].中国人兽共患病学报,2011,27(5):374.
[5]洪林娣,朱明东.快速免疫诊断牛布鲁氏菌病新方法的研究[J].中国人兽共患病学报,2007,23(1):74.
[6]Tadepalli Mythili,Lingala Rajendra,Trangadia Bhavesh.Development and Comparative Evaluation of a Competitive ELISA with Rose Bengal Test and a Commercial Indirect ELISA for Serological Diagnosis of Brucellosis[J].Indian J Microbiol.2011;51(4):528–530.
[7]Mayada M Gwida,Adel HEI-Cohary,Falk Melzer.Comparison of diagnostic tests for the detection of Brucella spp.in camel sera.[J].BMC Res Notes,2011,(4):525.
[8]李璐.动物布鲁氏菌病试管凝集试验方法改进的探讨[J].畜牧兽医科技信息,2011,(2):35.
[9]Silvia Minharro,Juliana P.Silva Mol,Elaine M.S.Dorneles.Biotyping and Genotyping(MLVA16)of Brucella abortus Isolated from Cattle in Brazil,1977 to 2008[J].PLoS One,2013,8(12):81152.
[10]Mohamed Abdel-Maksoud,Brent House,MomtazWasfy.Invitro antibiotic susceptibility testing of Brucella isolates from Egypt between 1999 and 2007 and evidence of probable rifampin resistance[J].Ann Clin Microbiol Antimicrob,2012,(11):24.
[11]张付贤,王英超,王兴龙.布鲁菌鉴别诊断方法的研究进展[J].中国生物制品学杂志,2008,11,21(11):1026.
[12]买买提明,古丽格娜.柯尔克孜羊的种质资源保护存在的问题及利用措施[J].草食家畜,2011,(6),4.
[13]符玉涓,徐晶晶.羊常见的寄生虫病[J].新疆畜牧业2012,(3):40-41.
[14]陶卫东,郑文新,蒙永刚.柯尔克孜羊品种资源及开发利用建议[J].中国草食动物科学,2012,(05):4.
[15]张芳毓,钱爱东.布鲁氏菌诊断学研究进展[J].吉林畜牧兽医,2011,01,274(32):11.
[16]王佳,徐卫民.布鲁氏菌病血清学诊断研究进展[J].中国病原生物学杂志,2008,(2):3.
[17]朱明东,洪林娣.布鲁氏菌病快速诊断金标试剂盒稳定性研究[J].中国卫生检验杂志,2007,7,17(7): 1294.
[18]姜海,崔步云,赵鸿雁.AMOS-PCR对布鲁氏菌种型鉴定的应用[J].中国人兽共患病学报,2009,25(2): 109.
Xinjiang Kirgiz Sheep Brucellosis Serological Survey and Research of Diagnostic Methods
DUOLIKUN·Nuershafa1,AMANGULI·Mamuti1,YAN Jing-hua1,AYITULA·Rouzi1,MA-wei1,
MIJITI·Muhetaerhan1,MUSHA·Yunusi2,NUERGULI·Tuohudi3,AMANTUER·Alike3,DILIXIATI·Abudukezier1(1.Xinjiang Uygur Autonomous Region Animal Health Epidemic Prevention and Monitoring Station,Urumqi 830063,China;2.Wuqia County Animal Husbandry and Veterinary Station,Wuqia Xinjiang 845450,China;3.Aheqi County Animal Husbandry and Veterinary Station,Aheqi Xinjiang 843500,China)
Using the brucellosis serological test to understand the brucellosis epidemic situation of in our country Xinjiang Kirgizsheep and carry out the different brucella serology and etiology detection method for testing other collecting blood samples and sheep aborted fetuses,at the same time evaluate the application value of that different methods and improved methods results,provide basis for scientific prevention of brucellosis.Use the Rose Bengal test(RBT),the Serum AgglutinationTest(SAT),the improved SAT test,Bovine Brucella Antibody ELISA test,bacteriology examination methods and AMOS-polymerase chain reaction (PCR)test.Results the tested Kirgizsheep were negative,the sensitivity of ELISA was respectively higher than the SAT 3.4and 4.3 precentage,compare with RBT 8.4 precentage higher and 0.51precentage lower.The improved SAT coincidence rate with RBT was 93.5%.By the method of bacteriology Isolated 5 strains of biovar 3 B.melitensis,that strains accuracy with PCR was100%.To the phage cracking test implementing modification and quantitative steps,the optimum usage of phage was 5 ul.ELISA method had no obvious quality differences between different batches and sensitivity was significantly higher than other test methods, that methods specificity need to do further research.The Improved SAT method’s sample adding accuracy and operation safety had a highest advantages.The modification method of phage were succeesfully cracking the isolated strains of brucellosis.The aborted fetuses sample collecting area main prevalence of bacterium was biovar 3 B.melitensis.
Kirgiz sheep;brucellosis serological test;bacteriology examination methods
S852.5文献标识码:A文章编号:1003-6377(2014)04-0042-06
2014-03-24
新疆少数民族科技人才特殊培养计划科研项目 (201123109)
多里坤·努尔沙发(1969-),男(哈萨克族),高级兽医师,主要从事家畜布病防制工作。

