不同浓度粒巨细胞集落刺激因子及白介素-4对树突状细胞体外诱导培养的影响
王晓婧,梅晓冬
(安徽医科大学附属省立医院、安徽省立医院呼吸内科,合肥 230001)
·基础研究·
不同浓度粒巨细胞集落刺激因子及白介素-4对树突状细胞体外诱导培养的影响
王晓婧,梅晓冬
(安徽医科大学附属省立医院、安徽省立医院呼吸内科,合肥 230001)
目的探讨不同浓度小鼠粒/巨噬细胞集落刺激因子(GM-CSF)和白介素-4(IL-4)对小鼠骨髓源性树突状细胞培养的影响,探索树突状细胞诱导培养的适宜条件。方法采用细胞裂解法分离得到Balb/c小鼠骨髓单个核样细胞,分为多组,分别加入不同浓度GM-CSF和IL-4,并设置空白对照组,共培养7 d,每天观察各组细胞形态,隔天拍照。第7天收集细胞,使用流式细胞法检测细胞表面树突状细胞标志分子CD11c的表达率。结果低浓度GM-CSF及IL-4可培养出高纯度小鼠骨髓源性树突状细胞,高浓度GM-CSF及IL-4可导致细胞死亡,GM-CSF和IL-4的合理细胞诱导浓度范围分别为5~100μg/L和2.5~50μg/L。结论合适浓度的GM-CSF及IL-4可诱导小鼠骨髓单个核样细胞向树突状细胞分化,获得大量树突状细胞。
树突细胞;细胞培养技术;巨噬细胞集落刺激因子;白细胞介素4
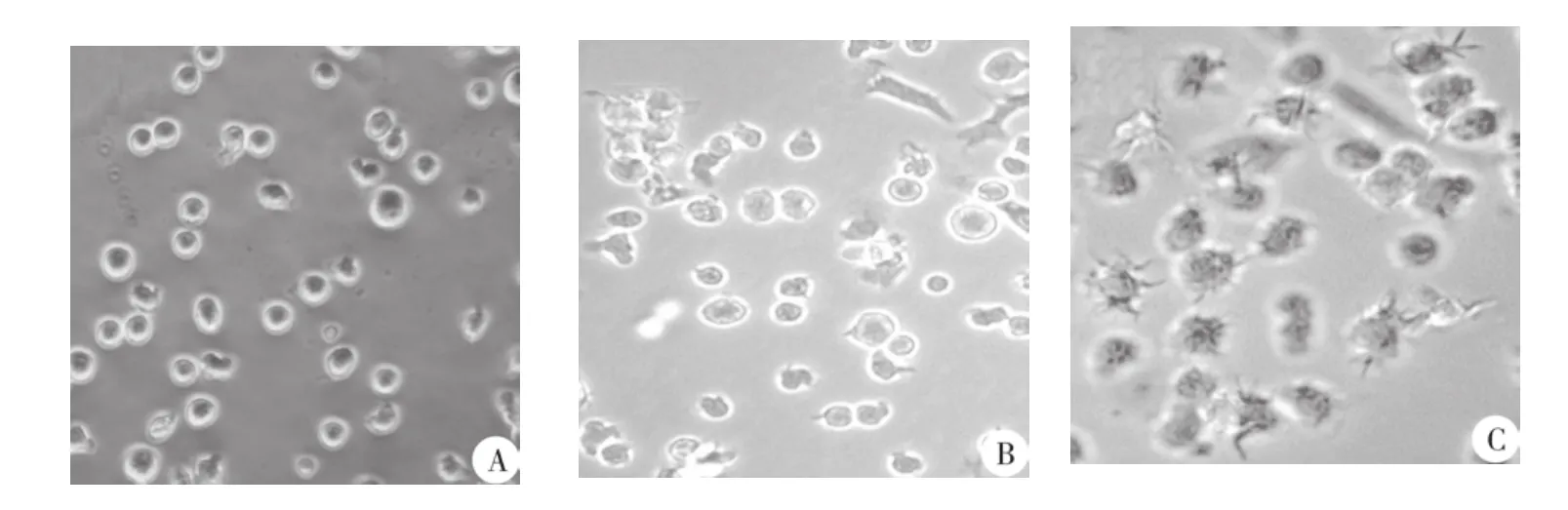
图1 骨髓来源单个核样细胞培养显微镜下细胞形态(×400)
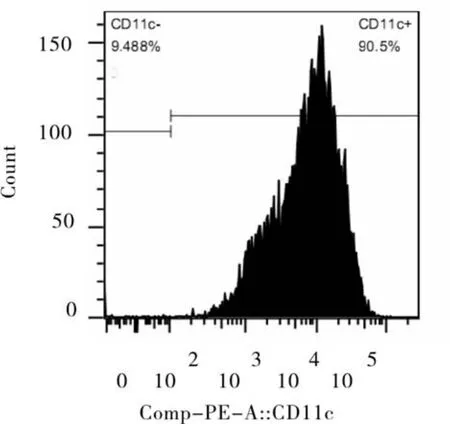
图2 合适浓度的细胞因子诱导培养7 d时细胞高表达CD11c的流式细胞图
树突状细胞(DC)在组织内广泛分布,但其数量极少,如在血液中只占血液细胞总数的不到1%。如何获得大量的DC就成为进行DC相关研究首先必须解决的问题。目前获取DC的方法有多种。主要有免疫磁珠直接筛选(MACS)和体外诱导法[1]。磁珠分选法费用昂贵且操作步骤复杂,最终分离到的DC数量又较有限,实验成本较高。体外诱导法相对较为经济方便。此方法系对采集的单核细胞或骨髓干细胞,用粒细胞/巨噬细胞集落刺激因子(GM-CSF)、白细胞介素4(IL-4)等细胞因子进行体外定向诱导分化,得到未成熟的DCs,再根据研究需要使用不同抗原刺激得到成熟的DC。本文探索采用不同浓度细胞因子诱导DCs生成的效果,确定诱导培养DC的合适细胞因子浓度,为进一步研究DCs创造必要条件。
1 材料与方法
1.1 主要试剂及仪器 重组小鼠GM-CSF、重组小鼠IL-4购自美国PerproTech公司,RPMI 1640培养液、胎牛血清(FBS)购自美国Hycolon公司,红细胞裂解液购自Beyotime公司,荧光抗体PE anti-mouse CD11c美国eBioscience公司。
1.2 实验动物 清洁级雌性Balb/c小鼠,6周龄,体质量20~25 g,由安徽医科大学实验动物中心提供,饲养于安徽省立医院动物实验中心。
1.3 骨髓细胞的制备 颈椎脱位法处死小鼠,无菌状态下取股骨和胫骨,浸泡在RPMI-1640培养基中。用1 mL注射器吸取RPMI-1640培养液,从骨干的一端刺入骨髓腔,反复冲洗,直至骨变白,将骨髓冲洗至15mL离心管中,离心,1 200 r/min,共5min,弃去上清,以1∶5加入预温的无菌红细胞裂解液,反复吹打混匀,于室温下静置2 min溶解红细胞后,再次离心,1 200 r/min,共5 min,弃上清。用RPMI-1640培养液洗涤2次,以完全RPMI-1640(含10% FBS,20万U/L青霉素,20万U/L链霉素)重悬,分装于细胞培养板中,将细胞培养板放入37℃,5% CO2的孵箱中培养4 h,去除未贴壁细胞,以完全1640调整细胞浓度为1×106/mL,加入24孔培养板中,并在每孔中加入完全培养基2 mL,再加入不同浓度rmGM-CSF及IL-4,将细胞培养板放入37℃,含5%CO2的孵箱中继续培养,隔天半量换液,同时补足相同浓度细胞因子,继续培养至第7天,用吸管轻轻吹打后收集所有悬浮细胞。
其中按照培养基中所含细胞因子浓度不同共分为6组,每组设3个复孔。第1组:GM-CSF终浓度为5μg/L,IL-4终浓度为2.5μg/L,第2组GM-CSF终浓度为10μg/L,IL-4终浓度为5μg/L,第3组:GM-CSF终浓度为30μg/L,IL-4终浓度为15μg/L,第4组:GM-CSF终浓度为100μg/L,IL-4终浓度为50μg/L,第5组:GM-CSF终浓度为200μg/L,IL-4终浓度为100μg/L,第6组为空白对照组,培养基中未加入细胞因子。
1.4 细胞形态学观察 每天用光学倒置相差显微镜动态观察培养DC形态学变化,并于第0,3,5,7天拍摄细胞照片。
1.5 DC流式细胞仪检测细胞表型 收集上述各组的细胞,离心,1 200 r/min,共5 min,弃上清,PBS漂洗2次,每组细胞用PBS调至浓度l×105个/mL,分装于3个小管中,每管100μL,分别加入4μLPE抗鼠CD11c,于4℃避光标记30 min,PBS洗涤细胞2次,最后用400μL的PBS悬浮细胞,流式细胞仪分析DC的CD11c的阳性表达率。
1.6 流式细胞图分析 采用Flowjo流式细胞图分析软件分析流式图。
1.7 统计学处理 采用SPSS 13.0软件,所有数据用±s表示,资料组间比较采用χ2检验。
2 结果
2.1 倒置显微镜观察 每只小鼠可获得骨髓细胞数(2.4~3.6)×107个,置于37℃,含5%CO2的孵箱中培养4 h后,部分细胞贴壁,培养液中可见大量的悬浮细胞,去除悬浮细胞后继续培养24 h,倒置显微镜下观察可见细胞贴壁生长,体积小,多为圆形,第2组及第3组可见细胞集落形成。第3天,各组细胞体积增大,部分细胞呈半悬浮状态,呈梭形,蝌蚪状,不规则形,第4、5组细胞数量减少,可见细胞碎片。第5天时可见1,2,3组悬浮细胞增多,部分细胞可见棘突,培养至第7天,第1、2、3、4组细胞集落分散,大量细胞悬浮,细胞表面可见多个突起,为未成熟DC,而第5组细胞稀疏,部分出现空泡,无典型DCs,见图1。
2.2 流式细胞仪检测细胞表型 培养第7天时,收集各组细胞经台竇蓝染色法检测,各组活细胞率大于90%,提示培养细胞生理状态正常。流式细胞仪检测细胞表面CD11c分子结果显示第1、2、3、4组培养,CD11c表达阳性的细胞比例分别为(89.67± 8.66)%,(90.51±9.49)%,(93.34±5.16)%,(56.73±6.27)%,第5组及第6组分别为0%,11.23%,第1~4组与5、6两组间差异有统计学意义(P<0.05),见图2。图示为第2组流式细胞结果,CD11c阳性细胞比例达到90.5%。结果显示,本研究所采用的方法,能高效诱导骨髓单个核样细胞分化为树突状细胞。所使用的刺激因子浓度较为合理。
3 讨论
DC是体内重要的抗原提呈细胞,在肿瘤免疫、器官移植免疫及抗感染免疫中至关重要,和DC相关的许多临床研究正在开展[1-4]。尤其在肿瘤免疫方面,DC疫苗已经成为一种新的肿瘤治疗方法,已有文献报道将DC肿瘤疫苗已用于非小细胞肺癌的I期临床研究[5],并获得了良好的治疗效果。因此如何能简单、高效获得大量高纯度DC是很多研究的前提条件。目前已有文献报道中GM-CSF和IL-4的诱导剂量差别很大,在2μg/L至500μg/L之间[6-9]。本研究探索了小鼠DCs体外培养中细胞因子的最适宜浓度,结果发现高浓度的细胞因子会导致细胞凋亡,GM-CSF和IL-4适宜浓度范围分别为5~100μg/L和2.5~50μg/L,在该浓度范围中,低浓度与较高浓度细胞因子诱导培养出的未成熟DC数量及纯度上无明显差别,能获得较高纯度的DC。CD11c是DC表面所特有的标志性蛋白,在未成熟和成熟DC表面均有高表达。实验室研究中常用CD11c阳性与否来判断所研究的细胞是否是DC。本研究中诱导培养得到的细胞,其CD11c的阳性率能高达90%以上,显示本研究所使用的细胞因子诱导浓度较为合理,诱导得到的细胞绝大多数为DC。研究结果提示本实验方法可行,为DC细胞相关研究,提供了可靠的DC细胞获得手段,为进一步研究DC建立了良好基础。
(本文图1,2见插图2-1)
[1] Steinman RM,Cohn ZA.Identification of a novel cell type in peripheral lymphoid organs of mice.Ⅰ.Morphology,quantification,tissue distribution[J].J Exp Med,1973,137(5):1142-1162.
[2] Luo J,Li J,Chen RL,et al.Autologus dendritic cell vaccine for chronic hepatitis B carriers:A pilot,open label,clinical trial in human volunteers[J].Vaccine,2010(28):2497-2504.
[3] Rahma OE,Ashtar E,Czystowska M,et al.A gynecologic oncology group phase II trial of two p53 peptide vaccine approaches:subcutaneous injection and intravenous pulsed dendritic cells in high recurrence risk ovarian cancer patients[J].Cancer Immunol Immunother,2012,61(3):373-384.
[4] LesterhuisWJ,SchreibeltG,Scharenborg NM,et al.Wildtype and modified gp100 peptide-pulsed dendritic cell vaccination of advanced melanoma patients can lead to long-term clinical responses independent of the peptide used[J].Cancer Immunol Immunother,2011,60(2):249-260.
[5] Um SJ,Choi YJ,Shin HJ,et al.Phase I study of autologous dendritic cell tumor vaccine in patients with nonsmall cell lung cancer[J].Lung Cancer,2010,70(2):188-194.
[6] 苏钰,高雪,王锦玲,等.大鼠骨髓源树突状细胞吞噬功能的超微结构观察[J].生物技术通讯,2012,23(3):407-410.
[7] 汪国营,张琪,刘炜.大鼠骨髓来源树突状细胞体外培养体系的优化[J].器官移植,2011,2(3):135-140.
[8] 付必莽,何晓顺,余思.小鼠骨髓源半成熟树突状细胞的培养与初步鉴定[J].中国医学科学院学报,2008,30(4):430-435.
[9] 孙国龙,王凯忠,周莉.小鼠骨髓及脾脏来源的树突状细胞培养及鉴定[J].中国实验诊断学,2012,16(3):408-411.
Generation of dendritic cells with appropriate concentration of granu Iocyte-macrophage coIony-stimu Iating factor and interleukin-4
WANG Xiaojing,MEI Xiaodong(Department of Respiratory,Anhui Provincial Hospital,Hefei230001,China)
MEIXiaodong,Email:hfmχd@sina.com
ObjectiveTo investigate the appropriate concentration range ofmurine granulocyte-macrophage colony-stimulating factor(GM-CSF)and interleukin-4(IL-4)in incubating mouse bone marrow monocytes-like cellsand proper conditions for dendritic cell differentiation.Methods The progenitor of dendritic cellswere isolated from bone marrow of Balb/cmice,and incubated in different dose ofmouse granuIocyte-macrophage coIony-stimu Iating factor and interleukin-4 for continuously seven days,themorphology of cells in each group were observed undermicroscope and snapped with digital camera every other day.The expression of CD11c was detected with flow cytometry.ResultsMorphological observation revealed thatmouse bonemarrow monocytes-like cells changed remarkably when cultured with low dose of cytokine.Cells became large and showed dendritic protruding on their surface.Furthermore,most cells were CD11c positive when detected by flow cytometry.The appropriate GM-CSF and IL-4 dose rangewere5 μg/L~100μg/L and 2.5μg/L~50μg/L respectively,while cytokines of overhigh concentration cause cell death.ConclusionDendritic cells can be derived from bonemarrowmonocytes-like cellswith appropriate dose of GM-CSF and IL-4 treatmentwith High purity DCs.
Dendritic cells;Cell culture techniques;Macrophage colony-stimulating factor;Interleukin-4
R329.24
A
10.3969/J.issn.1672-6790.2014.02.017
2013-05-05)
2013年度安徽省自然科学基金项目(1308085MH115)
王晓婧,硕士在读,Email:ahslyywxj@gmail.com
梅晓冬,主任医师,硕士生导师,Email:hfmxd@sina.com

