高温胁迫下坛紫菜的数字基因表达谱研究
赖晓娟,严小军,杨锐,骆其君,陈海敏*
(1.宁波大学海洋生物工程重点实验室,应用海洋生物技术教育部重点实验室,浙江宁波 315211)
高温胁迫下坛紫菜的数字基因表达谱研究
赖晓娟1,严小军1,杨锐1,骆其君1,陈海敏1*
(1.宁波大学海洋生物工程重点实验室,应用海洋生物技术教育部重点实验室,浙江宁波 315211)
坛紫菜是潮间带重要的经济藻种,对高温、渗透压等逆境具有独特的调控机制。本文采用基于高通量测序的数字基因表达谱(DGE)技术研究了坛紫菜在高温胁迫下的基因表达差异,并分析其相应的响应方式;利用实时定量PCR技术对DGE部分数据进行验证;检测了其中较有代表性的应答基因hsp70的差异表达。结果显示,高温胁迫下坛紫菜中有256个unigene上调表达,以HSP、核糖体蛋白L12、延伸因子EF-Tu及部分光合作用相关基因为代表,3 820个unigene下调表达,主要为核酸、蛋白以及糖类等合成代谢相关基因。Gene Ontology分析表明,差异表达基因主要定位于质体等有膜细胞器,参与繁殖和发育过程,行使催化和连接酶活性的功能。Pathway分析显示,这些基因分布于107条pathway中。其中,下调表达基因最显著富集于mRNA监督和RNA转运途径,而上调表达基因部分富集于内质网的蛋白加工、RNA降解及光合作用途径。验证表明此次DGE结果具有较高准确性,hsp70基因对高温响应积极。综上所述,DGE结果反应出,在高温胁迫时,坛紫菜出现基础代谢减慢、合成速度下降、能量合成受阻、碳同化降低等现象,但光合作用前期未受影响,同时补救途径启动。
坛紫菜;高温胁迫;数字基因表达谱(DGE);差异表达基因;响应
1 引言
坛紫菜Pyropia haitanensis属于红藻门Rhodophyta、原红藻纲Protoflorideophyceae、红毛藻目Bangiales、红毛菜科Bangiaceae、紫菜属Pyropia,为中国特有物种,主要分布于浙江、福建等南方海域,也是中国产量最高的紫菜养殖种类[1]。紫菜生长在沿海潮间带,对高度多变的潮汐环境有着特殊的适应性,尤其是对温度、渗透压及辐射等逆境具有高效的调节机制[2]。此外,紫菜在进化关系上比较原始,因此还可能拥有普通高等植物所没有的独特的抗逆机制。深入研究紫菜的抗逆机理将为紫菜以及陆地作物的健康栽培提供新思路。
过去几年,基于传统测序方法的表达序列标签(Express sequence tags,ESTs)技术在鉴定藻类抗逆相关基因及通路中取得了较多成果。近年来,随着新一代测序平台的发展以及市场化,转录组测序(RNA sequencing,RNA-Seq)技术逐渐被应用到藻类领域的研究,而基于此的数字基因表达谱(Digital Gene Expression Profiling,DGE)则因成本较低而多应用于基因表达差异的研究[3]。目前对紫菜在高温胁迫下的应答机制研究还很少,而且多侧重生理生化方面,杨锐等[2]曾提出坛紫菜对热胁迫应答的可能机制,但并未见后续详细报道。最近,Choi等[4]通过转录组测序初步比较了甘紫菜Pyropia tenera在高温和正常培养条件的表达差异,筛选出了部分应答基因,但其中绝大多数为未知基因,也未进行深入分析。因此,我们对其调控机制的了解还十分有限,尤其缺少分子水平上的系统认识。本文使用DGE技术对坛紫菜在高温胁迫下的基因表达差异进行研究,以期筛选相关的应答基因并分析坛紫菜在高温胁迫下的分子调控机制。
2 材料与方法
2.1 材料
坛紫菜叶状体采自宁波象山坛紫菜养殖场,样品在阴凉处风干后保存于-20℃。
RNA提取试剂Trizol购自Invitrogen公司,实时定量PCR相关试剂PrimeScript○RRT reagentKit、SYBR○RPremix Ex TagTMⅡ购自TaKaRa公司。
2.2 方法
2.2.1 DGE文库构建和测序
实验前用无菌海水将坛紫菜叶片清洗干净,在L∶D=12∶12、光强2 000~3 000 lx、20℃下复苏培养24~48 h。高温处理条件为35℃、30 min,取20℃下正常培养的样品作为对照。总RNA提取按照Trizol试剂说明书进行[5],采用Agilent 2100检测RNA质量。之后用带有Oligo(d T)的磁珠富集mRNA,加入fragmentation buffer将mRNA打断成平均长度为200 nt的短片段,以片段后的mRNA为模板,用六碱基随机引物(random hexamers)合成cDNA第一链,然后加入缓冲液、d NTPs、RNase H和DNA polymeraseⅠ合成cDNA第二链,经过QiaQuick PCR试剂盒纯化并加EB缓冲液洗脱之后做末端修复、加poly(A)并连接测序接头,再用琼脂糖凝胶电泳回收目的大小片段,最后进行PCR扩增,从而完成整个文库制备工作[6]。采用HiSeq 2000∶42SE的策略进行测序,测序工作由深圳华大基因研究院完成。
2.2.2 DGE数据处理[6]
测序所得的原始数据(raw reads)经去接头、去低质量序列处理后得到高质量干净序列(clean reads)进行后续分析。使用短reads比对软件SOAPaligner/soap2[7]将clean reads比对到参考基因序列。参考序列为本实验室前期经Illumina HiSeq 2000测序所获得的坛紫菜转录组数据(碱基总量3.1 Gb,组装后Unigene数为27 887)。基因表达量的计算使用RP-KM法(reads perKb per million reads),参照Audic S. 和Claverie发表在Genome Research上的基于测序的差异基因检测方法[8]筛选两样本间的差异表达基因,即FDR(False Discovery Rate)≤0.001且log2Ratio≥1(倍数差异不低于2倍)。后续分析均基于差异表达基因。Gene Ontology功能显著性富集分析采用Gene Ontology数据库(http://www.geneontology. org/)进行,将差异表达基因向数据库的各term映射,计算每个term的基因数目。Pathway显著性富集分析采用KEGG数据库[9],将差异表达基因向数据库映射,统计各个pathway中基因数目及富集程度。
2.2.3 实时定量PCR验证及hsp70基因的差异表达
取适量复苏后的坛紫菜叶片置于35℃海水中,分别于放入后的0 min,5 min,15 min和30 min收集样品,之后将剩余的坛紫菜叶片转入正常20℃海水中恢复培养,并分别于15 min,30 min,60 min,120 min和180 min收集样品,用吸水纸吸干表面水分,液氮速冻后存于-70℃冰箱待用(不超过12 h)。其中热激处理0 min(对照)和30 min的点用来进行DGE数据的验证。采用Trizol试剂提取总RNA,反转录成cDNA后进行实时定量PCR检测[10]。相关引物见表1,18S作为内参。PCR循环条件:95℃预变性3 min;95℃10 sec、55℃18 sec、72℃15 sec,40个循环。用Rotor-Gene的软件进行CT值分析,采用2-ΔΔCT法计算差异表达水平。各实验重复3次。

表1 实时定量PCR相关引物

续表1
3 结果
3.1 DGE测序数据评估
对照和高温组这2个文库经HiSeq 2000高通量测序后分别得到9 212 191和9 678 860条clean reads,分别占raw reads的98.13%和97.59%,碱基总量分别为451.4 Mb和474.4 Mb,均有88%以上的序列能够比对到参考序列(坛紫菜转录组),说明测序结果具有较高准确性,此外,测序饱和度分析显示,2组文库所检测到的基因数都已趋于饱和(未呈现数据)。这为后续分析提供了良好基础。
3.2 差异表达基因筛选
经过严格筛选(FDR≤0.001且倍数差异不低于2倍),最后确定有256个unigene上调表达,3 820个unigene下调表达,即高温处理后有14.62%的unigene出现了表达变化,其中上调和下调的比例分别为0.92%和13.70%,很明显,坛紫菜在高温胁迫下绝大多数基因出现了下调表达。
3.3 差异表达基因的功能分析
3.3.1 功能注释
我们重点关注高温胁迫下坛紫菜上调表达的基因。由于目前藻类基因组信息相对较少,这256个上调表达的unigene中大部分显示没有比对结果,其中只有59个有Nr比对结果,占总数的23.05%,所比对到的物种多为一些藻类,如条斑紫菜Pyropia yezoensis、莱茵衣藻Chlamydomonas reinhardtii、长囊水云Ectocarpussiliculosus等,而这其中仍有近一半的unigene显示为“predicted protein”或者“hypothetical protein”。选取其中有明确注释信息的27个unigene列于表2中,可以看出,高温胁迫下坛紫菜中上调表达的基因主要包括HSP70、小热激蛋白、核糖体蛋白L12、延伸因子EF-Tu、高光诱导蛋白、光合作用相关蛋白以及其他参与代谢的一些酶类。
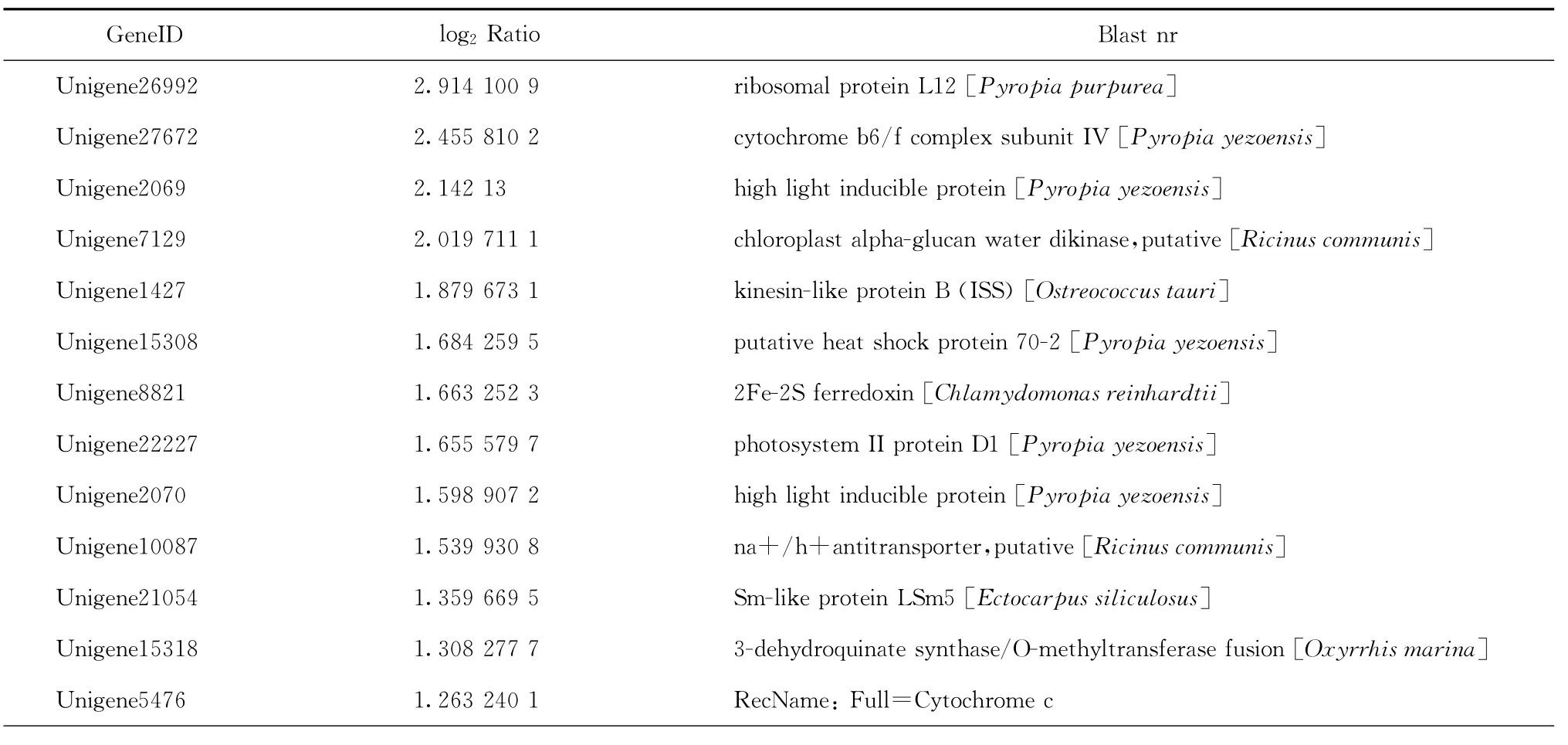
表2 高温诱导或上调表达的基因
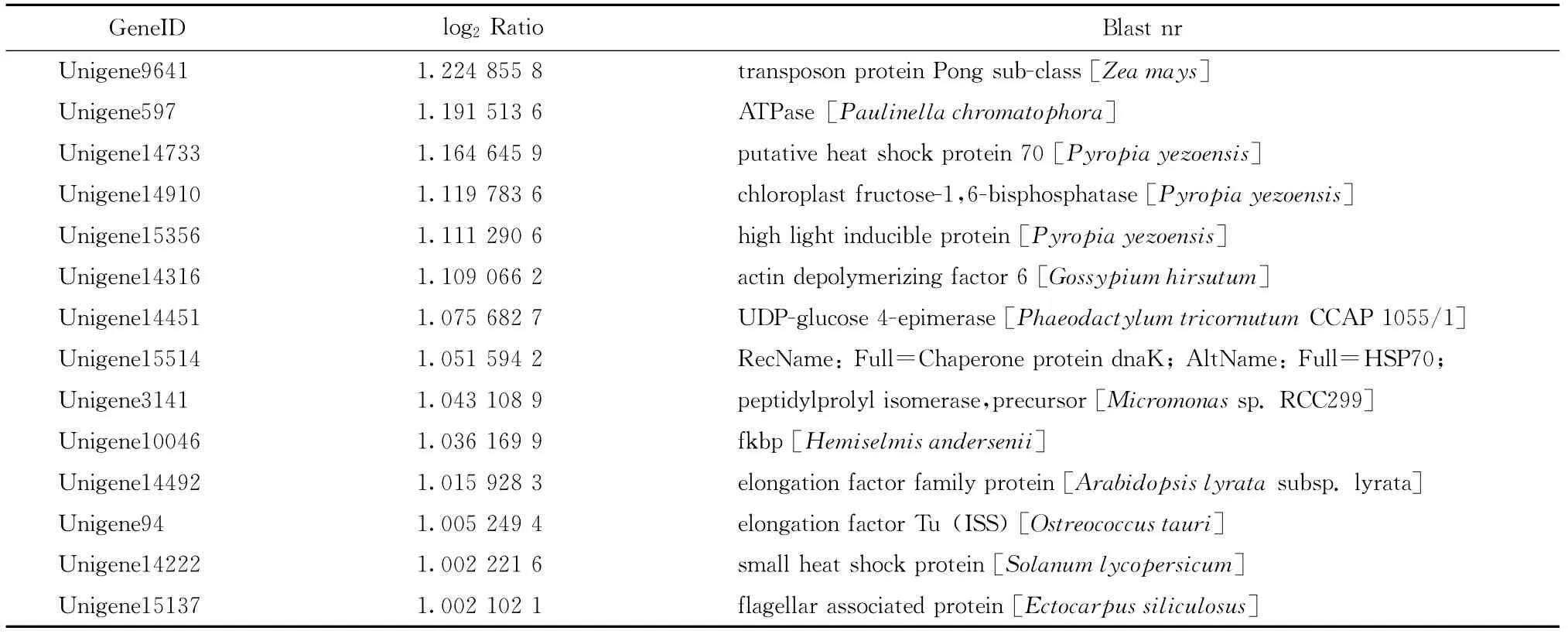
续表2
3.3.2 Gene Ontology功能显著性富集分析
Gene Ontology功能富集分析结果显示,差异表达基因涉及核酸代谢、蛋白翻译和修饰、糖代谢、脂质代谢、有机酸代谢、萜类等的次级代谢、转运、膜的组装及响应胁迫等生物过程。我们筛选在差异表达基因中显著富集的GO term(corrected p≤0.05)列于表3中,可以看出,这些基因主要参与繁殖和发育过程,行使的功能主要是催化和连接酶活性,所处的细胞位置为质体以及其他有膜细胞器,其中与催化活性相关的GO term富集的基因数量最多,其次为有膜细胞器,分别占到了差异表达基因总数的13.49%和9.30%,这些基因基本都呈现下调表达。

表3 差异表达基因的GO功能显著性富集分析
3.3.3 Pathway显著性富集分析
我们通过pathway富集分析来确定差异表达基因参与的主要生化代谢途径和信号转导途径,结果显示,高温胁迫下坛紫菜差异表达的基因分布在107条pathway中,图1所示为unigene数量大于20的24条pathway,其中涉及代谢途径的数量最多,占差异表达基因总数的9.25%。mRNA监督和RNA转运是2个显著富集的pathway(Q≤0.05),分别富集了283和303个差异表达基因,占总数的6.94%和7.43%,而且基本都呈现下调表达。此外,次级代谢物合成、剪接体、氨酰-tRNA合成、甘油酯代谢、脂肪酸合成、碳同化等途径也富集了大量下调表达的基因。如图2所示,在碳同化途径中,C3、C4途径的大部分基因都有被找到,而且出现下调表达,其中C4途径更为明显。在光合作用途径中,编码PSⅡ反应中心D1蛋白的psbA基因以及编码细胞色素b6f复合体亚基IV 的petD基因出现上调表达,但编码ATP合酶的部分相关基因呈现下调表达。RNA降解、内质网的蛋白加工这两条途径中有部分基因呈现上调表达,比较明显的是HSP70以及小热激蛋白。
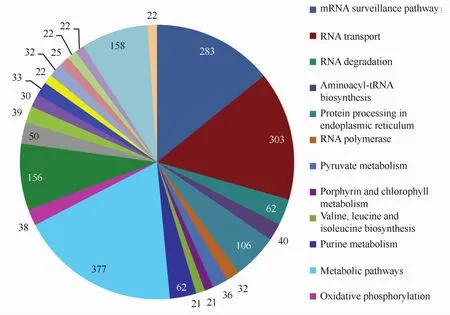
图1 差异表达基因的pathway分布
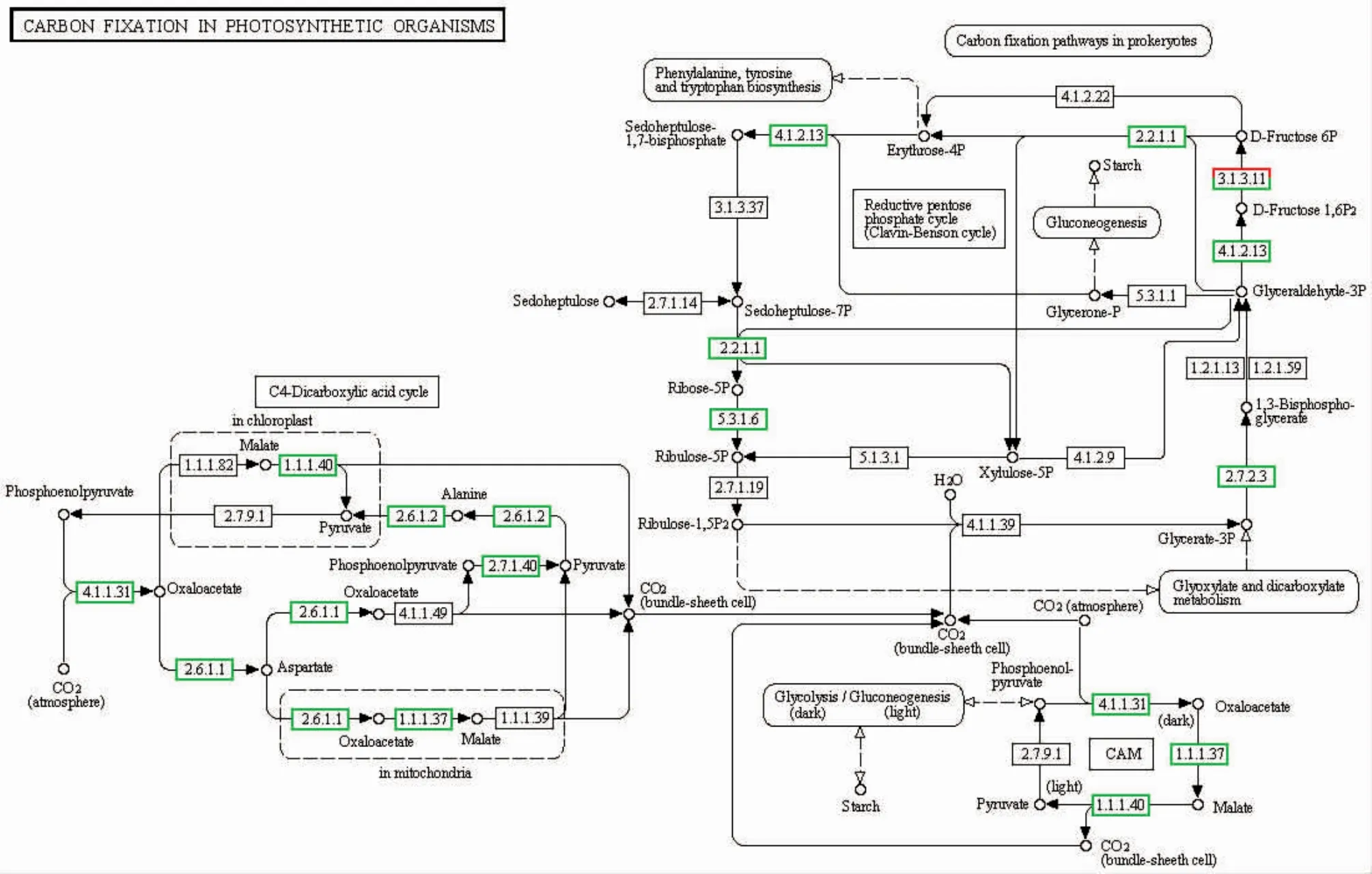
图2 碳同化途径相关基因的表达变化
3.4 实时定量PCR验证
随机选取了8个差异表达基因(其中4个上调,4个下调)进行实时定量PCR验证(见图3),结果显示其中7个基因的表达趋势与DGE结果一致。有1个相反(unigene16552),这个基因在DGE中为下调表达,但在此次验证结果中显示上调表达2.5倍。但总体说明此次DGE结果具有较高的准确性和可信度。
3.5 高温胁迫下hsp70基因的差异表达
选取DGE结果中比较有代表性的应答基因hsp70(unigene15514),检测了其在高温胁迫下多个时间点的差异表达情况,如图4所示,hsp70在高温处理5 min后即出现上调表达,在30 min时达到最大,为对照的14.60倍;进入恢复培养15 min时,hsp70表达先有所下降,之后开始上升,并在60 min时达到峰值,为对照的15.31倍,然后又逐渐下降,在180 min降为对照的7.48倍,总体呈现先上升后下降的趋势,而且整个恢复培养过程hsp70都保持较高水平的表达。
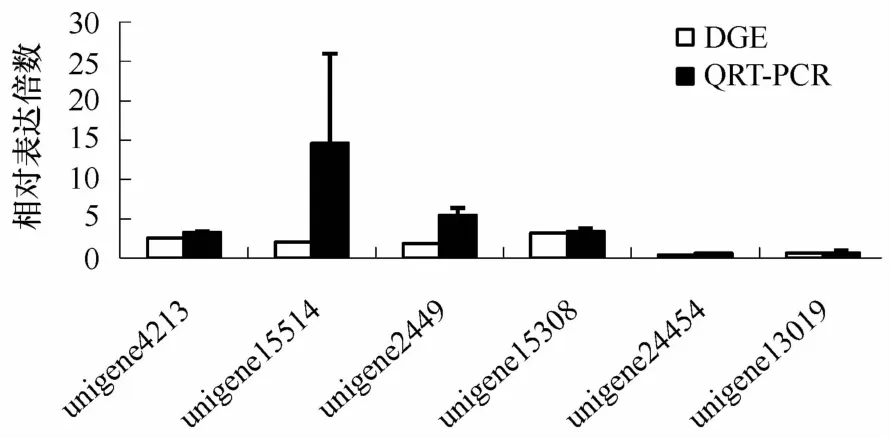
图3 差异表达基因的实时定量PCR验证
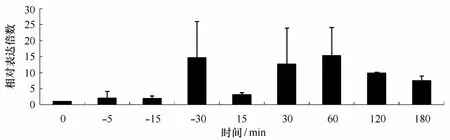
图4 坛紫菜hsp70基因在高温胁迫下的差异表达
4 讨论
据笔者了解,这是首次利用基于高通量测序的DGE技术系统研究坛紫菜在高温胁迫下的分子响应机制。通过差异表达基因筛选以及功能注释,我们发现高温胁迫下坛紫菜中仅有少部分基因出现上调表达,其中以HSP家族、核糖体蛋白L12、延伸因子EFTu及部分光合作用相关蛋白为代表,而有较高比例的基因呈现下调表达。Gene Ontology功能富集分析结果提示,坛紫菜在高温胁迫下可能出现相关酶的催化活性减弱,如核酸合成、蛋白合成、糖类合成等初级代谢以及生物碱合成等次级代谢相关的酶类,而且发育和繁殖的生物过程开始减慢,并有可能导致质体、线粒体等有膜细胞器的损伤。Pathway分析显示,mRNA监督和RNA转运途径明显受到影响,而RNA降解途径的基因开始上调表达,这可能导致细胞内产生错误的蛋白产物以及蛋白合成受阻,进而导致细胞功能受损,而脂肪酸合成代谢途径等相关基因的下调表达可能与细胞膜结构的损伤有关。
高等植物对高温胁迫的响应主要有蛋白合成速度减慢并伴随HSP等应答基因的上调表达[11—12],这些在本研究中都有发现。此外,光合作用被认为是对高温胁迫响应最为敏感的途径之一,主要表现为PSⅡ、碳同化及ATP的合成显著受影响[13],但本研究发现高温胁迫下坛紫菜参与光合作用的两个重要基因psbA和petD出现上调表达,而其中参与光合磷酸化的ATP合酶基因以及后续的碳同化途径相关基因出现表达下调,说明ATP合成以及碳同化确实受到了抑制,但前期的光捕获以及电子传递等并未受到影响,甚至出现上调的应答反应。综合来说,坛紫菜在高温胁迫下可能出现核酸、蛋白、糖类以及脂类等合成速度的全面减慢,其中以蛋白合成受抑制最为明显,进而导致繁殖和发育过程变慢甚至出现细胞膜以及质体、线粒体等细胞器受损,但它也拥有极强的抗高温能力,同时会迅速启动一系列的补救途径,如HSP、psbA、pet D以及核糖体蛋白L12、延伸因子EFTu等的上调表达将为后期的恢复做准备。
热激蛋白(HSP)是一组广泛存在于生物体内的高度保守的蛋白家族,其中以HSP70最为保守和重要,参与新生肽的成熟以及蛋白质变性后的复性、降解,具有保护功能,也是高等植物中研究最为深入的胁迫应答基因[14—15]。为深入研究坛紫菜hsp70基因的功能,本文还检测了其在高温胁迫下多个时间点的差异表达情况,发现hsp70对高温胁迫的响应非常迅速,短时间的处理即可使其表达量明显升高,在解除胁迫进入正常培养后,坛紫菜hsp70基因仍保持高水平表达,推测其可能参与后期的损伤修复过程,这与杨锐[2]等人的研究结果相似。此外,本研究还发现hsp70基因在刚进入恢复15 min时出现了短暂的下调,说明坛紫菜可能快速的感受到外界环境的改善,细胞出现hsp70基因暂时下调的反应,但当发现损伤还未修复,细胞仍需要合成大量的蛋白以进行后期恢复时,hsp70基因又开始上调。
Choi等人对列紫菜Pyropia seriata以及甘紫菜Pyropia tenera的在高温胁迫下的差异表达进行了研究,也发现HSP家族是其中最有代表性的应答基因,还指出核糖体蛋白L17a上调明显[4,16],而本研究的结果显示核糖体蛋白L12为上调应答基因,有一定差异,但核糖体蛋白参与高温响应早有报道,它有防止蛋白合成受抑制以及mRNA-rRNA加工和细胞信号转导的功能[17—18]。在植物小麦中,质体的延伸因子EF-Tu是除HSP基因以外第二个被发现的具有提高植物耐热能力的基因,它具有减少蛋白变性以及增强碳同化作用的功能[19]。而在本研究中也发现了一个EF-Tu上调表达基因,但其属于线粒体型,这与小麦不同,推测坛紫菜中线粒体的EF-Tu也可能具有类似功能,是一个重要的高温应答基因。
在高等植物的热胁迫响应研究中,目前只有HSP及热激转录因子(HSF)研究的比较透彻,虽然也通过各种组学技术筛选出了大量的热胁迫相关基因、蛋白以及代谢物,但都还没有进行深入研究[20—21]。Qin等[22]通过微阵列技术研究了小麦在高温胁迫下的转录组变化,筛选到了其他一些上调基因,主要涉及激素合成、钙离子及糖、脂质的信号转导以及初级、次级代谢等。这些在本研究中并没有找到太多信息,推测这可能与高温处理的方式及物种特异性有关。坛紫菜在高温胁迫下上调表达的基因数目较少,提示这部分基因可能对其耐高温具有重要作用。由于目前紫菜基因组信息的限制,我们筛选到的差异表达基因中有非常高比例的序列没有注释结果,因为紫菜比较原始,其序列与其他生物同源性普遍较低,这也给功能注释带来了困难,但同时也提示,紫菜中的这些功能未知的差异表达基因可能正是其独有的胁迫应答基因,这部分基因行使着普通高等植物所不具有的功能,对其特殊的环境适应性起着关键作用,如Kim等[16]人将筛选到的一个未知基因转到莱茵衣藻中进行表达研究,证实具有抗高温的功能。将来的工作是研究这些独特基因的功能,以深入了解其调控机制并更好的利用这些基因资源。
综上所述,在高温胁迫时,坛紫菜出现基础代谢减慢,核酸、蛋白、糖类等合成速度下降以及能量合成受阻、碳同化降低等现象,甚至可能导致繁殖和发育过程变慢以及膜、质体等受伤害,但光合作用前期未受影响,同时HSP等修复蛋白表达增加,启动补救途径。
[1] 张学成,秦松,马家海,等.海藻遗传学[M].北京:中国农业出版社,2005.
[2] 杨锐,张晓龙,徐丽宁,等.坛紫菜耐高温胁迫机理之初步研究[C]//中国海洋湖沼学会藻类学分会第七届会员大会暨第十四次学术讨论会论文摘要集,2007.
[3] Chen S,Jiang J,Li HY,et al.The salt-responsive transcriptome of Populussimonii×Populusnigra via DGE[J].Gene,2012,504(2):203-212.
[4] Choi S,Hwang M S,Im S,et al.Transcriptome sequencing and comparative analysis of the gametophyte thalli of Pyropia tenera under normal and high temperature conditions[J].J Appl Phycol,2013,25(4):1237-1264.
[5] 杨惠.条斑紫菜功能基因组及重复序列特征研究[D].青岛:中国海洋大学,2011.
[6] Mortazavi A,Williams B A,McCueK,et al.Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].Nat Methods,2008,5(7):621-628.
[7] Li R,Yu C,Li Y,et al.SOAP2:an improved ultrafast tool for short read alignment[J].Bioinformatics,2009,25(15):1966-1967.
[8] Audic S,Claverie J M.The significance of digital gene expression profiles[J].Genome Res,1997,7(10):986-995.
[9] Kanehisa M,Araki M,Goto S,et al.KEGG for linking genomes to life and the environment[J].Nucleic Acids Res,2008,36:480-484.
[10] 朱竹君,骆其君,严小军,等.琼胶寡糖聚合度对坛紫菜抗性诱导的影响[J].海洋学报,2012,34(6):205-209.
[11] Bray E A,Bailey-Serres J,Weretilnyk E.Responses to abiotic stresses[R]//Buchanan B,Gruissem W,Jones R.Biochemistry and molecular biology of plants.American Society of Plant Biologists,Rockville,2000:1158-1203.
[12] Wang W,Vinocur B,Shoseyov O,et al.Role of plant heat-shock proteins and molecular chaperons in the abiotic stress response[J].Trends Plant Sci,2004,9(5):244-252.
[13] Allakhverdiev S I,Kreslavski V D,Klimov V V,et al.Heat stress:an overview of molecular responses in photosynthesis[J].Photosynth Res,2008,98(1-3):541-550.
[14] McKersie B D,Leshem Y Y.Stress and stress coping in cultivated plants[M].Dordrecht:Kluwer Academic Publishers,1994:181-193.
[15] Daugaard M,Rohde M.The heat shock protein 70 family:Highly homologous proteins with overlapping and distinct functions[J].FEBS Lett,2007,581(19):3702-3710.
[16] Kim E,Park H S,Jung Y,et al.Identification of the high-temperature response genes from Porphyra seriata(rhodophyta)expression sequence tags and enhancement of heat tolerance of Chlamydomonas(chlorophyta)by expression of the porphyra HTR2 gene[J].J Phycol,2011,47(4):821-828.
[17] Kim YK,JangK.Continuous heat shock enhances translational initiation directed by internal ribosomal entry site[J].Biochem Biophys Res Comun,2002,297(2):224-231.
[18] Warner J R,McIntoshKB.How common are extraribosomal functions of ribosomal proteins[J].Mol Cell,2009,34(1):3-11.
[19] Fu J,MomciloviéI,Clemente T E,et al.Heterologous expression of a plastid EF-Tu reduces protein thermal aggregation and enhances CO2fixation in wheat(Triticum aestivum)following heat stress[J].Plant Mol Biol,2008,68(3):277-288.
[20] UranoK,Kurihara Y,Seki M,et al.“Omics”analyses of regulatory networks in plant abiotic stress responses[J].Curr Opin Plant Biol,2010,13 (2):132-138.
[21] Mittler R,Flinka A,Goloubinoff P.How do plant feel the heat?[J].Trends Biochem Sci,2012,37(3):118-125.
[22] Qin D,Wu H,Peng H,et al.Heat stress-responsive transcriptome analysis in heat susceptible and tolerant wheat(Triticum aestivum L.)by using Wheat Genome Array[J].BMC Genomic,2008,9:432.
Digital gene expression profiling analysis of Pyropia haitanensis (Rhodophyta)under high temperature stress
Lai Xiaojuan1,Yan Xiaojun1,Yang Rui1,Luo Qijun1,Chen Haimin1
(1.Marine Biotechnology Laboratory,Key Laboratory of AppliedMarine Biotechnology,Ministry of Educaltion,Ningbo University,Ningbo 315211,China)
Pyropia haitanensis is an economically important red alga cultivated in China.As an intertidal alga,P.haitanensis developed various and highly effective strategies to overcome those environmental stressors,such as temperature fluctuation and osmotic shock.In this research,digital gene expression profiling(DGE)technique based on high throughput sequencing was used to analysis the gene expression difference of P.haitanensis under high temperature stress.To validate the DGE data,eight genes were selected for real-time quantitative PCR(QRTPCR)analysis.The expression level of high-temperature response gene hsp70 was particularly investigated.Results indicated that 256 unigenes including HSP,ribosomal protein L12,elongation factor EF-Tu and some photosynthesis-related genes were up-regulated,3 820 unigenes involved in anabolism and metabolism of nucleic acid,protein and carbohydrate were down-regulated.Gene Ontology analysis indicated that differentially expressed genes mainly involved in reproduction and developmental process,exercised the functions of catalytic activity and ligase activity,and located in membrane-bounded organelle such as plastid.Pathway enrichment analysis showed that these genes distributed in 107 pathways.Down-regulated genes were significantly enriched in mRNA surveillance and RNA transport pathway,while up-regulated genes were partially enriched in protein processing in endoplasmic reticulum,RNA degradation and photosynthesis pathway.QRT-PCR confirmed the accuracy of DGE,and the positive response of hsp70 to high temperature was also demonstrated.In summary,DGE results indicated that under high temperature stress,primary metabolism,biosynthesis,energy synthesis,and carbon assimilation of P.haitanensis were weakened,whereas,the rescue strategies were activated.
Pyropia haitanensis;high temperature stress;digital gene expression profiling(DGE);differentially expressed gene;response
S917.3
A
0253-4193(2014)06-0104-08
2013-06-05;
2013-10-11。
浙江省重大科技专项(2012C12907-6);国家公益性行业(海洋)科研专项经费项目(201105023);浙江省创新团队项目(2012R10025-07);宁波市创新团队项目(2011B81007);宁波市科技攻关项目(201201C1011016);宁波大学研究生科研创新基金项目。
赖晓娟(1989—),女,浙江省台州市人,研究方向为海洋生物。E-mail:laixiaojuan204@gmail.com
*通信作者:陈海敏,研究员,研究方向为海洋生物。E-mail:chenhaimin@nbu.edu.cn
赖晓娟,严小军,杨锐,等.高温胁迫下坛紫菜的数字基因表达谱研究[J].海洋学报,2014,36(6):104—111,
10.3969/j.issn. 0253-4193.2014.06.013
Lai Xiaojuan,Yan Xiaojun,Yang Rui,et al.Digital gene expression profiling analysis of Pyropia haitanensis(Rhodophyta)under high temperature stress[J].Acta Oceanologica Sinica(in Chinese),2014,36(6):104—111,doi:10.3969/j.issn.0253-4193.2014.06.013

