大连湾石油污染沉积物中细菌群落结构分析
高小玉,明红霞,陈佳莹,李江宇,韩俊丽,林凤翱,樊景凤*
(1.国家海洋局国家海洋环境监测中心,辽宁大连 116023;2.国家海洋局近岸海域生态环境重点实验室,辽宁大连 116023;3.大连海洋大学水产与生命学院,辽宁大连 116023)
大连湾石油污染沉积物中细菌群落结构分析
高小玉1,2,3,明红霞1,2,陈佳莹1,2,3,李江宇1,2,3,韩俊丽1,2,3,林凤翱1,2,樊景凤1,2*
(1.国家海洋局国家海洋环境监测中心,辽宁大连 116023;2.国家海洋局近岸海域生态环境重点实验室,辽宁大连 116023;3.大连海洋大学水产与生命学院,辽宁大连 116023)
大连新港“7.16”输油管道爆炸溢油事故发生后,为探究石油污染与细菌群落结构变化之间的关系及在石油生物降解过程中起重要作用的细菌菌群,本研究对大连湾表层沉积物中石油烃含量和细菌宏基因组16S rDNA V3区进行分析。结果表明:溢油初期2010年8月DLW01站位表层沉积物石油烃含量高达1 492 mg/kg,符合第三类沉积物质量标准,随着时间推移,2011年4月、2011年7月、2011年12月航次各站位沉积物中石油烃含量基本呈下降趋势,且均符合第一类沉积物质量标准;16S r DNA PCR-DGGE方法分析表明,石油烃含量高的区域优势细菌种类少,反之则较丰富;海洋环境中同一地点的细菌群落能保持一定稳定性;大连湾石油污染沉积物中变形菌门γ-变形菌纲和拟杆菌门一直保持较高的优势度,是在石油生物降解过程中起重要作用的细菌菌群,而厚壁菌门只在石油烃含量低的区域出现;此外,出现的对污染物敏感的嗜冷杆菌可作为石油污染指示生物进行深入研究。
细菌优势种群;石油污染;大连湾;沉积物
1 引言
有调查显示,石油污染对微生物的群落结构产生一定的影响,而微生物群落结构是海洋生态系统的重要组成部分[1],微生物在群落水平上通过各种单一功能的种群依次阶梯作用完成对环境中的有机物(如石油烃)、氮、磷、硫等污染物的降解[2]。而某种或某类微生物数量或活性的消长都会影响到群落功能的完整性,最终导致生态系统的失衡或破坏。学者们在海洋石油污染细菌群落鉴定以及主要降解菌的分类等方面进行了大量研究[2—4],也采用了变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)方法,但大部分学者对得到的数据分析不够透彻,未将各个细菌种属归纳至门或纲的分类单元,研究结果繁杂、可比性差。而采用DGGE技术结合测序比对、系统发育分析的方法对环境中微生物群落跟踪调查可清楚了解微生物群落的优势种群组成及其演替规律。
大连湾位于辽东半岛南端,是大连地区黄海沿岸的第一大湾。由于历史的原因,在海陆运输接触点的大连湾周围,设有造船、石油化工、钢铁等工业企业[5]。2010年7月16日,位于大连湾附近的大连新港石油储备库输油管道发生爆炸,大量原油泄漏入海,导致包括大连湾在内的局部海域受到严重污染[6]。海洋沉积物是大多数污染物的最终归宿,泄露到海洋中的石油,通过蒸发、化学聚凝、沉降、吸附等作用最终沉积于海底[7],而沉积的石油对沉积物中的微生物群落会造成怎样的影响,同时微生物群落在石油降解中发挥着怎样的作用呢?为探究这一问题,本文选取2010年大连发生的海洋溢油事故影响海域大连湾为研究海域,首先分析大连湾沉积物样品中石油烃含量,并采用DGGE结合测序比对、系统发育分析的方法研究其细菌优势种群,旨在分析石油污染环境中细菌优势种群结构组成和变化规律,为探究石油污染生物降解过程中起重要作用的细菌菌群提供依据。
2 材料与方法
站位选取按照离岸距离及与溢油爆炸点位置距离不同,在大连湾海区设置DLW01(39°1.541′N, 121°44.801′E)、DLW02(38°58.488′N,121° 45.297′E)和DLW03(38°58.488′N,121°45.297′E)3个站位(图1),同时也分别代表海湾的3个重要位置—近岸、湾中和湾口,其中湾口DLW03距离爆炸溢油点较近。分别于2010年8月、2011年4月、2011年7月、2011年12月采集了3个站位共12个表层沉积物样品,每个样品用箱式采泥器各采集2份(100 g/份),置于冷藏箱中(4℃左右)保存,于24 h内送至实验室,用于表层沉积物石油烃含量检测和细菌优势种群分析。
2.1 表层沉积物的石油烃含量测定
采用紫外分光光度法测定表层沉积物中石油烃的含量,具体操作参照《海洋监测规范》(GB 17378.4 -2007)[8]。
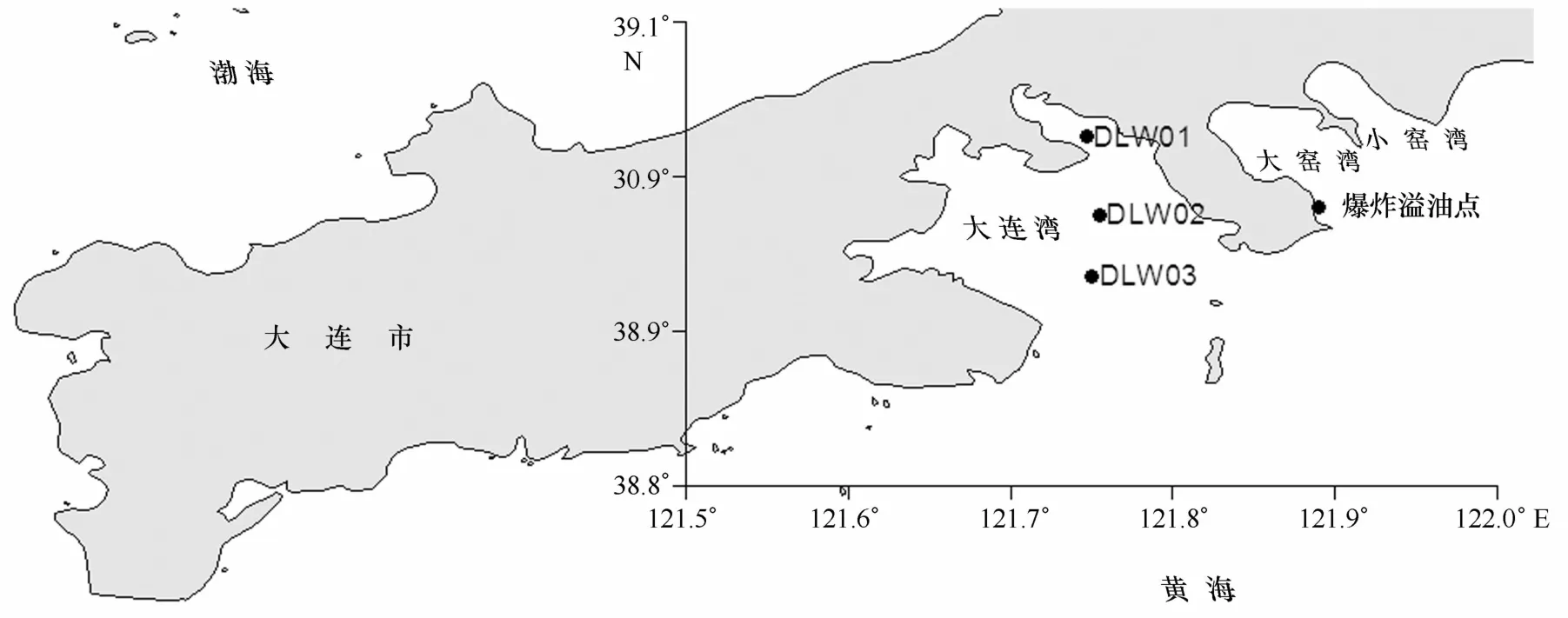
图1 大连湾沉积物样品采集站位
2.2 16S rDNA PCR-DGGE分子指纹图谱技术
2.2.1 微生物宏基因组的提取和PCR扩增
首先,采用冻融和加入SDS、蛋白酶K相结合的方法裂解海洋沉积物中的微生物细胞,然后用酚-氯仿-异戊醇法抽提其宏基因组[9],电泳纯化(DNA凝胶回收试剂盒,天根生物公司),经适当稀释作为模板,采用巢式PCR扩增16S rDNA的V3区段。细菌16S rDNA的扩增引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGT TACCTTGTTACGATCC-3′);以细菌16S rDNA为模板,扩增其V3区段的引物为F338(5′-TCCTACGGGAGGCAGCAG-3′)和R518(5′-ATTACCG CGG CTGCTGG-3′),PCR试剂均购自TaKaRa公司,PCR反应体系和程序参考前期报道[10],其中F338需加上GC发卡,防止DNA在变性梯度凝胶电泳中完全解链,GC发卡结构序列为5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGC -3′。
2.2.2 变性梯度凝胶电泳条带的选择与测序
变性梯度凝胶电泳的凝胶配制及实验条件见参考文献[10]。
将DGGE图谱中12条泳道根据站位划分为3组,标记组内4个泳道在同一水平线上最清晰的条带,并用无菌刀片切下凝胶条带,储存于1.5 mL的离心管中,加入20μL灭菌的蒸馏水;4℃过夜扩散浸出凝胶中的DNA作为模板,以GC-F338和R518为引物,再重复进行16S rDNA的V3区段的PCR扩增和DGGE操作,纯化每条DGGE条带并保证其质量,最后用不带GC发卡的F338和R518引物进行PCR扩增[9],PCR产物与PMD19-T载体连接并转化到E.coli DH5α感受态细胞中克隆,送生工生物工程(上海)有限公司测序。
2.2.3 数据分析
(1)DGGE条带测序结果与NCBI数据库进行比对,确定其在原核生物界的分类地位,收集相似度最高的序列,用Clustal X 1.8和MEGA 4.1软件采用距离法(Neighbor joining,NJ)建立系统发育树[11],将同一分类地位的细菌归类后,进一步解析DGGE图谱,定性定量分析环境样品中的细菌优势种群组成。
(2)DGGE图谱经BIO-DAP软件分析,得到条带净光密度值(Net Intensity),根据净光密度值计算每个样品中各细菌类群的优势度Y,计算公式为:
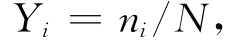
式中,ni为第i种细菌类群的DGGE条带净光密度值,N为所有条带的净光密度值之和。当Y>0.01时,该类菌群为优势种。结合DGGE测序和比对结果,将同一细菌类群的Y值相加得到其优势度。
(3)根据条带灰度值计算样品中细菌群落的香农-威纳指数(Shannon-Weaver index,H),分析细菌多样性。香农-威纳指数的计算公式为:式中,Yi为第i种细菌的优势度,S为细菌种类总数。
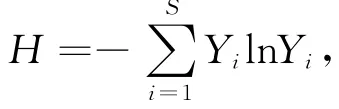
(4)DGGE图谱通过Quantity One软件采用轨道定量法识别泳道(Lane)、条带(Band)并匹配(Match)条带,输出DGGE图谱条带示意图,并对各个泳道进行UPGMA聚类分析,得出各个样品的细菌群落差异性和相似性。
3 结果与分析
3.1 石油烃含量
初步调查大连湾3个站位表层海洋沉积物的石油污染状况,结果表明该海区选择的3个站位中,DLW01站位沉积物污染较重,2010年8月其石油烃含量高达1 492 mg/kg,符合海洋沉积物质量标准(GB 18668-2002)中第三类海洋沉积物质量标准(≤1 500 mg/kg)[12],DLW02各航次平均石油烃含量为209.08 mg/kg,低于离爆炸溢油点较近的湾口DLW03站位,其各航次平均石油烃含量为253.95 mg/kg。除2011年8月采集的DLW01站位外,2011 年4月、2011年7月、2011年12月各航次、各站位均符合第一类海洋沉积物质量标准(≤500 mg/kg)[12],具体结果见图2。
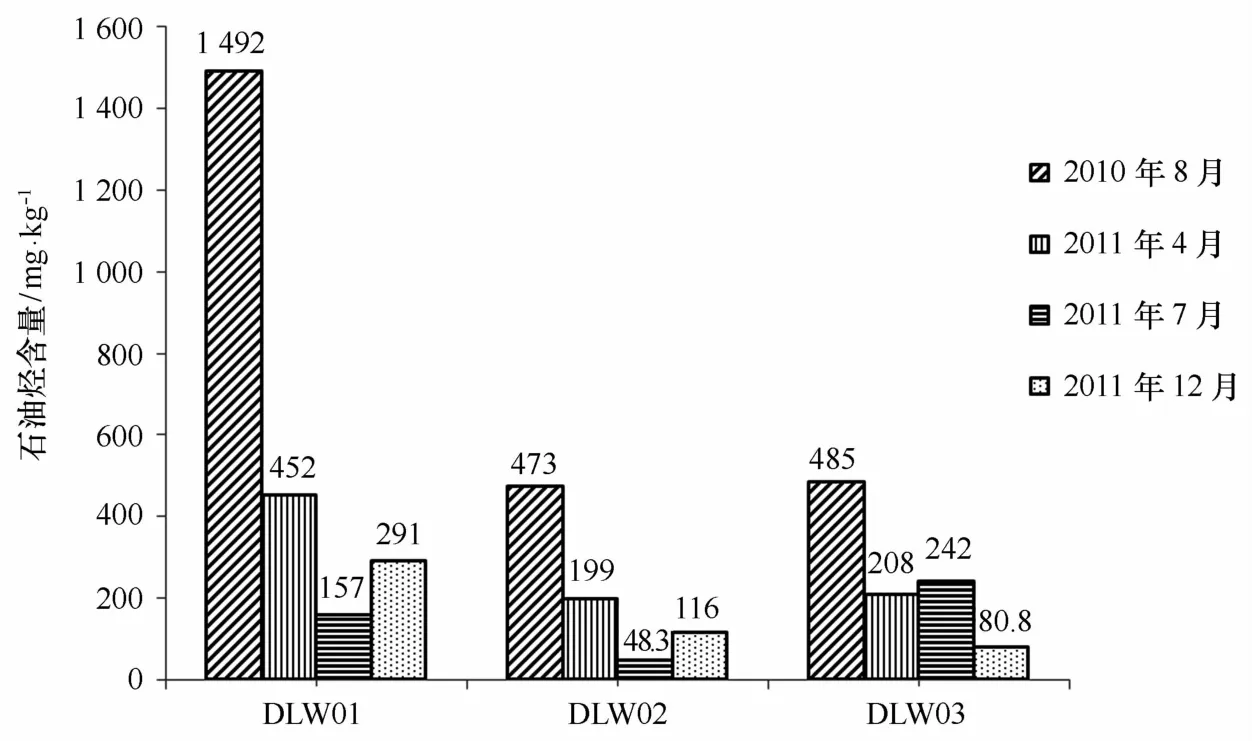
图2 大连湾表层沉积物中石油烃含量
3.2 16S rDNA PCR-DGGE结果
变性梯度凝胶电泳分离大连湾表层沉积物中细菌16S rDNA的V3区段,得到的电泳图谱见图3。通过DGGE得到的指纹图谱上每个条带代表一个微生物优势菌群,条带光密度值越大说明该菌群丰度越高,得到的条带越多说明研究对象多样性越高,通过测序和序列比对可以得出此细菌优势种群的种类(见表1和图4)。经优势度公式计算,本研究中切割的条带所代表的细菌均为样品中的优势种(Y>0.01),以变形菌门和拟杆菌门为代表。
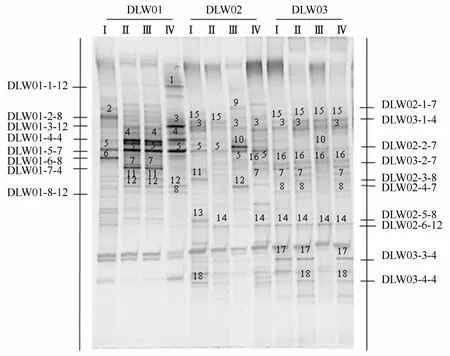
图3 大连湾表层沉积物中细菌群落DGGE图谱
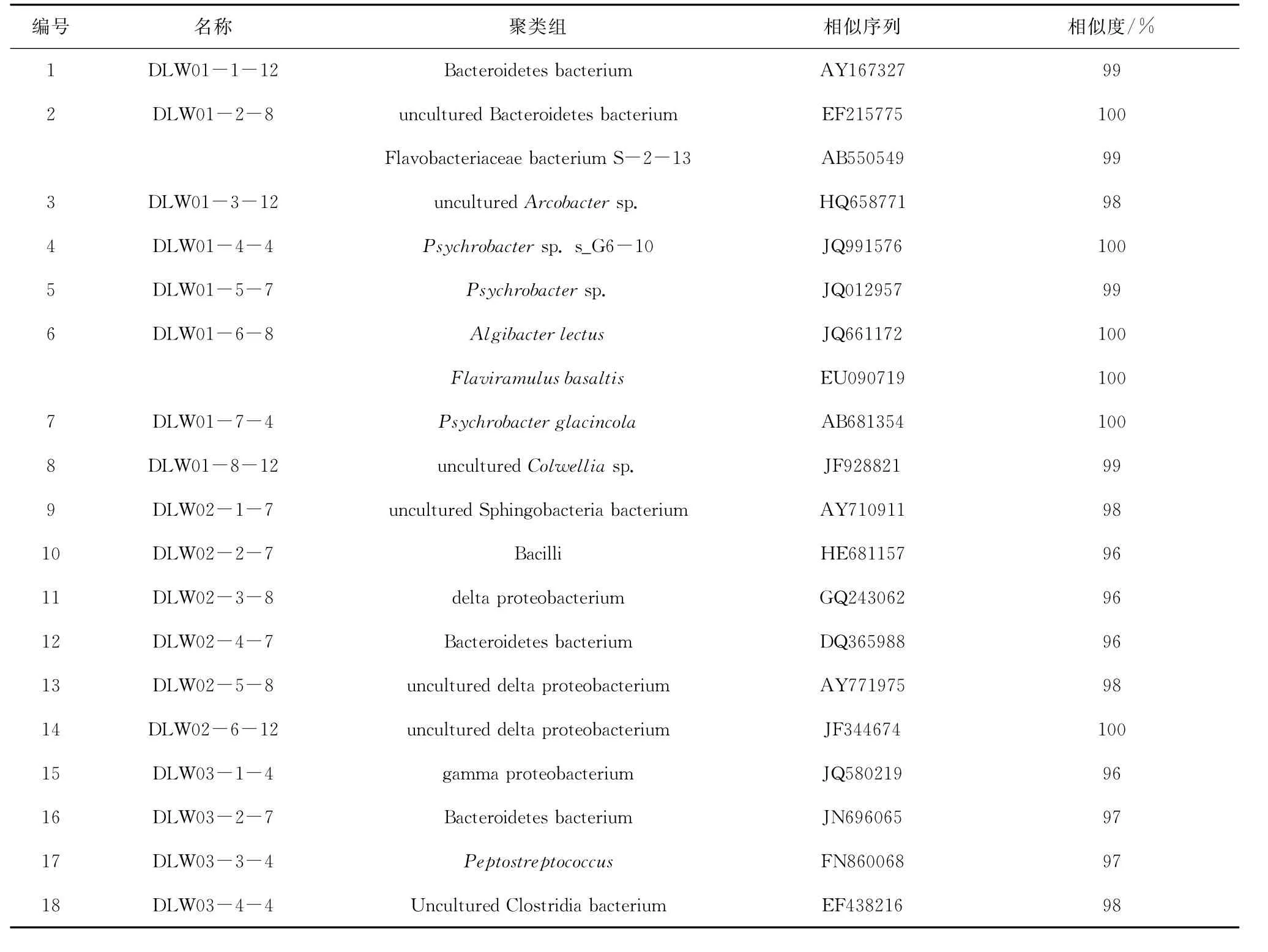
表1 DGGE条带测序结果
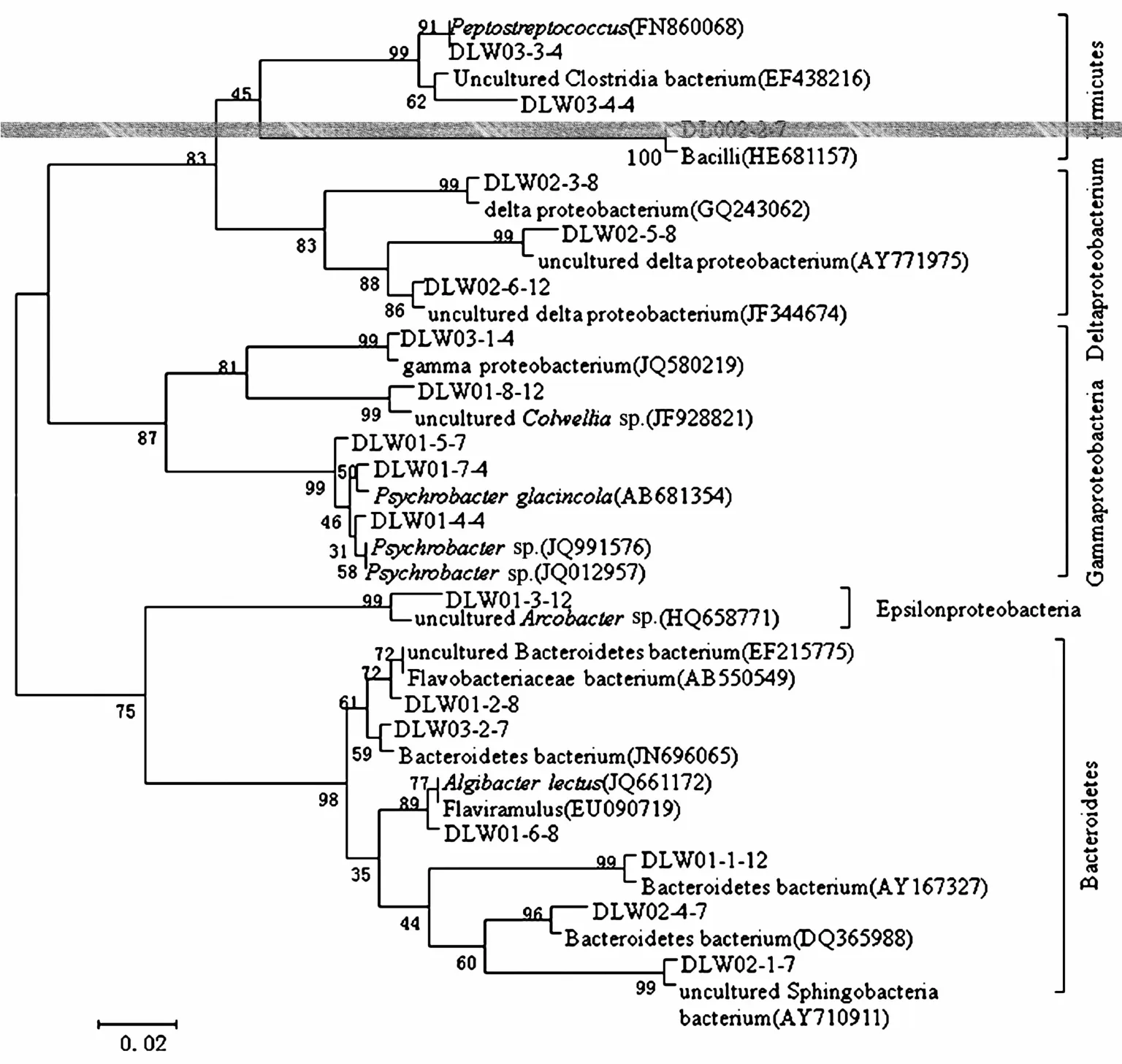
图4 大连湾表层沉积物中优势细菌系统发育树
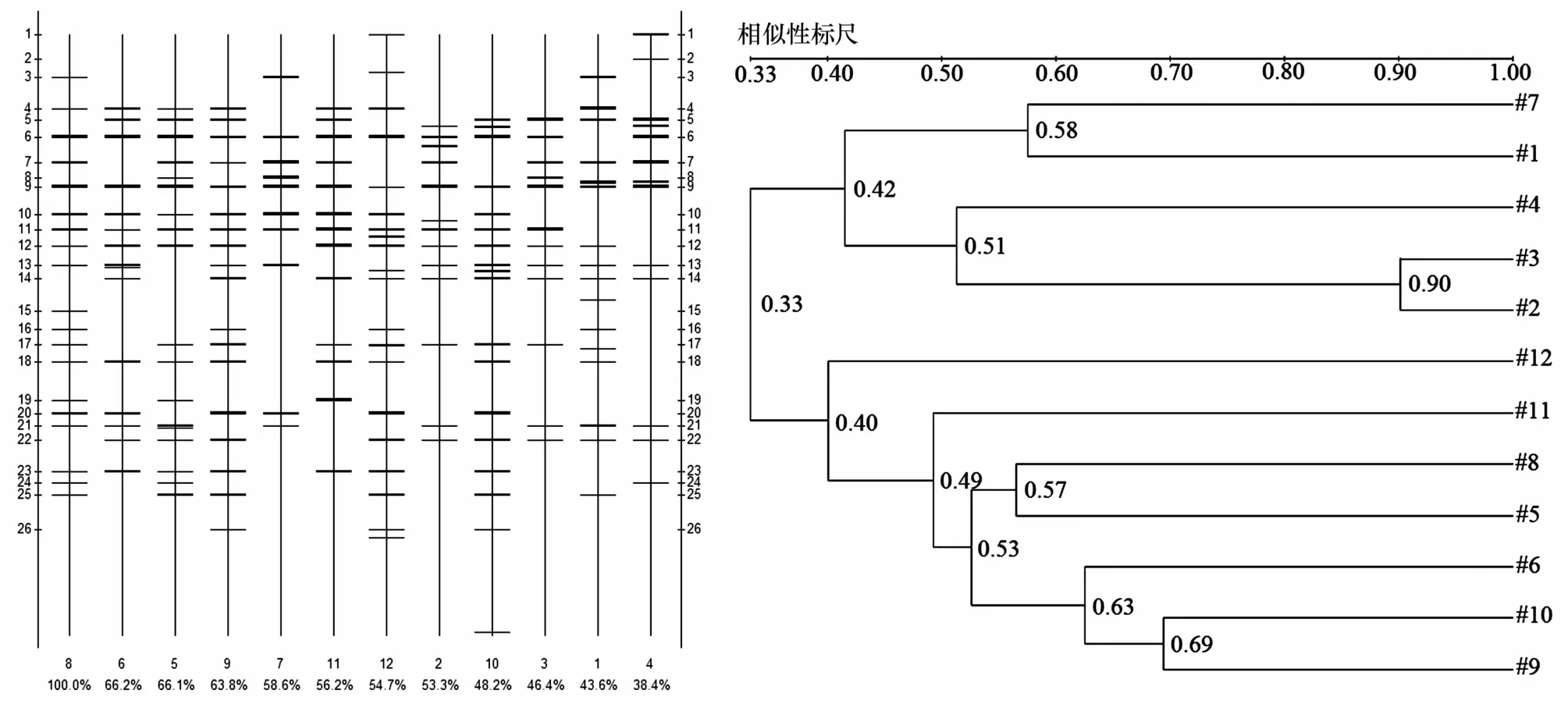
图5 大连湾表层沉积物细菌群落DGGE图谱的聚类分析
3.3 细菌群落组成变化分析
采用UPGMA聚类分析发现(图5),大连湾DLW01站位4个航次的沉积物中细菌群落(泳道1、2、3、4)聚为一支,说明DLW01站位4个航次的细菌群落组成具有相似性,表明海洋沉积物中的细菌群落能保持一定稳定性;DLW02、DLW03两个站位细菌群落比较相近(泳道5、6、8、9、10、11、12聚为一支),其细菌优势种群较DLW01站位丰富。结合DGGE图谱中条带优势度和条带测序分析结果(见表1),沉积物中细菌优势种群和细菌群落结构多样性(香农-威纳指数)的变化如图6所示。
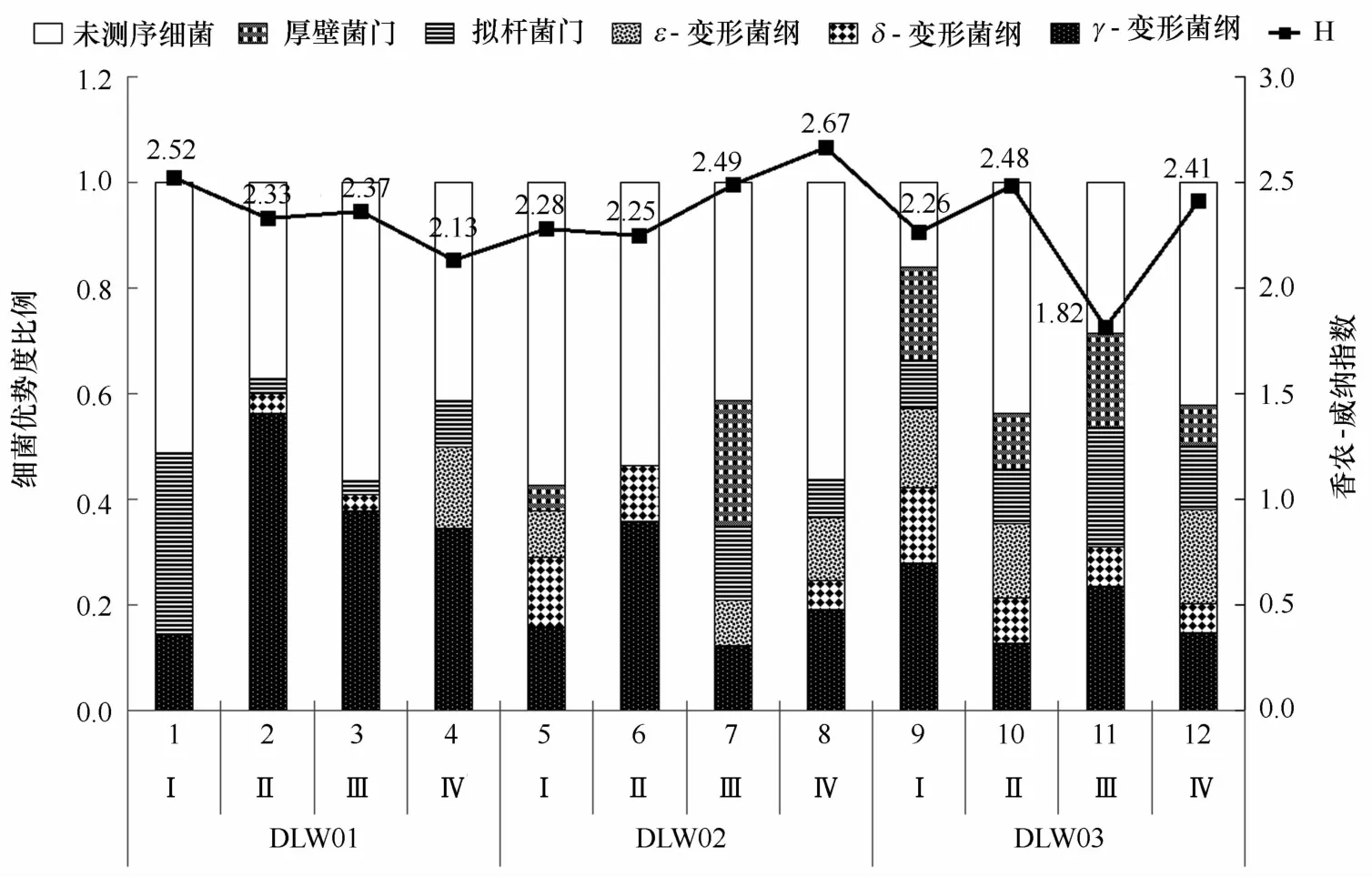
图6 大连湾石油烃污染沉积物不同站位(DLW01、DLW02、DLW03)细菌优势种群的优势度比例组成
由图6可以看出,DLW01的细菌优势种群变化情况是:2010年8月,拟杆菌门(条带2、6)的优势度Y 是0.343,变形菌门γ-变形菌纲(条带5)的优势度Y 为0.145;2011年4月和7月该站位沉积物中细菌优势种群基本一致,变形菌门的优势度超过拟杆菌门;2011年12月,变形菌门γ-变形菌纲(条带4、5、8;Y =0.345)依旧保持优势,拟杆菌门有所增多(条带1、12;Y=0.89),另外出现了变形菌门ε-变形菌纲的菌群(条带3;Y=0.153),其条带净光密度值较大(见图3)。该站位细菌群落香农-威纳指数随时间推移呈下降趋势。
分析DLW02站位的细菌优势种群演替发现:2010 年8月其细菌优势种群较为丰富,有变形菌门的γ-变形菌纲(条带5、15;Y=0.159)、δ-变形菌纲(条带11、13;Y=0.131)、ε-变形菌纲(条带3;Y=0.088),以及厚壁菌门(条带18;Y=0.049);2011年4月,其细菌优势种群只有变形菌门的γ-变形菌纲(条带5、15;Y=0.358)和δ-变形菌纲(条带14;Y=0.106);2011年7月其细菌优势种群丰富,以厚壁菌门(条带10;Y=0.237)、拟杆菌门(条带9、12;Y=0.142)为主,还有变形菌门γ-变形菌纲(条带5;Y=0.123)、ε-变形菌纲(条带3;Y=0.85);2011年12月的细菌优势种群比例较均匀,但未检测到厚壁菌门。该站位细菌群落香农-威纳指数随时间推移呈上升趋势。
DLW03站位的细菌优势种群不明显,4个航次中变形菌门的γ-变形菌纲、δ-变形菌纲、ε-变形菌纲,以及拟杆菌门和厚壁菌门均有出现,只是各自所占比例不同(图6)。该站位香农-威纳指数随时间而波动变化。
4 讨论
4.1 石油污染与细菌群落变化
综上所述,DLW01站位的细菌优势种群变化为:变形菌门中的γ-变形菌纲一直占优势地位;拟杆菌门由盛转衰,最终优势恢复不明显;后出现的ε-变形菌纲细菌,优势较明显。DLW02站位沉积物中细菌优势种群以变形菌门为主,拟杆菌门和厚壁菌门也有出现,除变形菌门的γ-变形菌纲外,其他各类细菌的出现不稳定,且优势度偏小、较平均。DLW03站位自2010年8月至2011年12月,沉积物细菌优势种群组成基本无改变,变形菌门、拟杆菌门、厚壁菌门均有出现。
在Brito等[13]的研究中发现,红树林沉积物经过原油富集后细菌群落多样性降低。仔细观察本研究图6,同一站位的细菌优势种群在溢油初期(2010年8月)较单调,后期(2011年4—12月)较丰富;石油烃含量高的站位(DLW01)优势细菌种类少,石油烃含量低的站位(DLW02、DLW03)则丰富。这可能由于石油烃含量高,只有少数几种细菌能够存活;而石油烃含量低则对细菌的抑制作用弱,其细菌优势种群相对丰富。但本研究未发现3个站位的细菌群落结构多样性变化与石油污染含量之间的关系。
4.2 石油污染与细菌优势种群
4.2.1 变形菌门与拟杆菌门
在海洋生态系统中多次发现变形菌门和拟杆菌门是占主导地位的细菌类群,其中β-变形菌纲通常在湖泊和河流出现,而α-和γ-变形菌纲经常大量出现在海洋系统[14—15]。如肖慧等[16]调查发现,青岛、威海水域夏、冬两季表层沉积物中变形菌门是主要类群,且γ-变形菌纲(γ-Proteobacteria)占优势。
研究表明[17—20],石油污染海域的变形菌门、拟杆菌门仍能保持其优势。如Hazen等[17]于2010年的8 月24日在《Science》杂志上发表的“深海油区富含石油烃降解菌”研究中阐述了γ-变形菌门的数量与石油烃含量呈正相关;1997年1月,Nakhodka油轮在日本海失事发生沉船溢油事故10、18、22、29个月后,近岸海水样品中微生物群落组成主要有嗜细胞菌属-黄杆菌属-拟杆菌属(CFB);附近海滩残留的石油污染物中主要是食烷菌(变形菌门γ-变形菌纲)和鞘氨醇单胞菌(拟杆菌门)等烃类降解菌[18],还有最著名和分布最广泛的γ-变形菌纲Alcanivorax.bor犽umensisa[19]。本研究中12个石油污染沉积物样本中,细菌优势群落均包括变形菌门γ-变形菌纲,如Psychrobacter sp.(条带5)、Psychrobacter glacincola(条带7)、uncultured Colwellia sp.(条带8)、gamma proteobacterium(条带15);此外,本次调查海区大连湾沉积物中还出现了归属于变形菌门的δ-变形菌纲和ε-变形菌纲优势种群。从系统发育分析树(见图4)可看出,本研究中出现了大量的拟杆菌门菌群(如条带1、2、6、12、16),其中一些为以往报道过的石油烃降解菌,如拟杆菌门黄杆菌科的Flaviramulus和Algibacter lectus,这些细菌的存在为石油污染的降解起到了积极的作用[18]。拟杆菌门细菌是一类厌氧的滑动细菌,不需要鞭毛,通过分泌粘液(多糖)在平坦的表面滑动[21]。由此可见,本研究中变形菌门γ-变形菌纲和拟杆菌门在石油污染环境中的大量出现具有其合理性。我们推断它们的滑动本领使其可以在粘稠的油污中自由穿行,同时它们又拥有很强的分泌胞外多糖能力,为滑动起到润滑作用,使其能够在恶劣的石油污染环境中存活。
4.2.2 厚壁菌门
本研究的3个站位都表现出以变形菌门和拟杆菌门为主,而厚壁菌门是在石油污染降低后才出现。余素林等[22]研究发现,黄河三角洲背景土壤中的微生物主要属于γ-变形菌门的海杆菌Marinobacter与食烷菌Alcanivorax,添加原油至37.85 g/kg后,这两个菌属的丰度有所波动,最后均恢复背景水平;原油的添加对背景土壤中的α-变形菌门Alphaproteobacteria以及拟杆菌门Bacteroidetes微生物未产生显著影响,但厚壁菌门只在背景土壤中出现(2.75%)。这与本研究的发现基本一致,说明变形菌门和拟杆菌门的细菌能够耐受石油污染,而厚壁菌门不适应石油污染环境,原油对其具有抑制作用。
4.3 污染环境中的特殊细菌种群
在2001年,印度科研人员曾对阿根廷附近的亚南极水域的细菌多样性调查,结果在受烃类污染物污染的水域中检测到嗜冷菌属Psychrobacter和弓形杆菌属Arcobacter相关的克隆[23]。在大连湾DLW01站位沉积物样品的细菌优势种群中,变形菌门的γ-变形菌纲嗜冷杆菌(Psychrobacter sp.;条带4、5、7)和ε-变形菌纲弓形杆菌属(Arcobacter;条带3)优势度明显,是以往石油污染研究中较少出现的特殊功能种群。
4.3.1 嗜冷杆菌属
据历史文献记载,嗜冷菌是指在温度低于0℃能缓慢生长,最适生长温度低于15℃,高于20℃则不能生长的细菌[24]。近年来有关研究除了针对嗜冷菌的嗜冷性,还兴起了嗜冷菌对污染物的敏感性研究。同济大学基于Psychrobacter sp.的CellSense生物传感器在重金属、有机物、表面活性剂、抗生素等毒性检测中应用的研究结果表明,Psychrobacter sp.具有较好的毒性响应特性[25—26],这一发明为快速检测石油污染的生理毒性提供了新方法,该菌有望成为检测石油污染的指示生物。
4.3.2 弓形杆菌属
弓形杆菌是一种人畜共患致病菌,该目标微生物已经被认为是欧洲和东南亚食源性相关疾病暴发的病因,美国农业部农业研究服务处的科学家对其做过重点研究,绘制了Arcobacter butzleri的宏基因组图谱[27],该类细菌在城市废水、水产养殖废水排放区域也有发现。吴春笃等[28]为掌握镇江城市污水中微生物种群结构特征,通过构建并分析城市污水中细菌16S r RNA基因文库发现:近似弓形杆菌属的细菌比例高达74.2%,为城市污水中的主要优势菌群,大连湾DLW01站位离岸较近,该区域可能受到陆源城市生活污水或养殖废水的污染,弓形杆菌的检出为城市污水处理和排放敲响了警钟。
5 结论和展望
本研究将DGGE图谱信息与目的条带测序比对结果相结合,对石油污染和细菌群落变化之间的内在联系进行了深入探讨。在大连新港“7.16”输油管道爆炸溢油事故发生后,大连湾表层沉积物中石油烃含量高的区域,细菌优势种群较单一,反之则较丰富;海洋环境中同一区域的细菌群落能保持一定稳定性,变形菌门γ-变形菌纲和拟杆菌门一直保持优势度较高,是石油生物降解过程中起重要作用的细菌菌群,而厚壁菌门只在石油烃含量低的区域出现;此外,出现的对污染物敏感的嗜冷杆菌可作为石油污染指示生物深入研究,具有致病性的弓形杆菌为城市污水处理和排放敲响了警钟。
存在的问题及其展望:对细菌优势种群的认识还不够完全,大连湾石油污染环境中一定还存在许多细菌种群等待被分离研究;此外这些已经获得的细菌优势种群降解石油烃的机制值得在生理生化或遗传特性等方面深入研究探讨。
[1] Fuhrman J A.Microbial community structure and its functional implications[J].Nature,2009,495(7244):193-199.
[2] 黄磊,李丹,谢玉娟,等.石油污染海域的微生物群落及烃的降解[J].微生物学通报,2007,34(2):339-342.
[3] 吴常亮,王鑫,邵宗泽.印度洋表层海水石油降解菌的多样性分析[J].微生物学报,2010,50(9):1218-1225.
[4] 林学政,沈继红,杜宁,等.北极海洋沉积物石油降解菌的筛选及系统发育分析[J].环境科学学报,2009,29(3):536-541.
[5] 盖美,王本德.大连市近岸海域水环境质量及影响因素分析[J].水科学进展,2003,14(4):354-358.
[6] 国家海洋局.2010年中国海洋环境状况公报[R].北京:国家海洋局,2011.
[7] 王静芳,韩庚辰.大连湾近岸沉积物中油类污染的研究[J].海洋通报,1994,13(04):59-63.
[8] 中华人民共和国国家质量监督检验检疫总局.海洋监测规范第5部分:沉积物分析[S].北京,中国国家标准化管理委员会,2007.
[9] Chong C W,Pearce D A,Convey P,et al.High levels of spatial heterogeneity in the biodiversity of soil prokaryotes on Signy Island,Antarctica[J]. Soil Biology and Biogeochemistry,2010,42(4):601-610.
[10] 付慧,樊景凤,陈佳莹,等.黄河三角洲北部互花米草盐沼湿地区与贝壳沉积区微生物群落的DGGE分析[J].海洋环境科学,2011,30(2):216-219,226.
[11] TamuraK,Dudley J,Nei M.MEGA4:Molecular Evolutionary Genetics Analysis(MEGA)Software Version 4.0[J].Molecular Biology and E-volution,2007,24(8):1596-1599.
[12] 国家环境保护总局.GB 18668-2002海洋沉积物质量标准[S].北京:中国标准出版社,2002.
[13] Brito E M S,Guyoneaud R,Goñi-Urriza M,et al.Characterization of hydrocarbonoclastic bacterial communities from mangrove sediments in Guanabara Bay,Brazil[J].Research in Microbiology,2006,157(8):752-762.
[14] Stevens H,Stübner M,Simon M,et al.Phylogeny of Proteobacteria and Bacteroidetes from oxic habitats of a tidal flat ecosystem[J].FEMS Microbiology Ecology,2005,54(3):351-365.
[15] 樊景凤,张兰,明红霞,等.北戴河近岸沉积物中微生物16S rDNA的PCR-RFLP分析[J].海洋环境科学,2008,28(05):409-413.
[16] 肖慧,张艳,张喆,等.青岛、威海水域夏冬季表层沉积物细菌多样性的初步研究[J].中国海洋大学学报(自然科学版),2009,39(4):641-646.
[17] Hazen T C,Dubinsky E A,Desantis T Z,et al.Deep-Sea Oil Plume Enriches Indigenous Oil-Degrading Bacteria[J].Science,2010,330(6001):204-208.
[18] Kasai Y,Kishira H,SyutsuboK,et al.Molecular detection of marine bacterial populations on beaches contaminated by the Nakhodka tanker oilspill accident[J].Environmental Microbiology,2001,3(4):246-255.
[19] Schneiker S,Dos Santos V A M,Bartels D,et al.Genome sequence of the ubiquitous hydrocarbon-degrading marine bacterium Alcanivorax borkumensis[J].Nat Biotechnol,2006,24(8):997-1004.
[20] Han P,Zheng L,Cui Z S,et al.Isolation,identification and diversity analysis of petroleum-degrading bacteria in Shengli Oil Field wetland soil[J]. Chinese Journal of Applied Ecology,2009,20(5):1202-1208.
[21] Berman J.Chapter 10-Bacteroidetes and Fusobacteria[M]//Berman J.Taxonomic Guide to Infectious Diseases.Boston:Academic Press,2012:57 -60.
[22] Yu S,Li S,Tang Y,et al.Succession of bacterial community along with the removal of heavy crude oil pollutants by multiple biostimulation treatments in the Yellow River Delta,China[J].Journal of Environmental Sciences,2011,23(9):1533-1543.
[23] Prabagaran S R,Manorama R,Delille D,et al.Predominance of Roseobacter,Sulfitobacter,Glaciecola and Psychrobacter in seawater collected off Ushuaia,Argentina,Sub-Antarctica[J].FEMS Microbiology Ecology,2007,59(2):342-355.
[24] Morita R Y.Psychrophilic bacteria[J].Bacteriological reviews,1975,39(2):144-167.
[25] 赵红宁.基于新型毒性敏感菌株的CellSense生物传感器毒性分析性能研究[D].上海:同济大学,2009.
[26] 王学江,贺莹,丁钰力,等.嗜冷杆菌(Psychrobacter sp.)微生物传感器毒性分析性能研究[J].环境科学学报,2010,30(5):965-971.
[27] Miller W G,Parker C T,Rubenfield M,et al.The complete genome sequence and analysis of the epsilonproteobacterium Arcobacter butzleri[J]. PLoS One,2007,2(12):e1358.
[28] 吴春笃,许小红,宁德刚,等.城市污水细菌多样性及其生物安全性研究[J].中国安全科学学报,2008,18(1):119-122.
Bacterial communities in Dalian Bay petroleum pollution sediments
Gao Xiaoyu1,2,3,Ming Hongxia1,2,Chen Jiaying1,2,3,Li Jiangyu1,2,3,Han Junli1,2,3,Lin Feng’ao1,2,Fan Jingfeng1,2
(1.National Marine Environmental Monitoring Center,State Oceanic Administration,Dalian 116023,China;2.Key Laboratory for Ecological Environment in Coastal Areas,State Oceanic Administration,Dalian 116023,China;3.College of Aquiculture andLife Science,Dalian Ocean University,Dalian 116023,China)
In order to explore the connection between petroleum pollution and bacterial community structure change,the important dominant bacteria communities in the process of oil biodegradation,after the“7.16”pipeline explosion and oil spill accident happened in Dalian Xingang,the content of petroleum hydrocarbon and bacterial metagenome were studied in Dalian Bay.Results showed that the petroleum hydrocarbon content in the surface sediment of DLW01 in August 2010 was 1 492 mg/kg,according with the third standard of marine sediment quality.As time went on,the content of petroleum the presented basic downward thrend,and all conformed to the first standard of marine sediment quality in April 2011,July 2011,December 2011.16S rDNA targeted PCR-DGGE results suggested that the dominant bacteria communities were monotonous in high petroleum hydrocarbons areas,while conversely rich in low oil pollution.Bacterial community in the same place could maintain stability.Phylum Gammaproteobacteria and Bacteroidetes were higher in the oil polluted sediment of Dalian Bay,which played an important role in the process of oil biodegradation.Phylum Firmicutes only detected in the area of low oil pollution.The sensitive pollution indicator Psychrobacter sp.could be used as biological indicator for further research.
dominant bacterial communities;oil pollution;Dalian Bay;sediment
Q938.1
A
0253-4193(2014)06-0058-09
2013-06-27;
2013-11-27。
国家海洋局海洋溢油鉴别与损害评估技术重点实验室开放研究基金(201103)。
高小玉(1987—),女,辽宁省大连市人,主要从事海洋环境中微生物的研究。E-mail:149786894@qq.com
*通信作者:樊景凤(1972—),女,黑龙江省明水县人,研究员,博士,主要从事海洋微生物学与水产动物病害学研究。E-mail:jffan@nmemc.gov.cn
高小玉,明红霞,陈佳莹,等.大连湾石油污染沉积物中细菌群落结构分析[J].海洋学报,2014,36(6):58—66,
10.3969/j. issn.0253-4193.2014.06.008
Gao Xiaoyu,Ming Hongxia,Chen Jiaying,et al.Bacterial communities in Dalian Bay petroleum pollution sediments[J].Acta Oceanologica Sinica(in Chinese),2014,36(6):58—66,doi:10.3969/j.issn.0253-4193.2014.06.008

