超声时间对米糠蛋白理化和功能特性的影响
王长远 许 凤 张 敏
(黑龙江八一农垦大学食品学院1,大庆 163319)
(东北农业大学食品学院2,哈尔滨 150030)
(北京工商大学食品学院3,北京 100037)
蛋白质的改性方法有物理法、化学法、生物法和基因工程法[1]。物理改性是利用热、电、磁、机械能等物理作用形式改善蛋白的功能特性,对产品无毒副作用及对产品营养性能影响较小。超声波被认为是安全、无毒、环保的,这是超声相比于其他改性技术的一大优势。超声可分为2大类:低强度超声(频率100 kHz~1 MHz,功率 <1 W/cm2)和高强度超声(频率16~100 kHz,功率 10~1 000 W/cm2),低强度超声是一种常用的分析技术,可以为食物物理化学性质(如硬度、糖度、酸度等)提供数据,而高强度超声可用于改变食物的物理化学性质[2]。
目前,应用高强度超声改变生物大分子被广泛的研究,如使用超声水解淀粉,形成短链分子和还原糖[3]。Chen等[4]利用超声波处理来增加蛋白质的水解速率。杨会丽等[5]对大豆分离蛋白进行超声处理的研究发现,超声处理后蛋白的溶解性、起泡性和乳化性显著提高。也有报道指出乳清蛋白和酪蛋白经20 kHz的超声处理后,降低了蛋白的黏度,并且改善了凝胶特性[6]。除了研究超声对蛋白功能性质的影响外,也有学者对蛋白结构进行了测定。Krešic'a等[7]报道,超声处理虽然没有改变乳清蛋白的巯基含量,但轻微的改变了其二级结构和表面疏水性。Krishnamurthy等[8]利用PAGE和体积排阻色谱法研究超声处理对溶菌酶亚基组成变化情况,发现蛋白片段之间无差异,认为超声作用并没有引起一级结构的变化。
已有研究证明超声能够显著改善蛋白的功能特性,并且超声波技术具有作用时间短、操作简单易控制及能耗较低等优点[9],然而关于用超声处理RBP改善其功能性质和结构的研究还鲜有报道。本试验研究了超声处理时间对RBP溶解性、起泡性、乳化性、表面疏水性、游离巯基和亚基组成的影响,为RBP的深加工提供理论基础。
1 材料与方法
1.1 试验试剂
牛血清白蛋白、TEMED、β-巯基乙醇、丙烯酰胺、N,N-甲叉双丙烯酰胺、Tris、甘氨酸、考马斯亮蓝R-250、DTNB、ANS:美国 Sigma公司;低相对分子质量标准蛋白:中国科学院上海生物化学研究所。
1.2 材料与仪器
全脂米糠:黑龙江省农垦总局查哈阳农场,水稻品种为空育131。
FS-450N超声波处理器:上海生析仪器有限公司;TDZ5-WS台式低速离心机:湘仪离心机仪器有限公司;RF-5301荧光分光光度计:岛津国际贸易(上海)有限公司。
1.3 试验方法
1.3.1 RBP的制备
原料米糠过60目筛,按照1∶10(g∶mL)加入正己烷,室温下于通风橱中不断搅拌脱脂4 h,4 000 r/min,离心10 min,脱脂后将米糠置于通风橱中挥发至干。
根据王威等[10]的方法提取RBP。脱脂米糠50 g,加入500 mL蒸馏水,用NaOH溶液调pH至9,室温下搅拌2 h,4 000 r/min离心20 min,上清液调节pH至4.5,4 000 r/min离心15min,沉淀于4℃对蒸馏水透析48 h,真空冷冻干燥,干粉于-20℃保存备用。
1.3.2 蛋白质含量的测定
凯氏定氮法(GB 5009.5—2010)。
1.3.3 RBP的超声处理
分别称取200 mg米糠浓缩蛋白于烧杯中,加入20 mL pH 7.4的磷酸缓冲溶液,混合液置于冰水浴中温度平衡后,使用20 kHz,额定功率450 W的超声破碎仪,在工作时间为4 s,间歇时间2 s,振幅为50%的条件下,超声处理累计时间分别为5、15、30、45 min。
1.3.4 溶解性的测定
将200 mg样品溶解在20 mL的0.01 mol/L pH 7.4的磷酸缓冲液中,室温下搅拌30 min,4 000 r/min离心20 min,用福林酚法测定上清液中蛋白质含量,所有试验重复测定3次,蛋白质的溶解度按下式计算。
蛋白质的溶解度=(上清液中蛋白质的含量/样品中蛋白质含量)×100%
1.3.5 乳化性的测定
将经超声处理的各样品浓度稀释至1 mg/mL,取3 mL样品加入2 mL大豆油,高速均质后于500 nm处测定吸光值,以0.1%的 SDS(十二烷基磺酸钠)溶液作为空白,室温放置10 min后再次取样测定[11]。按下式计算:
乳化活性(EAI)/m2/g=(2×2.303×A0×N)/(c×Φ×104)
乳化稳定性(ESI)/min=(A0×t)/(A0-A30)
式中:A0为均质后迅速被稀释的乳化液的吸光值;A30为乳化液在静止30 min后的吸光值;t为时间(本试验30 min);N为稀释倍数;Φ为乳化液中油的体积分数(本试验是0.4);c为样品溶液中蛋白质浓度/g/mL。
1.3.6 起泡性的测定
根据Sze-Tao等[12]描述的方法测定起泡性(FC)和泡沫稳定性(FS)。将经超声处理的各蛋白样品稀释至 1 mg/mL,13 000 r/min速度下均质 2 min。迅速将混合液转移至25 mL的量筒中,量取搅拌前和搅拌后的体积,搅拌后增加的体积(%)即为FC,FS为泡沫在30 min内的变化。FC和FS按以下公式计算:

式中:V为未经搅拌的样品溶液的体积/mL;V0为搅拌结束时刻泡沫体积/mL;V30为搅拌结束30 min时泡沫体积/mL。
1.3.7 游离巯基的测定
根据 Lagrain等[13]和 Shiyi等[14]描述的方法测定游离巯基含量。取1.0 mg/mL蛋白溶液1.0 mL加入2.0mL Tris-甘氨酸缓冲溶液和20μL 4 mg/mL DTNB的Ellman试剂,室温下放置5 min,用分光光度计在412 nm波长下测定吸光度值,以不加样品而加Ellman试剂为空白,以不加Ellman试剂而加样品溶液测其混浊度。巯基含量计算如下:

式中:A412为加DTNB时样品的吸光度-不加DTNB时样品的吸光度;D为样品的稀释倍数;C为固形物含量。
1.3.8 表面疏水性的测定
根据Gulseren等[15]描述的方法测定。采用ANS荧光探针法。荧光条件:激发波长390 nm;发射波长470 nm(400~600 nm扫描获得);狭缝宽度5 nm。
1.3.9 SDS-PAGE凝胶电泳
根据Zhao等[16]描述的方法进行,浓缩胶为5%,分离胶浓度为12%。
1.4 数据处理
所有试验重复3次,结果表示为±s。用SAS 8.12进行显著性及相关性分析。
2 结果与分析
2.1 蛋白质含量的测定
采用凯氏定氮法测定提取的米糠蛋白干粉中蛋白质质量分数为(74.43±1.38)%。
2.2 超声处理后样品温度和pH的变化
表1所示,超声处理后的样品溶液的pH值没有显著的变化(P>0.05)。样品的起始温度为室温下溶液的温度为23℃,处理后溶液的温度升高到30℃左右,显著低于Abayomi等[17]报道的RBP的变性温度。这是符合逻辑的,因为20 kHz探头工作时会有较高的能量输入,过多的能量被释放出来导致温度上升。

表1 超声时间对蛋白溶液的pH和温度的影响
2.3 溶解性分析
如图1所示,在超声时间5~45 min,溶解度的增幅不大,与未经超声处理的RBP相比,超声处理后的RBP的溶解度显著增加,由25.52%增加到79.23%~83.88%。溶解度增加是因为超声处理过程中产生大量的空化气泡,气泡崩溃时其周围区域的温度和压力大幅增加,从而导致蛋白质分子展开和部分基团暴露。Morel等[18]指出高强度超声(20 kHz探头)通过改变蛋白质的构象和结构使亲水性的氨基酸暴露,静电引力增加,更多的水分子与蛋白质作用,从而增加了蛋白质的溶解性。

图1 超声时间对RBP溶解性的影响
2.4 乳化性分析
由试验结果(见图2)可知,随着超声时间的延长,RBP的乳化活性和乳化稳定性显著增加,在30~45 min时,EAI和ESI最强。与未经超声处理的RBP相比,EAI增加了82.28%左右。这是因为超声处理后蛋白的疏水基团外露,结构变得更加无序,并且减小了液滴的尺寸,使蛋白更多的吸附在油-水界面。孙冰玉等[19]在对大豆蛋白超声处理(如均质)过程中指出,震荡运动有利于蛋白质的吸附和形成可溶性聚集体。所以超声处理后的蛋白的乳化活性得到了改善。在超声过程中湍流运动的影响下,使乳化液中的油泡一体化,蛋白质具有更好的取向,这可以解释乳化稳定性的增加。
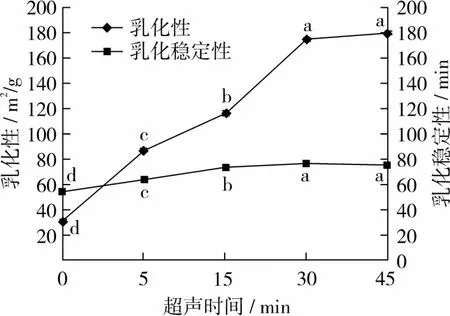
图2 超声时间对RBP乳化性及乳化稳定性的影响
2.5 起泡性分析
机械均质过程往往会增加起泡能力,超声的均质作用通常是使蛋白质颗粒分布更均匀[20]。经超声处理的RBP起泡性和泡沫稳定性得到了改善(见图3)。随着超声时间的增加,FC和FS先增大后减小。FC由52.7%最大增加到82.5%,FS由71.37%增加到73.57%。试验结果表明,为使蛋白具有较好的起泡性和泡沫稳定性,超声时间应控制在15 min左右。
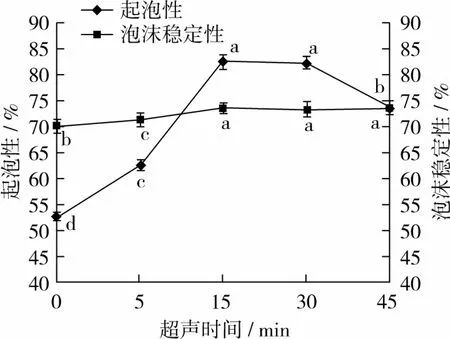
图3 超声时间对RBP起泡性和泡沫稳定性的影响
2.6 表面疏水性分析
蛋白质的表面疏水性是极性水环境中蛋白质表面疏水基团数目的指标,并且与蛋白质的功能性质密切相关。不同超声处理条件下的RBP表面疏水性如表2所示,在0~30 min,表面疏水性逐渐增大,在30 min时达到最大,比对照组提高了15.6%。而随着超声时间的进一步延长,表面疏水性略有下降。这一结果与Gülseren等[15]研究的超声处理能够增加BSA表面疏水性的结论一致。在这项研究中发现,表面疏水与溶解性呈正相关,而王中江等[21]研究表明大豆蛋白的溶解性与疏水性呈负相关。出现这种矛盾的结果可能是因为暴露在蛋白分子表面的疏水基团广泛的参与分子间的作用,降低了蛋白的溶解性。相反的,超声处理后随着蛋白表面疏水性的增加,降低了与分子间的相互作用,并且蛋白粒径减小,故溶解度升高。
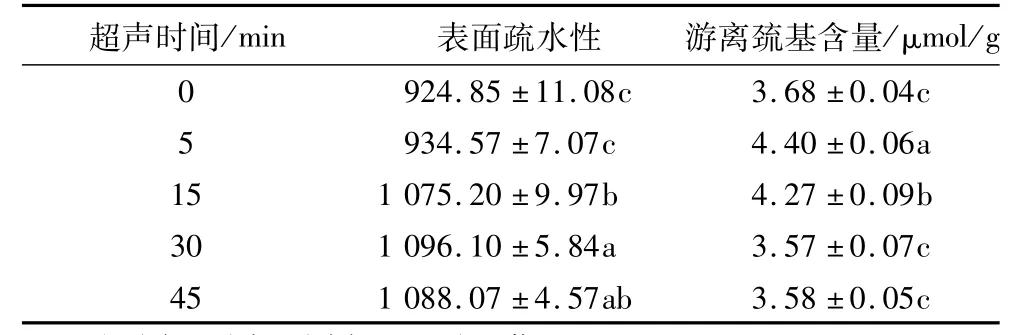
表2 超声时间对RBP表面疏水性及游离巯基含量的影响
2.7 游离巯基含量分析
采用Ellman试剂法对不同超声处理时间的RBP游离巯基含量进行测定,结果见表2。未处理的RBP游离巯基含量为(3.68±0.04)μmoL/g,随着超声时间的延长RBP游离巯基含量先增加后减小。在超声5 min时,游离巯基含量增加了16%,是因为超声处理使蛋白分子展开,更多的巯基暴露于RBP分子表面。Jambrak等[22]报道,超声过程中产生的瞬间高压、液体的湍流运动和空化作用剪切力减小了SPI的粒径,在此过程中使埋藏的巯基暴露出来。随着超声时间的进一步延长,RBP游离巯基含量下降,在30和45 min时的游离巯基含量与未处理蛋白的巯基含量未见显著差异(P<0.05)。巯基含量下降可能是因为超声空化作用产生的过氧化氢与巯基反应(被氧化),并且蛋白局部变性或巯基的增加是短暂的并且是可逆的,这已在牛血清蛋白中被证实[23]。
2.8 亚基组成分析
由于先前的结果显示,超声处理后的RBP的溶解性和表面疏水性增加可能是因为形成了可溶性的蛋白聚集体或蛋白裂解,所以通过还原(样品缓冲液中含巯基乙醇,图4b)和非还原(未加巯基乙醇,图4a)SDS-PAGE判断亚基间是否有二硫键,进而评价不同超声处理时间对RBP分子组成的影响。在非还原状态下,RBP主要亚基的分子质量为53、36、24、21 u(图4a);还原条件下,RBP主要亚基的分子质量为63、53、49、36、<21 u(图4b)。由图4可知,不同超声时间处理的RBP与未处理的RBP的还原和非还原电泳图谱基本一致,表明不同超声处理时间对RBP的亚基组成无影响。这与Karki等[24]对大豆分离蛋白的研究结果一致。由图4a与图4b对比知,在巯基乙醇存在下,RBP大分子聚集体断裂成小分子聚集物和α、α′,并且β′亚基的含量也有增加,但大聚集体仍有部分不能降解。表明构成RBP大聚集体和小分子质量亚基相互作用力以二硫键为主。
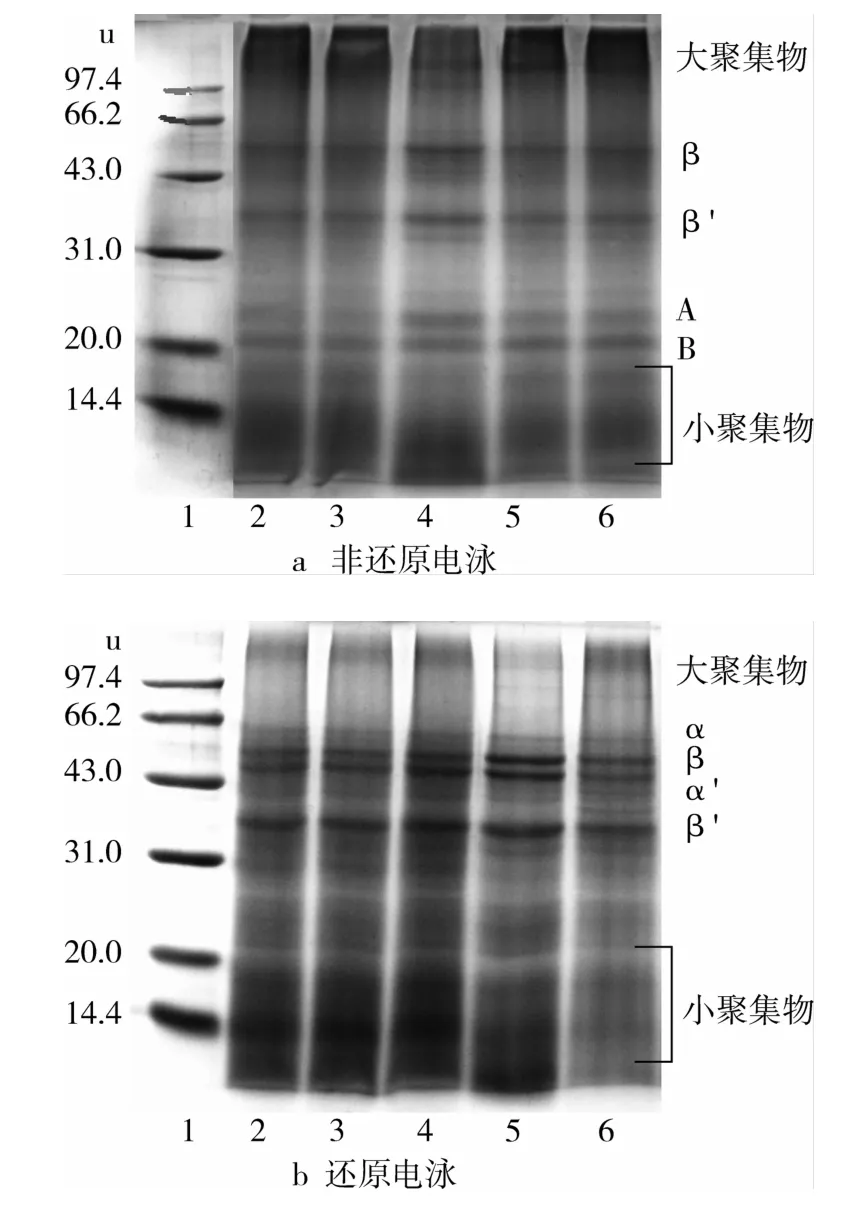
图4 超声时间的RBP的SDS-PAGE电泳
3 结论
与传统方法相比,超声具有低能耗、短时、安全无毒等优点。高强度超声处理的RBP的功能性质如溶解性、乳化性和起泡性有明显的改善,这与分子的变化密切相关,主要表现在表面疏水性的增加和粒径的减小,并且通过紫外和荧光光谱的结果发现,高强度超声处理改变了RBP的空间结构进而影响了其功能性质。但这种处理并没有改变蛋白的亚基组成,但对二级结构的影响还有待于进一步的研究。
[1]郭永,张春红.大豆蛋白改性的研究现状及发展趋势[J].粮油加工与食品机械,2003(7):46-50
[2]Soria A C,Villamiel M.Effect of ultrasound on the technological properties and bioactivity of food[J].Trends in Food Science and Technology,2010,21(7):323-331
[3]Kardos N,Luche J L.Sonochemistry of carbohydrate compounds[J].Carbohydrate Research,2001,332(2):115-131
[4]Chen Lin,Chen Jianshe,Ren Jiaoyan,et al.Effects of ul-trasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J].Journal of Agricultural and Food Chemistry,2011,59(6):2600-2609
[5]杨会丽,马海乐.超声波对大豆分离蛋白物理改性的研究[J].中国酿造,2009(5):24-27
[6]Ashkan M,Zahra E D,Mohamad E M,et al.Acid-induced gelation behavior of sonicated casein solutions[J].Ultrasonics Sonochemistry,2010,17(1):153-158
[7]Kreša G,Lelasb V,Jambrakb A,et al.Influence of novel food processing technologies on the rheological and thermophysical properties ofwhey proteins[J].Journal of Food Engineering,2008,87(1):64-73
[8]Krishnamurthy R,Lumpkin JA,Sridhar R.Inactivation of lysozyme by sonication under conditions relevant tomicroencapsulation[J].Intemational Journal of Pharmaceutics,2000,205(1-2):23-34
[9]刘高梅,任海伟.不同功率超声波对芸豆蛋白理化和功能性质的影响[J].中国粮油学报,2012,27(12):17-21
[10]王威,张月天,曾凡骏.响应面法优化碱法提取大米蛋白工艺[J].粮食与饲料工业,2007(9):20-22
[11]Pedroche J,Yust M M,Lqari H,et al.Brassica carinata protein isolates:chemical composition,protein characterization and improvement of functional properties by protein hydrolysis[J].Food Chemistry,2004,88(3):337-346
[12]Sze-Tao KW C,Sath SK.Functional properties and in vitro digestibility of almond(Prunus dulcis L.)protein isolate[J].Food Chemistry,2000,69(2):153-160
[13]Lagrain B,Brijs K,Delcour JA.Reaction kinetics of gliadine-glutenin cross-linking in model systems and in bread making[J].Journal of Agriculturaland Food Chemistry,2008,56(22):10660-10666
[14]ShiyiQ,Kwok K C,Wang Yong,etal.An improvedmethod to determine SH and-S-S-group content in soymilk protein[J].Food Chemistry,2004,88(2):317-320
[15]Gülseren I,Güzey D,Bruce B D,et al.Structural and functional changes in ultrasonicated bovine serum albumin solutions[J].Ultrasonics Sonochemistry,2007,14(2):173-183
[16]Zhao Guanli,Liu Yan,Zhao Mouming,et al.Enzymatic hydrolysis and their effects on conformational and functional properties of peanut protein isolate[J].Food Chemistry,2011,127(4):1438-1443
[17]Abayomi P A,Ayobamitale O A,Yusuke H,et al.Isolation and characterization of protein fractions from deoiled rice bran[J].European Food Research and Technology 2009,228(3):391-401
[18]Morel M H,Dehlon P,Autran JC,et al.Effects of temperature,sonication time,and power settings on size distribution and extractability of total wheat flour proteins as determined by size-exclusion high-performance liquid chromatography[J].Cereal Chemistry,2000,77(5):685-691
[19]孙冰玉,石彦国.超声波对醇法大豆浓缩蛋白乳化性的影响[J].中国粮油学报,2006,21(4):60-63
[20]孙冰玉,石彦国.超声波对醇提大豆浓缩蛋白起泡性的影响[J].中国食品学报,2006,6(6):100-104
[21]王中江,江连洲,魏冬旭,等.pH值对大豆分离蛋白构象及表面疏水性的影响[J].食品科学,2012,33(11):47-51
[22]Jambrak A R,Lelas V,Mason T J,et al.Physical properties of ultrasound treated soy proteins[J].Journal of Food Engineering,2009,93(4):386-393
[23]Zhou Cunshan,Ma Haile,Yu Xiaojie,et al.Pretreatment of defatted wheat germ proteins(by-products of flourmill industry)using ultrasonic horn and bath reactors:Effect on structure and preparation of ACE-inhibitory peptides[J].Ultrasonics Sonochemistry,2013,20(6):1390-1400
[24]Karki B,Lamsal B P,Grewell D,etal.Functional Properties of Soy Protein Isolates Produced from Ultrasonicated Defatted Soy Flakes[J].Journal of the American Oil Chemists’Society,2009,86(10):1021-1028.

