禽分枝杆菌副结核亚种hsp65与鹅副黏病毒HN融合基因真核表达载体的构建与表达
么乃全,李淑君,姜秀云,马红霞,高云航,王春芳,胡静涛,徐凤宇,胡桂学*
(1.吉林农业大学动物科技学院,长春130118;2.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春130118;3.吉林农业大学生命科学院,长春130118)
鹅新城疫是由鹅副黏病毒(Goose paramyxovirus,GPMV)引起的一种急性、高度接触性传染病,15日龄以内的雏鹅发病率和死亡率可达100%。1997年以来,该病成为了严重危害我国养鹅业的主要疫病之一。目前用于预防鹅新城疫的灭活疫苗成本相对较高,所以有必要研发新的疫苗防治该病。GPMV表面的HN(Hemagglutinin neuraminidase)糖蛋白是其主要保护性抗原之一[1],与经典鸡新城疫病毒株相比,GPMV HN的个别氨基酸有所不同,抗原的差异使针对GPMV疫苗的研究具有重要意义[2]。DNA疫苗具有产生持久免疫应答、制备简单、省时省力、贮存运输方便、应用较安全、诱发细胞免疫和体液免疫等优点,对病毒感染等需要细胞免疫清除病原的疾病预防更为有效[3],但单基因疫苗刺激机体产生免疫应答的能力一般较常规疫苗弱,有必要配合高效的佐剂使用[4-5]。分枝杆菌的热休克蛋白65(Heat shock proteins65,hsp65)是放线菌中特有的蛋白,不但作为主要保护性抗原[6],还可抑制黑色素瘤的生长,减弱肿瘤诱发的血管生成作用[7],并被证明对 C57BL/6小鼠是安全的[8];可通过交叉递呈经MHCI途径提高树突状细胞等对抗原的递呈、加工能力[9],作为分子伴侣发挥免疫佐剂作用,能有效提高小鼠的细胞免疫应答[10-11]。
本研究拟构建含有MAP(Mycobacterium avium subsp.paratuberculosis,禽分枝杆菌副结核亚种)hsp65和GPMV HN融合基因的真核表达载体,转染入Marc-145细胞中进行表达,以期为制备新型的GPMV DNA疫苗奠定基础,也为探索hsp65在病毒DNA疫苗中的分子佐剂作用提供材料。
1 材料与方法
1.1 材料 鹅新城疫病毒 MHK-1株、E.coli DH5α感受态、标准鸡新城疫阳性血清、真核表达载体pVAX1、Marc-145细胞、pMD19-T-hsp65-2(吉林农业大学预防兽医学实验室);pMD19-T载体、Ex Taq DNA 聚合酶、dNTPs、NheⅠ、EcoRⅠ、XbaⅠ、DL2000、DL5000、T4DNA 连接酶、Trizol RNA Reagent(TaKaRa,大连宝生物工程有限公司);梭华-sofast转染试剂盒、FITC标记的兔抗鸡荧光抗体(北京鼎国昌盛生物公司);反转录试剂盒、凝胶纯化回收试剂盒(Trans,全式金生物公司);DMEM高糖细胞培养液、TBD标准胎牛血清(Thermo,赛墨飞世尔生物化学制品有限公司);化学试剂均为国产分析纯。
1.2 HN基因的扩增 参考鹅源新城疫NA-1株、WF0株、JAU04株(GenBank登录号分别为DQ659677.1、FJ754273.2、EF141104.1)的 HN 基因序列设计一对引物,由生工生物(上海)有限公司合成。上游P1∶5’TATGAATTCGACCGCGCGGTTAACA3’(划线部分为 EcoRⅠ酶切位点);下游 P2∶5’GGGTCTAGATTAAATCCCATCATCCTTGAGG3’(划线部分为XbaⅠ酶切位点)。按Trizol RNA Reagen操作说明提取鸡胚尿囊液培养的鹅副黏病毒RNA,RNA反转录成cDNA参照全式金生物公司的反转录试剂盒说明书进行,体系为:模板 RNA 5 μL,Random Primer(0.1 μg/μL)1 μL,2×T - S Reaction Mix 10 μL,RI Enzyme Mix 1 μL,RNase - free Water 3 μL,总体积20 μL。PCR扩增HN基因反应体系:cDNA 2 μL,dNTPs 2.5 μL,上游引物 P1 0.5 μL,下游引物 P2 0.5 μL,10×Ex Taq buffer 2.5 μL,Ex Taq DNA 聚合酶 0.3 μL,ddH2O 16.7 μL,总体积25 μL。反应条件:95℃预变性5 min,94℃变性30 s;57.5 ℃退火30 s,72 ℃延伸1 min,共30 个循环;72℃延伸10 min。反应结束后,取3 μL PCR产物于0.8%琼脂糖凝胶电泳进行鉴定。
1.3 MAP hsp65基因的扩增 根据MAP K-10株(GenBank 登录号:NC_002944.2)、Mycobacterium avium 104株(GenBank登录号:NC_008595.1)hsp65基因的序列设计一对引物,由生工生物(上海)有限公司合成。上游P11∶5’GGCGCTAGCACCATGGCCAAGACAATT3’;(划线部分为 NheⅠ酶切位点)下游 P22∶5’GGCGAATTCAGAGCCTCCACCGAAGTCC3’;(划线部分为EcoRⅠ酶切位点)反应体系:模板 pMD19-T -hsp65-2 2μL,dNTPs 2.5 μL,上游引物 P11 0.5 μL,下游引物 P22 0.5 μL,2×GC buffer 2.5 μL,Ex TaqDNA 聚合酶 0.3 μL,ddH2O 16.7 μL,总体积 25 μL。反应条件:98 ℃预变性5 min;98℃变性1 min,62℃退火1 min,72℃延伸2 min,共35个循环;72℃延伸10 min。反应结束后,取3 μL PCR产物于0.8%琼脂糖凝胶电泳进行鉴定。
1.4 pVAX1-HN、pVAX1-hsp65-HN 真核表达载体的构建 将hsp65和HN基因片段回收纯化后分别与pMD19-T载体连接,产物转化E.coli DH5α感受态细胞,挑取阳性克隆,提取质粒,进行酶切及PCR鉴定,并送生物工程(上海)有限公司测序。
鉴定正确后,用限制性内切酶XbaⅠ和EcoRⅠ双酶切克隆质粒pMD19-T-HN和载体pVAX1。回收、纯化HN基因和pVAX1线性质粒,用T4DNA连接酶连接,转化E.coli DH5α感受态细胞,挑取阳性克隆,提取质粒pVAX1-HN,酶切及PCR鉴定。
将酶切及PCR鉴定正确的pVAX1-HN用限制性内切酶NheⅠ和EcoRⅠ双酶切pVAX1-HN和pMD19-T-hsp65。回收、纯化 hsp65基因和pVAX1-HN线性质粒,用T4DNA连接酶连接,转化E.coli DH5α感受态细胞,挑取阳性克隆,提取质粒,进行酶切及PCR鉴定。
1.5 重组表达质粒转染Marc-145细胞 在转染前20 h,消化Marc-145单层细胞,转入6孔板(孔底装有处理过的盖玻片),每孔6×105个细胞,待细胞铺板密度在75%时进行转染。
梭华-sofast/DNA复合物的制备:分别将2 μg pVAX1-HN、pVAX1-hsp65-HN、pVAX1质粒分别稀释于不含血清和抗生素的DMEM中,使混合液的终体积均为100 μL;18 μL脂质体分别稀释于不含血清和抗生素的DMEM中,使混合液的终体积均为300 μL,轻轻混匀;将100 μL 脂质体稀释液滴加到100 μL质粒稀释液中,边加边混匀;室温孵育20 min,将200 μL梭华-sofast/DNA复合物加入到6孔板中,轻轻摇动使均匀混合,置37℃培养48 h。
1.6 表达产物的检测 取出细胞爬片,用pH为7.2的PBST溶液漂洗细胞3次,加入预冷的80%丙酮,固定30 min;用PBST液洗3次;5%脱脂奶粉封闭2 h,弃封闭液,PBST液洗3次;加入10倍稀释的鸡新城疫标准阳性血清,37℃孵育1 h,PBST液洗3次;加1000倍稀释好的兔抗鸡荧光抗体,37℃温箱中避光孵育1 h,PBST液洗3次后,取出细胞爬片,在荧光显微镜下观察并照相。在转染后的细胞中加入Trizol,提取RNA、反转录后PCR检测,方法如1.2、1.3 项。
2 结果
2.1 HN及hsp65的PCR扩增 以hsp65基因的P11/P22为引物、pMD19-T-hsp65-2为模板PCR扩增hsp65基因,以HN基因的P1/P2为引物、鹅新城疫病毒鸡胚尿囊液的反转录产物cDNA为模板PCR扩增HN基因,扩增产物经0.8%琼脂糖凝胶电泳分析,分别可见约1600、1700 bp的DNA片段,与预期片段大小相符(图1)。
2.2 HN及hsp65基因的克隆及酶切鉴定 回收纯化后的HN、hsp65 PCR产物与pMD19-T连接,分别构建克隆质粒pMD19-T-HN、pMD19-T- hsp65,酶切、PCR结果说明所克隆序列与目的片段大小相近(图2、图3)。
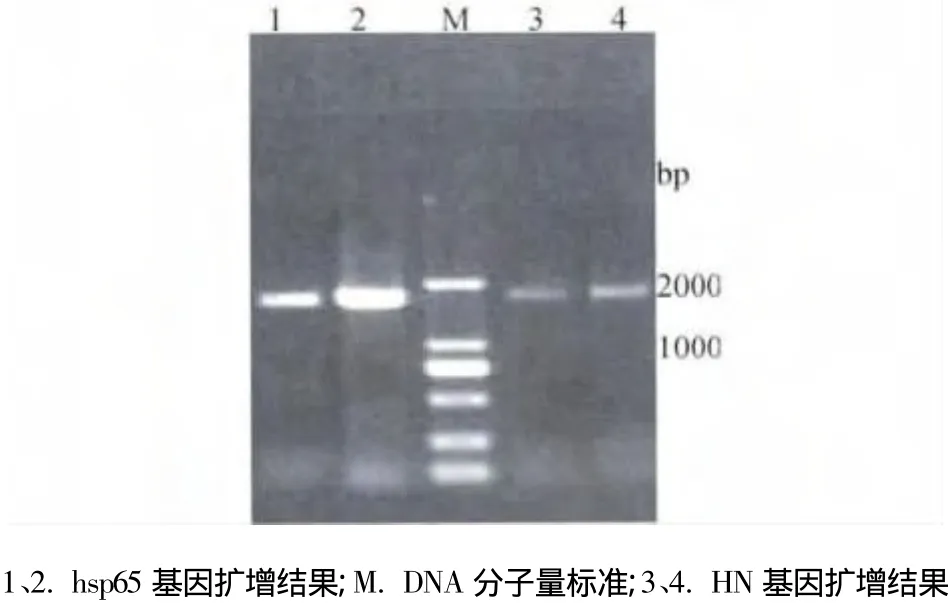
图1 hsp65和HN基因的PCR扩增结果

图2 重组质粒pMD19-T-HN酶切及PCR鉴定结果
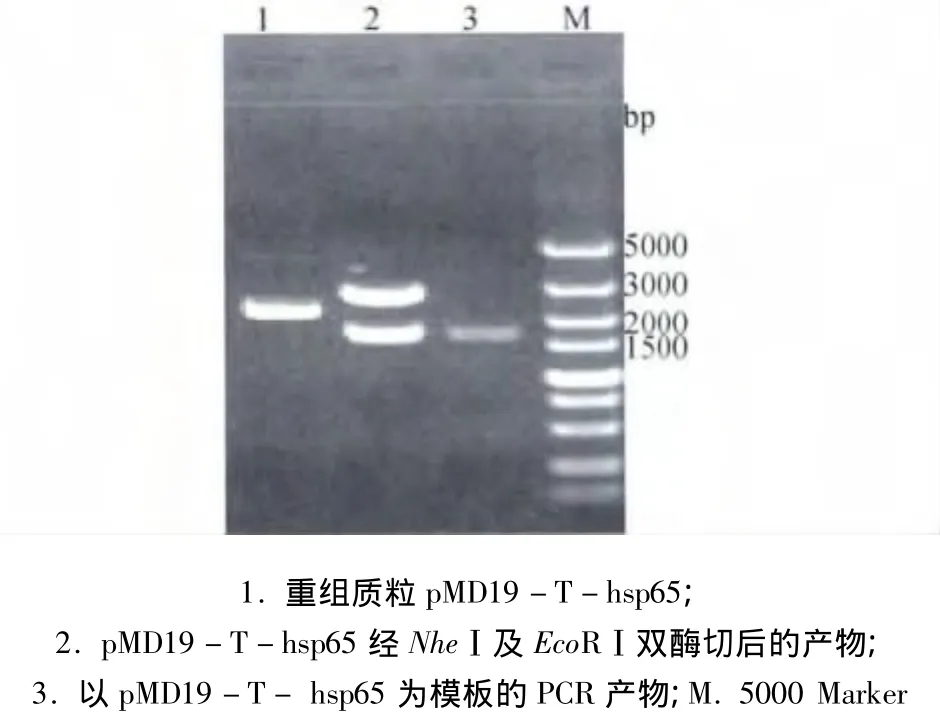
图3 重组质粒pMD19-T-hsp65酶切及PCR鉴定结果
2.3 系统进化分析 测序结果表明分别得到了1731、1626 bp的片段,应用DNAman软件,将所得HN序列(GHN)、hsp65(CDhsp65)序列分别与GenBank中相关11、12株序列(登录号见图4、图5)进行比对,发现GHN与EF141104亲缘关系最近,同源性为99%;CDhsp65与AE016958亲缘关系最近,同源性为98.68%。说明已成功克隆到了HN、hsp65基因。

图4 HN基因的系统进化分析

图5 hsp65基因的系统进化分析
2.4 真核表达质粒的构建及鉴定 重组质粒pVAX1-hsp65-HN经EcoRⅠ及XbaⅠ双酶切后得到约1700 bp和4500 bp的条带,经 NheⅠ及EcoRⅠ双酶切后得到约1600 bp和4600 bp的条带,经NheⅠ及XbaⅠ双酶切后的产物得到约3300 bp和3000 bp的条带,PCR鉴定结果也获得了约1700 bp和1600 bp的条带,说明成功构建了重组真核表达质粒pVAX1-hsp65-HN(图6)。
2.5 RT-PCR鉴定转染结果 提取转染质粒pVAX1-HN、pVAX1-hsp65-HN并培养后的Mack-145细胞的总RNA,得到如图7所示的28s、18s、5s 3条带。以提取的细胞总RNA反转录后的cDNA为模板,分别以hsp65基因的P11/P22、HN基因的P1/P2为引物进行PCR扩增,得到了相应大小DNA片段(图8),而以提取的空载体pVAX1转染的Mack-145细胞总RNA反转录后的cDNA为模板PCR后则未见相应条带,从转录水平上说明了hsp65、HN两基因在Mack-145细胞中获得了表达。

图6 重组质粒pVAX1-hsp65-HN酶切及PCR鉴定结果

图7 pVAX1-hsp65-HN和pVAX1-HN转染Marc-145细胞RNA提取结果

图8 pVAX1-hsp65-HN和pVAX1-HN转染Marc-145细胞RT-PCR结果
2.6 表达产物的免疫荧光鉴定 转染48 h后,用荧光显微镜观察,重组质粒pVAX1-HN、pVAX1-hsp65-HN转染的Marc-145细胞均可见绿色荧光(图9 A、B),而pVAX1转染的Marc-145细胞中未见荧光(图9 C),从蛋白水平上表明HN基因在Marc-145细胞中获得了表达。本研究将hsp65基因插于启动子和HN基因之间,所以对于质粒pVAX1-hsp65-HN而言,HN的表达也间接说明了hsp65的表达。

图9 真核表达载体转染Marc-145细胞后间接免疫荧光检测结果(200×)
3 讨论
从遗传学方面分析,目前流行的基因Ⅶ型副黏病毒与经典的新城疫病毒存在抗原差异[12],推测此差异是应用传统新城疫弱毒疫苗预防本病效果不甚理想的原因之一,所以应用新的临床分离株研制疫苗对于鹅新城疫的防控更有意义。本研究也表明所用毒株MHK-1(临床分离强毒株,另文报道)的HN基因与亲缘关系最近的吉林省鹅源JAU04株(登录号:EF141104.1)有1个氨基酸的差异,与山东农业大学分离的鸡源ytan-2-01株(登录号:AAY56372.1)有5个氨基酸的差异,与中国农业大学分离的鸡源AG/Tianjin/07株(登录号:ACM67336.1)有13个氨基酸的差异,与LaSota株的核苷酸同源性仅为80.33%。
在本研究过程中发现,将构建的重组质粒pVAX1-hsp65-HN、pVAX1-HN分别转染到Marc-145细胞后,已经铺满爬片的细胞有部分脱落,使致密的细胞间出现较大空隙,而空载体转染组无此现象。推测可能是HN表达于细胞表面后,通过血凝素位点与细胞表面的唾液酸结合,使细胞表面的负电荷减少的缘故,这也是HN作为NDV抗肿瘤的主要功能蛋白的作用之一;但研究也表明新城疫病毒对肿瘤细胞的杀伤、裂解是有选择性的,对正常细胞无杀伤作用[13],而本研究的后续试验也证实,所构建的上述质粒对BALB/c鼠和吉林白鹅是安全的。
本研究通过酶切和PCR证实,成功构建了真核表达质粒pVAX1-HN、pVAX1-hsp65-HN;转录水平和蛋白水平上均可检测到pVAX1-HN、pVAX1-hsp65-HN在Marc-145细胞中的表达,为进一步研究真核重组表达质粒pVAX1-hsp65-HN作为DNA疫苗及hsp65的免疫佐剂作用奠定了基础。
[1]Miller P J,Afonso C L,Spackman E,et al.Evidence for a new avian paramyxovirus serotype 10 detected in 571 rockhopper penguinsfrom the Falkland Islands[J].Virol,2010,573(21):496-504.
[2]Kapczynski D R,King D J.Protection of chickens against overt clinical disease and determination of viral shedding following vaccination with commercially available Newcastle disease virus vaccines upon challenge with highly virulent virus from the California 2002 exotic Newcastle disease outbreak[J].Vaccine,2005,23(34):24-33.
[3]Vogel F R,Sarver N.Nucleic acid vaccines[J].Clin Microbiol Rev,1995,8(3):406-410.
[4]侯俊玲,郑亚东,景志忠,等.DNA疫苗免疫佐剂的研究进展[J].中国兽医科技,2005,35(2):153-156.
[5]Sawant P M,Verma P C,Subudhi P K,et al.Immunomodulation of bivalent Newcastle disease DNA vaccine induced immune response by co-delivery of chicken IFN-γ and IL-4 genes[J].Veterinary Immunology and Immunopathology,2011,144:36-44.
[6]Okada M,Kita Y.Anti- tuberculosis immunity by cytotoxic T cells granulysin and the development of novel vaccines(HSP-65 DNA+IL-12 DNA)[J].Kekkaku,2010,85(6):531-538.
[7]Yang J,Xie Y,Wang H,et al.Administration of heat shock protein 65 inhibits murine melanoma growth in vivo[J].Mol Med Report,2012,6:1167.
[8]孙 琳,吴秀丽,王丽颖.hsp65-MUC1肿瘤疫苗对小鼠胰腺组织的分子模拟作用[J].吉林大学学报(医学版),2011,37(1):15-17.
[9]Chen K,Lu J,Wang L,et al.Mycobacterial heat shock protein 65 enhances antigen cross-presentation in dendritic cells independent of Toll-like receptor 4 signaling[J].Epub,2004,75(2):260 -266.
[10]Hua Wang,Xuejin Su.Recombinant heat shock protein 65 carrying PADRE and HBV epitopes activates dendritic cells and elicits HBV-specific CTL responses[J].Vaccine,2011,29:2328 -2335.
[11]靳彦文,曹 诚,李 平,等.热休克蛋白65增强小鼠对HBV DNA疫苗免疫反应的研究[J].军事医学科学院院刊,2006,30(1):11-14.
[12]李志杰,丁 壮,毕玉海,等.鹅源副黏病毒NA-1株与鸡新城疫病毒 F48E9株的抗原变异关系分析[J].中国兽医学报,2008,28(3):235-238.
[13]P V Ravindra,AshokK Tiwari,Bhaskar Sharma,et al,Newcastle disease virus as an oncolytic agent[J].Indian J Med Res,2009,130(11):507-513.

