苦参碱的提取纯化工艺研究
郭德祥,郭亚楠,李向阳
(国家兽用药品工程技术研究中心,河南洛阳471003)
苦参为豆科植物苦参(Sophora flavescens Ait.)的干燥根,具有清热燥湿、杀虫利尿的功效[1-2],临床上常用于治疗猪感冒、无名高热,仔猪白痢,家兔疥癣,鸡球虫病等。现代研究表明,苦参主要的有效成分为苦参碱、氧化苦参碱等生物碱[3],本研究采用最为方便、易于工业化生产的水煎煮法,以浸膏得率、苦参碱提取率为评价指标,通过正交试验筛选苦参提取的最佳工艺条件,为新药研究和充分利用苦参药材资源提供理论依据。
1 仪器与材料
1.1 仪器 依利特高效液相色谱仪(P230型高压输液泵;UV230型检测器;EC2000色谱工作站);ZORBAX NH2色谱柱,4.6 mm ×250 mm,5 μm(Agilent公司,美国);Ab265-s电子分析天平(梅特勒-托利多公司,瑞士)。
1.2 仪器 苦参,购自洛阳康鑫中药饮片公司,符合《中华人民共和国兽药典》二○一○年版二部苦参项下的有关规定[4];苦参碱对照品,批号:110805-200507,由中国药品生物制品检定所提供;乙腈为色谱纯,水为重蒸水,其他试剂均为分析纯。
2 方法与结果
2.1 含量测定方法 色谱条件与系统适用性试验:ZORBAX NH2柱(4.6 mm ×250 mm,5 μm);以乙腈-无水乙醇-3%磷酸溶液(80∶10∶10)为流动相;检测波长为220 nm。理论板数按苦参碱峰计算应不低于1500。
线性范围考察:精密称取苦参碱对照品20.9 mg于100 mL容量瓶中,加乙腈-无水乙醇(80:20)溶解、定容,制成浓度为209 μg/mL的储备液,将上述储备液用乙腈-无水乙醇(80∶20)稀释成浓度分别为 104.5、52.2、26.1、13.1 μg/mL 的对照品溶液,分别精密吸取上述5个不同浓度的对照品溶液10 μL,以峰面积(Y)与对照品浓度(X)进行线性回归,回归方程为 Y=4396.7X -0.8696,r=0.9999。表明在 0.13 ~2.09 μg范围内,线性关系良好。
对照品溶液的制备:精密称取5 mg苦参碱对照品于100 mL容量瓶中,加乙腈-无水乙醇(80∶20)溶解定容,制成每1 mL含苦参碱0.05 mg的溶液,即得。
供试品溶液的制备:精密称取10 mg干燥物甲醇超声溶解,并定容于10 mL容量瓶中,即得。
测定法:分别精密吸取对照品溶液与供试品溶液各10 μL,注入液相色谱仪,测定。
2.2 正交试验法提取苦参碱
2.2.1 苦参碱提取工艺条件的选择[5]采用水煎煮法进行提取,以用水量、提取时间和提取次数为3个因素,设计3个水平,进行L9(34)正交试验,筛选最佳工艺条件。因素水平表见表1。
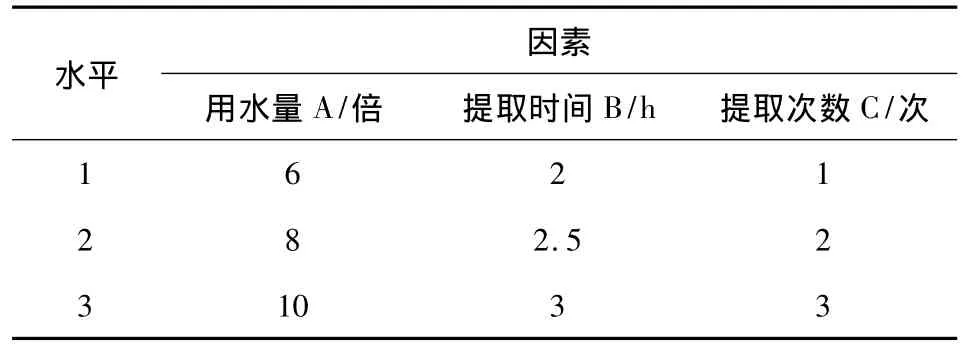
表1 因素水平表
2.2.2 考察指标的确定和测定 苦参碱为苦参的主要有效成分,将其作为考察指标,同时结合浸膏收率优选最佳工艺。分别称取苦参药材9份各100 g,按照L9(34)正交表2设计的条件进行煎煮,合并煎煮液,滤过,滤液浓缩,置已恒重的蒸发皿中,水浴蒸干,70℃减压干燥至完全干燥后,称重并计算浸膏收率(浸膏收率%=浸膏重量/样品重量×100%),结果见表2。
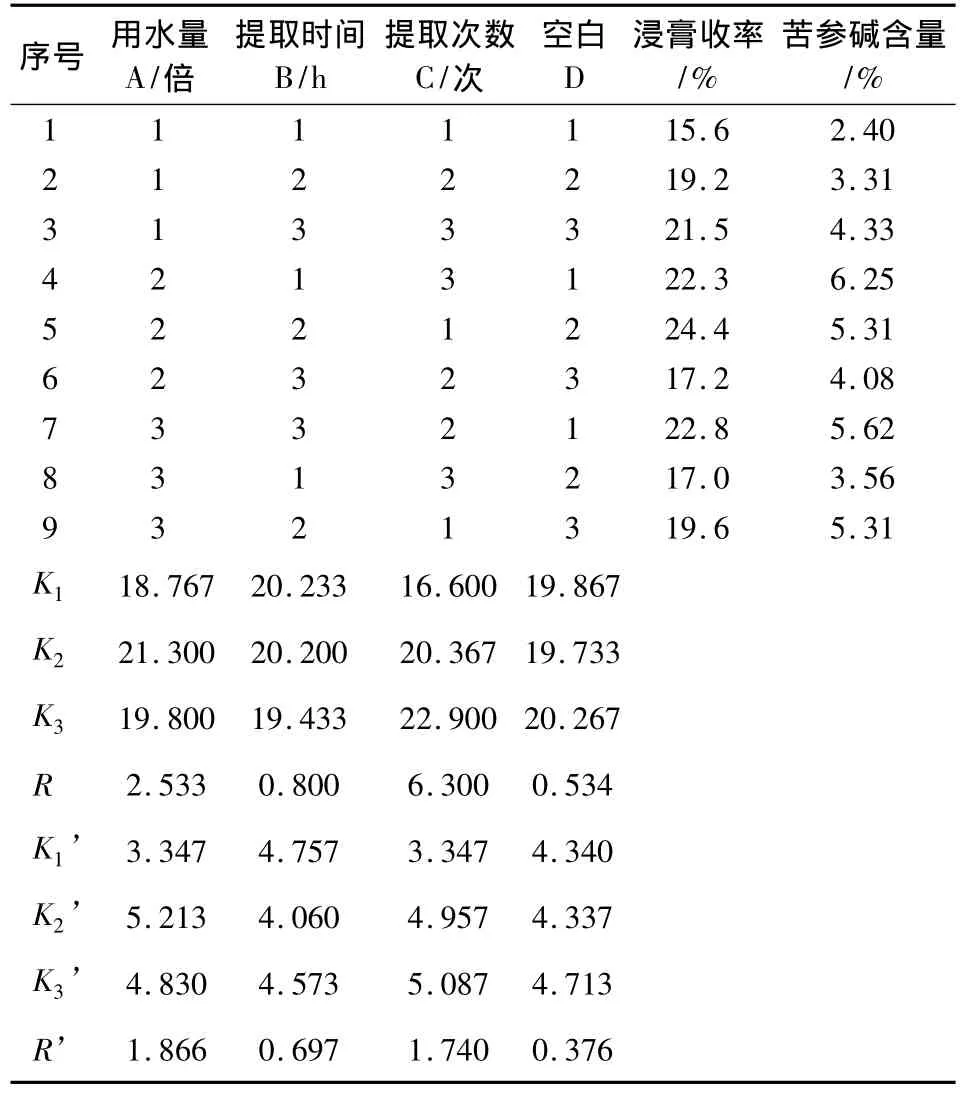
表2 正交试验结果
由表2直观分析可知,以浸膏收率为评价指标时,在所考察的影响因素中,重要性依次为C>A>B;以苦参碱含量为评价指标时,在所考察的影响因素中,重要性依次为A>C>B。得到最佳工艺条件A2B1C3。
以浸膏收率为指标方差分析结果表明,以浸膏收率作为评价指标时,C因素具有显著意义,A因素和B因素均无显著意义(表3);以苦参碱含量为指标方差分析结果表明,以苦参碱含量作为评价指标时,A因素、B因素和C因素均无显著意义。综合考虑环保节能因素,确定最佳提取工艺条件为A2B1C3,即加8倍量水提取3次,每次提取2 h(表4)。
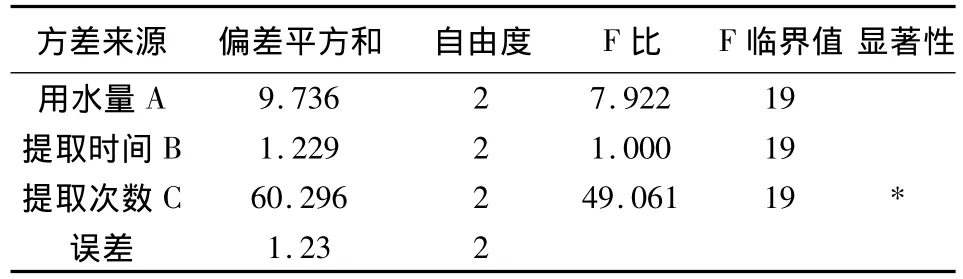
表3 以浸膏收率为指标方差分析结果
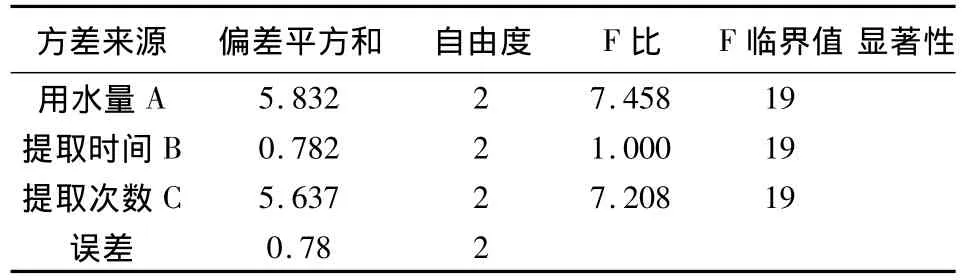
表4 以苦参碱含量为指标方差分析结果
2.2.3 验证试验 称取苦参药材3份,按正交试验优选的最佳提取工艺进行放大验证试验,即加8倍量水提取3次,每次提取2 h。三次验证试验干膏收率(%)分别为 22.4、22.0、22.1,苦参总碱含量(%)分别为 6.08、5.94、5.87;干膏收率(%)和苦参总碱含量(%)的平均值分别为 22.2、5.94。验证试验结果表明正交设计筛选出的最佳提取工艺条件重现性良好,说明此工艺稳定、可行。
2.3 苦参碱纯化工艺的优化 苦参提取之后,除有效成分外,还含有较多的淀粉等杂质,而这些杂质将影响其质量,因此需要对粗提物进行纯化。本文采用乙醇沉淀及三氯甲烷萃取相结合的方法对苦参粗提物进行纯化。
2.3.1 乙醇沉淀 取苦参提取液浓缩成1.0、1.5、2.0 g生药/mL,每份取相当于生药100 g,加乙醇使含醇量达75%,4℃冷藏,上清液回收乙醇,比较不同药液浓度对收膏率及苦参碱含量的影响,结果见表5。
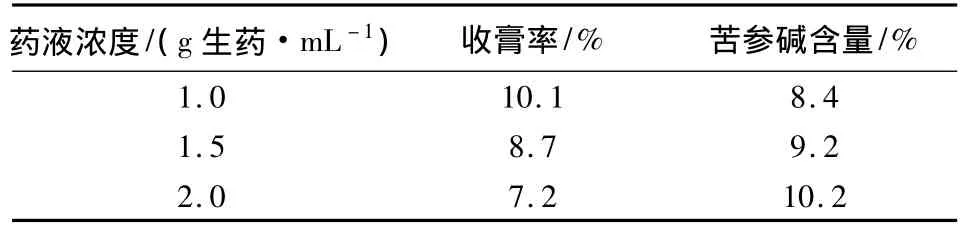
表5 不同药液浓度对收膏率及苦参碱含量影响的比较
从表中可以看出,当药液浓度为1.0 g生药/mL时,收膏率高,从苦参碱含量比较,当药液浓度为2.0 g生药/mL时,苦参碱的含量较高,但是此时收率比较低。综合考虑收膏率及苦参碱含量,选择将药液浓缩至1.0 g生药/mL进行醇沉。
2.3.2 三氯甲烷萃取 利用生物碱的碱性,将苦参提取液中生物碱加碱碱化,用三氯甲烷萃取,回收三氯甲烷,即可得到纯度较高的生物碱。
取经苦参醇沉并回收乙醇后的药液3份,每份相当于生药 100 g,加水至1 mL∶1.5 g生药,用20%氢氧化钠溶液调pH值至11,用三氯甲烷分别萃取1、2、3次,比较不同萃取次数对收膏率及苦参碱含量的影响,结果见表6。
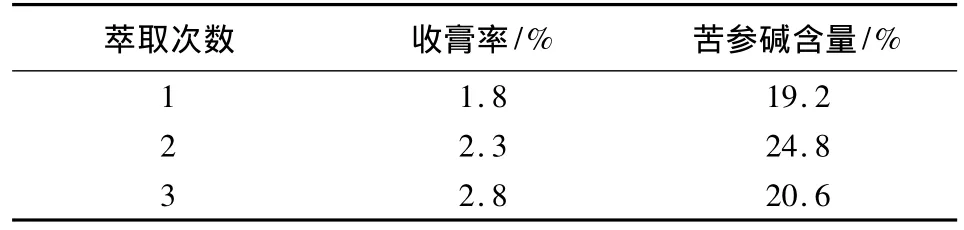
表6 萃取次数的比较
从表中可以看出,萃取3次,收膏率高,从苦参碱含量比较,药液萃取2次,苦参碱的含量较高,但此时收率相对较低。综合考虑收膏率及苦参碱含量,选择萃取3次。
2.3.3 pH的考察 取经苦参醇沉并回收乙醇后的药液3份,每份取相当于生药100 g,加水至1 mL∶1.5 g生药,分别用20%氢氧化钠溶液调pH值至9、10、11,用三氯甲烷各萃取3次,比较不同pH值对收膏率及苦参碱含量的影响,结果见表7。
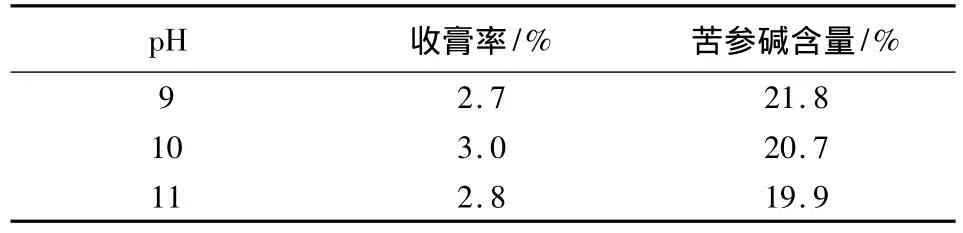
表7 不同pH值的比较
从表中可以看出,调整pH值至9~11,对收膏率及苦参碱含量影响不明显。因此,萃取时调节药液的pH值至9~11。
2.3.4 批验证试验 称取苦参粗提物3份各1 kg,按照筛选出的最佳纯化工艺进行放大验证试验。验证试验结果无显著性差异,说明该工艺稳定、可行。
3 讨论与小结
苦参粗提物被20%氢氧化钠溶液碱化后,生物碱被游离出来,易被三氯甲烷等溶剂萃取,但生物碱还能与苦参粗提物中的淀粉等杂质生成不溶或难溶沉淀,同时非碱溶性物质也析出,形成咖啡色沉淀,包埋并带走部分生物碱,造成生物碱的损失。所以采用乙醇沉淀及三氯甲烷萃取相结合的方法先除去苦参粗提物中的淀粉等杂质。
苦参药材用8倍量水提取3次,每次提取2 h,合并药液并浓缩至1.0 g生药/mL时进行醇沉,醇沉后调节药液的pH值为9~11,并用三氯甲烷萃取3次。优选出的提取、纯化工艺稳定、可行,可用于苦参碱的工业化提取。
[1]刘 梅,刘雪英,程建峰.苦参碱的药理研究进展[J].中国中药杂志,2003,28(9):801-804.
[2]李 燕,何立人.苦参碱类生物碱的心血管系统药理研究[J].中草药,2000,31(3):227-229.
[3]马方励,程 怡.苦参碱多种制剂的药效学研究进展[J].中成药,2004,26(5):420-422.
[4]中国兽药典委员会.《中华人民共和国兽药典》二○一○年版二部[S].
[5]邓丽琴.苦参中苦参碱提取工艺研究[J].时珍国医国药,2006,17(2):233-234.
- 中国兽药杂志的其它文章
- 猪瘟疫苗田间免疫效果监测
- 猪瘟母源抗体衰减及保护水平分析

